人冠状病毒229E 寒湿疫毒袭肺证病证结合小鼠模型的建立及评价
2022-02-21耿子涵包蕾郭姗姗时宇静鲍岩岩赵荣华孙静高英杰崔晓兰
耿子涵包 蕾郭姗姗时宇静鲍岩岩赵荣华孙 静高英杰崔晓兰
(中国中医科学院中药研究所,北京 100700)
病毒性肺炎是由病毒引起的单侧或双侧肺部炎性病变。 基于上千年的经验和积累,中医药在历次病毒性肺炎疫情的防治中发挥了重要的作用,在缓解临床症状、缩短疗程、促进治愈等方面取得了良好的效果。 不论是缓解急性重症呼吸综合征(severe acute respiratory syndrome, SARS)的急性早期症状[1],在甲型H1N1 流感的辨证治疗[2],还是在新型冠状病毒性肺炎(corona virus disease 2019,COVID-19)疫情中[3-7],复方中药或中成药均在临床应急治疗中发挥了积极作用。
与此同时,提供实验数据与临床相互验证,也显得尤为重要,这对有效药物的筛选、寻找其作用靶点、进一步推动中医药在临床应用具有现实意义。 考虑到中医药治疗的特点是并不针对某一特定病毒,而是基于对其病因病机的认识进行辨证论治,主要注重机体整体状态、特别是对机体免疫状态的调节[8],建立符合中医药特点的病毒感染动物模型十分必要。 中药药效评价的模型着重于中医证候、疾病表现与临床症状的一致性,而不局限于特定的病毒感染。 由寒、湿之邪导致的“寒湿疫毒袭肺证”是一种可见于病毒性肺炎早期的中医证候[9-11],在本研究中,我们以寒湿疫毒袭肺证以及病毒性肺炎疾病的典型临床表现作为参照,使用人冠状病毒229E(hCoV-229E)叠加寒湿刺激的方法,建立hCoV-229E 寒湿疫毒袭肺证病证结合模型,对病毒的感染条件和模型小鼠的表现进行摸索和评价,为治疗以该证候为表现的肺炎的有效药物筛选和临床应用提供源自动物实验的科学数据。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
72 只 21 ~ 28 日龄 BALB/c 小鼠,SPF 级,雌雄各半,体重(14±1)g,购自北京维通利华实验动物技术有限公司[SCXK(京)2021-0006]。 小鼠饲养于中国中医科学院中药研究所ABSL-2 实验室[SYXK(京)2019-0003]。 所有动物实验均遵循美国国立卫生研究院(NIH)及北京市实验动物伦理委员会的规定,经过中国中医科学院中药研究所动物伦理委员会批准(2020D007),实验遵循3R 原则。
1.1.2 细胞
人肺癌细胞系A549(BNCC337696)、人胚肺成纤维细胞系MRC-5(BNCC338054),均购自北京北纳创联生物技术研究院。
1.1.3 病毒株
hCoV-229E 毒株由中国医学科学院医药生物技术研究所提供,由中药研究所BSL-2、ABSL-2 实验室保存及传代。
1.2 主要试剂与仪器
胎牛血清(fetal bovine serum, FBS),批号35081003,Dulbecco’s modified Eagle’s(DMEM)培养基,批号 33218004,磷酸盐缓冲液(phosphate buffer solution, PBS),批号18919010,均购自美国康宁公司;青霉素链霉素双抗(Penicillin Streptomycin,PS),批号1796440,胰蛋白酶,批号2048080,均购自美国Gibco 公司;甲醛溶液,批号 F20180825,二甲苯,批号20170705,购自国药集团化学试剂有限公司; QIAamp 病 毒 RNA 纯 化 试 剂 盒, 批 号163052733,购自凯杰企业管理上海有限公司;TRIzol Reagent,批号257403,购自美国 Life 公司;Human Coronavirus(hCoV-229E)Real time RT-PCR kit,批号P20191201,购自上海之江生物科技股份有限公司;Mouse Gas ELISA Kit,批号02/2020,Mouse MTL ELISA Kit,批号02/2020,均购自上海酶联生物技术有限公司;Mouse IL6 ValukineTMELISA Kit,批号951928,Mouse IL10 ValukineTMELISA Kit,批号185314, Mouse TNF-α ELISA Kit, 批 号 266117,Mouse INF-γ ELISA Kit,批号 352764,均购自美国bio-techne 公司;无水乙醇,批号20180208,伊红,批号20150915,购自北京化工厂;4%细胞组织固定液,批号DE0094,购自北京拜尔迪生物技术有限公司;苏木素染色液,批号DH0001/0405A17,购自北京博瑞捷科技有限公司;PerCP-Cyanine5.5 标记抗小鼠CD4(RM4-5),批号65-0042,APC 标记抗小鼠CD8a(53-6.7),批号 20-0081,PE 标记抗小鼠 CD19(1D3), 批 号 50-0193, 红 细 胞 裂 解 液, 批 号B4300083019TN,均购自美国 TONBO biosciences公司。
验证用药使用《新型冠状病毒肺炎诊疗方案(试行第八版)》中的寒湿疫方[12-13],组成为:生麻黄6 g、生石膏15 g、杏仁 9 g、羌活 15 g、葶苈子15 g、贯众 9 g、地龙 15 g、徐长卿 15 g、藿香 15 g、佩兰9 g、苍术15 g、云苓45 g、生白术30 g、焦三仙9 g、厚朴15 g、焦槟榔9 g、煨草果9 g、生姜15 g,由中国中医科学院中药研究所中药药理研究中心制备,批次20200318。 给药量根据 Meeh-Rubner 公式,以人体给药剂量推算小鼠的等效剂量,生药量105.6 g/(kg·d)为临床2 倍剂量,52.8 g/(kg·d)为临床等倍剂量。
A2 型生物安全柜,型号MCS-Advantage 1.8,购自美国Thermo 公司;智能人工气候箱,型号RXZ-380B,购自宁波江南仪器厂;电子分析天平,型号AR1140 MAX110 g,购自美国 Ohaus 公司;电子天平,型号AL204 MAX210 g,购自梅特勒-托利多仪器(上海)有限公司;IVC 小鼠饲养笼,型号ZJ-4,购自苏州市冯氏实验室动物设备有限公司;Buxco 小鼠雾 化 吸 入 系 统, 购 自 美 国 DSI; 离 心 机, 型 号Centrifuge 5430,购自德国Eppendorf 公司;石蜡包埋机,型号EG 1140 H,自动染色机,型号XL 5010,购自德国Leica 公司;全自动轮转式切片机,型号HM 355 S,购自德国Microm 公司;全景组织定量分析系统, 型 号 Tissue FAXS Plus, 购 自 奥 地 利TissueGnostics 公司;小动物 Micro-CT,型号 Inveon MM,购自德国 Siemens 公司。 Real-time PCR 仪,型号QuantStudio 5,购自美国Applied biosystems 公司;八连排管迷你离心机,型号LX-300,迷你涡旋振荡器,型号OL-901,均购自海门市其林贝尔仪器制造有限公司;多功能酶标仪,型号Enspire,购自德国PerkinElmer 公司;流式细胞仪,型号Accuri C6 Plus,购自美国BD 公司。
1.3 方法
1.3.1 病毒株传代与感染
病毒液接种在A549 细胞中,在细胞维持培养基(含2% FBS 的培养基)中培养72~96 h 并观察细胞病变,并将细胞及培养液于-80℃下冻融后取上清,采用Reed-Muench 法梯度稀释病毒,测定半数组织培养感染剂量(median tissue culture infective dose, TCID50)[14],分装保存于-80℃。 在验证小鼠肺组织中是否存在活病毒的实验中,取各组小鼠的全肺组织与 PBS 进行匀浆,取匀浆上清接种于MRC-5 细胞,镜下观察细胞病变情况。 所有病毒相关实验均在生物安全柜中操作。
1.3.2 hCoV-229E 寒湿疫毒袭肺证病证结合小鼠模型的建立
将模型组小鼠置于人工气候箱中,(4±2)℃,相对湿度(90±3)%,每天放置4 h 至实验结束,首次放置为第1 天。 于第5、6 天轻度麻醉小鼠,取生理盐水稀释的病毒悬液,以100 倍TCID50、体积为50 μL的病毒稀释液滴鼻感染BALB/c 小鼠。 相应的50 μL 正常细胞培养上清用于正常组小鼠滴鼻。 以仅放置于人工气候箱中的小鼠作为寒湿对照,以正常环境下饲养的感染小鼠作为感染对照,以正常环境下饲养且未进行病毒感染的小鼠作为正常对照。在造模期间对各组小鼠寒湿疫毒袭肺证相关的行为表征进行评价,并于第8 天进行肺指数、肺组织病毒载量、肺部CT、肺组织中的炎性细胞因子、外周血淋巴细胞百分比等的检测。
1.3.3 寒湿疫毒袭肺证相关行为表征的评价
造模后,分别于第 2、4、6、8 天进行行为表征观察和评分,包括行为状态(扎堆不动=1,少动=2,适度活动=3,活跃=4,兴奋多动=5),精神状态(迟滞=1,倦怠=2,适度=3,易激惹=4,躁怒=5),皮肤毛发状态(枯乱=1,不泽=2,顺泽=3,潮湿=4,油腻=5),粪便状态(便硬结=1,干燥=2,适宜=3,粘腻=4,便溏=5),并于第7~8 天测定平均食物和水摄入量(计算方法为摄食或饮水总量/该组小鼠数量)。
1.3.4 小鼠肺组织病理分析
将在细胞组织固定液中固定后的小鼠肺组织用乙醇和二甲苯进行脱水,并进行石蜡包埋。 将蜡块切为4~6 μm 的切片,置于载玻片,烤片烘干。 石蜡切片经苏木素-伊红(hematoxylin-eosin, HE)染色后,于光学显微镜下观察肺组织病理变化并拍照。根据组织病理学改变,对各组小鼠肺组织进行评分,其中,无炎性渗出、水肿、明显出血红染=0,肺间质有轻度炎性渗出,肺细支气管及周围无明显炎症=1,肺间质轻度渗出炎症,有少量出血红染,肺细支气管周围轻度炎性渗出=2,肺间质出血红染,伴肺泡塌陷、组织水肿、炎性渗出=3。
1.3.5 hCoV-229E 核酸提取与扩增
取小鼠左肺组织,使用TRIzol Reagent 提取肺组织RNA。 使用hCoV-229E Real time RT-PCR Kit,按说明书操作进行HCoV-229E 核酸的扩增,采用QuantStudio 5 Real-time PCR 仪进行荧光信号检测。其中FAM 通道Ct 值小于等于38 h 为病毒RNA 阳性,并根据试剂盒中阳性对照品的标准曲线计算病毒载量。
1.3.6 酶联免疫吸附试验( enzyme linked immunosorbent assay, ELISA)
取小鼠血清,按ELISA 试剂盒操作说明检测小鼠血清中的胃动素、胃泌素水平。 取小鼠右肺肺组织50 mg 置于2 mL PBS 中进行超声匀浆,取匀浆上清,按ELISA 试剂盒操作说明检测肺组织中白细胞介素-6(interleukin-6, IL-6)、IL-10、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α )、 γ 干 扰 素(interferon-γ, IFN-γ)水平。 使用酶标仪检测 450 nm 处的吸光度值,并根据标准曲线及样品稀释倍数计算上述各指标的浓度。
1.3.7 流式细胞术
取抗凝小鼠全血150 μL,按流式抗体及红细胞裂解液说明书,分别加入抗小鼠CD4、抗小鼠CD8a以及抗小鼠CD19,于4℃避光孵育30 min 后,加入2 mL 1×裂解液重悬细胞,室温孵育5 ~10 min 直至溶液由红色浑浊变为红色澄清,立即加入10 mL PBS 终止裂解,1600 r/min 4℃离心5 min,弃去上清,用含2% FBS 的PBS 将4%细胞组织固定液稀释为2%,重悬细胞,4℃保存并尽快使用 Accuri C6 plus 流式细胞仪收集细胞,使用 FlowJo 软件进行分析。
1.3.8 验证用药的给药方法
在造模的第5 ~7 天,每天进行1 次灌胃给药,高剂量组105.6 g/(kg·d),低剂量组52.8 g/(kg·d),体积 20 mL/(kg·d)。
1.4 统计学方法
2 结果
2.1 动物模型的建立
选择体重(14±1)g,约为 3 ~4 周龄的 BALB/c幼鼠,构建hCoV-229E 寒湿疫毒袭肺证病证结合模型。 采用参考文献[15]模拟寒湿环境刺激,并使用100 TCID50的hCoV-229E 进行滴鼻,诱导小鼠肺部炎症。 其分组与步骤如图1 所示,以模型小鼠开始放置于人工气候箱为造模第1 天,其中正常组小鼠饲养于正常环境且不进行感染;感染组小鼠饲养于正常环境,在第5 天和第6 天用病毒各滴鼻感染1次;寒湿组小鼠从第1 天起每天置于人工气候箱中4 h,但不进行感染;模型组小鼠从第1 天起每天置于人工气候箱4 h,并在第5 天和第6 天进行2 次滴鼻感染。

图1 病证结合模型小鼠的构建方法Figure 1 Methods to establish the disease-syndrome combination mouse model
2.2 动物模型的鉴定和评价-中医寒湿证表现
为了明确模型小鼠是否具有中医寒湿证相关的行为表征,于造模第2 天开始对小鼠的行为状态、精神状态、皮肤毛发状态以及大便状态进行评分。结果发现,造模第2 天,寒湿组小鼠开始出现皮肤毛发潮湿,相应评分增加,其他行为表征均未出现异常;造模第4 天,与正常小鼠相比,寒湿组小鼠行为状态评分较低,精神、皮肤毛发状态评分增高,大便状态评分也较高;造模第6 天,与正常小鼠相比,寒湿组小鼠的行为状态评分较低,皮肤毛发状态、大便状态评分均升高;感染组小鼠的行为评分变化趋势与寒湿组相似,但毛发和粪便更为干燥;模型组与寒湿组小鼠各项行为表征均较为一致,其中行为和精神状态的变化更为明显。 对比造模第8 天各组每只小鼠的评分,发现暴露于寒湿环境中的寒湿组和模型组小鼠的行为和精神状态评分低于正常,且毛发油腻、便溏,皮肤毛发和大便状态评分高于正常,与寒湿证相关文献报道一致[16];而感染组的行为和精神状态评分明显下降,皮肤毛发则表现为干枯,大便硬结(图2A)。
观察各组的平均摄食量、摄水量(摄食或饮水总量/该组小鼠数量),发现与正常组相比,模型组的摄入量较低;感染组和寒湿组与正常组相比摄食、摄水量减少,但高于模型组(图2B)。 以上结果表明模型小鼠能够表现出与中医寒湿证相吻合的外观和行为特征。
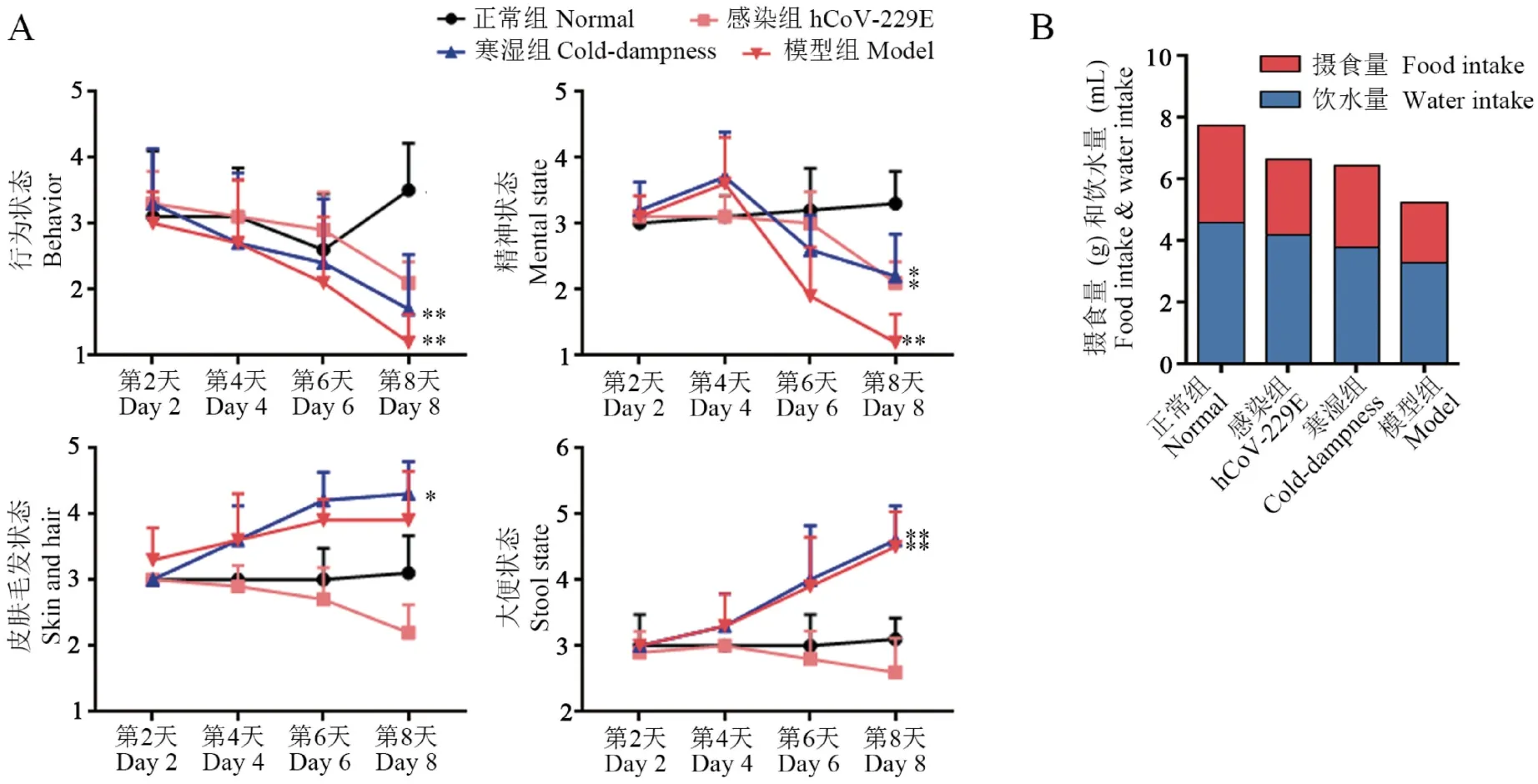
图2 病证结合模型小鼠的建立及行为表征评价(, n=10)Note. A, Evaluation of behavior scores at the 2nd, 4th, 6th and 8th day. B, Average food intake and average water intake of each group (total food or water intake of each group) measured for 24 h from the 7th to 8th day. On the 8th day, compared with normal group, *P<0.05, **P<0.01.Figure 2 Establishment of the disease-syndrome combination model mice and evaluation of its appearance and behavior
2.3 动物模型的鉴定和评价-基于现代医学的评价指标
为了明确该病毒是否会引起小鼠肺炎,对各组小鼠肺组织进行hCoV-229E 核酸扩增,并观察肺部的组织病理学和影像学变化。 结果显示,感染组以及模型组小鼠肺组织病毒RNA 均呈阳性,其中模型组小鼠肺病毒载量显著高于感染组,提示寒湿环境可进一步促进病毒进入肺组织(图3A)。 肺指数计算结果显示,在各组小鼠体重无显著性差异的前提下,与正常组相比,感染组及模型组小鼠肺指数显著升高(图3B、3C)。 随后,将各组小鼠肺组织匀浆上清接种至MRC-5 细胞中,发现与正常培养的细胞相比,正常小鼠的肺组织匀浆上清使细胞形态略有改变,而感染组和模型组上清接种后造成了明显的细胞病变(图 3D),其 TCID50分别为 10-5.23和10-6.15,提示感染组和模型组小鼠肺组织中均存在活病毒。

图3 各组小鼠的肺指数及病毒活性检测(, n=10)Note. A, Real time RT-PCR amplification of hCoV-229E nucleic acid extracted from mice lung tissues. B, Body weight of mice measured at the 8th day.C, Lung index of mice. D, Microscopic cell morphology of MRC-5 cells of each group. Compared with normal group,**P<0.01. Compared with hCoV-229E group,##P<0.01.Figure 3 Detection of lung index and virus activity of each group
HE 染色结果显示,正常组的肺组织结构正常,肺组织未见明显肿胀,肺间质未见明显瘀血或炎性渗出;寒湿组观察到轻度出血、肺组织细胞增生和炎症浸润;感染组和模型组小鼠肺组织均出现大面积出血红染、肺泡支架塌陷,伴有肺泡上皮增生和炎性细胞浸润(图4A)。 与正常组相比,模型组支气管的组织病理学评分显著升高,感染组及模型组的肺病理学评分明显升高(图4B、4C)。Micro-CT 结果显示,感染组和模型组小鼠肺静脉明显增粗,可观察到斑点状阴影(图4D)。 以上结果表明,模型小鼠除表现出中医寒湿证相关的行为表征外,肺部也表现出与病毒性肺炎相似的炎性改变。
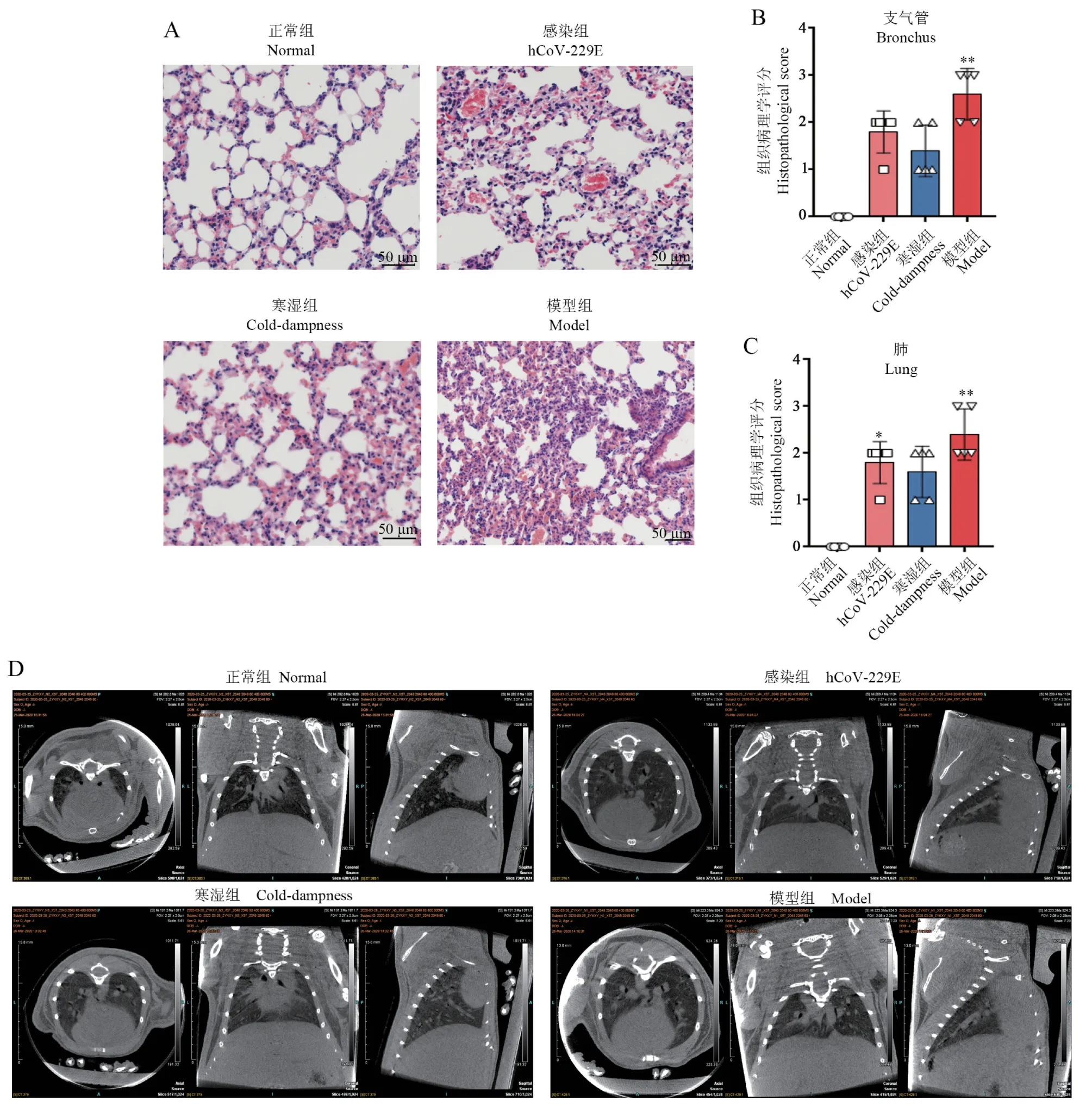
图4 各组小鼠的肺部病理学和影像学改变(, n=5)Note. A, HE staining of lungs. B, Histopathological scores of bronchioles. C, Histopathological scores of lungs. D, Micro-CT of mice lung in each group. Compared with normal group,*P<0.05,**P<0.01.Figure 4 Pathological and imaging changes of mice lung in each group
在外周血生理生化指标方面,对本模型小鼠外周血中的CD4+和CD8+T 细胞以及B 细胞的百分比进行检测,结果发现与正常组相比,模型组小鼠T和B 细胞的百分比均显著降低(图5A)。 寒湿组的淋巴细胞也呈减少趋势,提示病毒和寒湿的刺激均可造成细胞免疫功能受损。 对各组小鼠血清中的胃动素和胃泌素水平进行检测,发现与正常组相比,寒湿组和模型组胃泌素水平显著降低,而其它3组的胃动素水平显著升高,其中模型组小鼠胃动素水平最高(图5B),提示寒湿组以及模型组小鼠胃肠功能受损。

图5 各组小鼠外周血生理生化指标变化情况(, n=10)Note. A, Frequency of T and B lymphocytes in peripheral blood. B, Level of serum gastrin and motilin. Compared with normal group,**P<0.01.Figure 5 Physiological and biochemical changes in peripheral blood of mice
对各组小鼠肺组织匀浆中细胞因子的水平变化情况进行检测,结果显示,与正常组相比,寒湿组的4 种细胞因子无明显差异,感染组和模型组的IL-6、IL-10 和 TNF-α 水平显著升高(图 6A ~6C);各组IFN-γ 水平无统计学差异(图6D)。 以上结果显示,模型小鼠外周血淋巴细胞比例降低,肺组织中的炎性细胞因子水平升高,与人冠状病毒肺炎的临床表型类似。
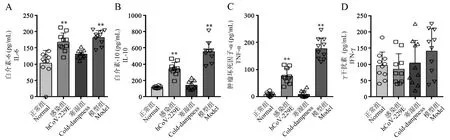
图6 小鼠肺组织匀浆中的细胞因子水平(, n=10)Note. A, Level of IL-6 in lung homogenates of each group. B, Level of IL-10 in lung homogenates of each group. C, Level of TNF-α in lung homogenates of each group. D, Level of IFN-γ in lung homogenates of each group. Compared with normal group,**P<0.01.Figure 6 Cytokines level in lung homogenates of mice
2.4 动物模型的鉴定和评价-中药复方验证
为了对该小鼠模型在药效评价中的可靠性进行明确,使用能够治疗寒湿疫毒袭肺证的复方中药“寒湿疫方”[13],以临床2 倍剂量(高剂量)和等倍剂量(低剂量),从第5 天开始每天进行给药。 结果发现,在小鼠中医证候方面,与模型组相比,给药治疗能够恢复小鼠的平均摄食、饮水量(图7A),能够缓解小鼠寒湿证行为表征(图7B)。 在小鼠肺炎疾病方面,与模型组相比,给药后小鼠肺指数显著降低(图7C);小鼠肺病毒载量、胃动素水平、外周血淋巴细胞百分比、细胞因子水平得到明显恢复(图7D ~7G)。 以上结果表明治疗寒湿疫的复方中药对模型小鼠的各指标有不同程度的缓解作用,该模型对于评估药物是否可以缓解hCoV-229E 寒湿疫毒袭肺证具有一定可靠性。
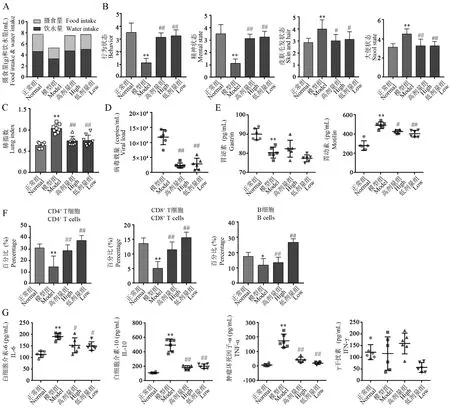
图7 两剂量的复方中药对病证结合小鼠各评价指标的影响()Note. A, Average food and water intake of each group from the 7th to 8th day. B,Appearance and behavior scores determined at the 8th day(n=8). C,Lung index of each group (n=8). D, RT-PCR of hCoV-229E in lung tissue (n=6). E, Level of gastrin and motilin in mice serum (n=8). F, Percentage of T and B lymphocytes in peripheral blood(n=8). G,Level of inflammatory cytokines in lung tissue homogenate(n=6),high and low represent clinical double and equal dose, respectively. Compared with normal group,*P<0.05,**P<0.01. Compared with model group,#P<0.05,##P<0.01.Figure 7 Effect of compound TCM on the disease-syndrome combination model
3 讨论
中医药在病毒性肺炎的治疗中有着丰富经验和积极的疗效,然而,大多数药物缺乏动物实验数据支持。 其中的主要原因是缺乏相应的动物模型,因此,构建符合中医证候、适用于中医药药效评价的动物模型迫在眉睫。
在病毒性肺炎的治疗中,西药研发主要针对病毒本身,主要通过抑制病毒的糖基化修饰以及病毒核酸,从病毒增殖周期中的吸附、穿入、复制等环节发挥抗病毒作用[17-18]。 中医药治疗病毒性肺炎并不针对病毒本身,而是强调根据疾病证候特点辨证论治,更多关注机体整体状态的调节,其突出特点是非特异性抗病毒、调节机体免疫功能、减轻炎性病理损伤的作用[19-20]。 因此,用动物模型从中医证型外观行为、一般状态,以及药理学、病理学、生理生化指标、免疫细胞比例等多方面对病毒性肺炎的临床表现进行模拟,更有利于中药抗病毒性肺炎的药效评价。 本研究中,我们建立了hCoV-229E 寒湿疫毒袭肺证病证结合模型,发现模型小鼠在中医寒湿证以及肺炎疾病方面与临床表现具有一致性。
病毒感染呼吸道后,在气候和环境的作用下,可出现以寒、湿为主的证候特征[9-10,13]。 在中医寒湿证表现方面,模型小鼠在造模第4 天出现毛发油腻、大便粘稠等,为寒湿的早期证候;从造模第6 天开始,小鼠出现扎堆不动、摄食和饮水量减少,模型小鼠血清胃动素升高、胃泌素降低,这些表型均符合文献报道中寒湿证动物模型的特征[15,21]。 在临床上,寒湿疫毒袭肺证表现为乏力、恶寒、纳呆、恶心、大便粘腻,本模型的中医证候表现与临床疾病一致[13]。
在肺炎疾病表现以及现代医学检测指标方面,模型小鼠出现肺组织水肿、肺泡结构破坏、炎性细胞浸润等组织病理学改变,以及肺部阴影等影像学改变,与临床中的肺炎的病理学和影像学表现一致。 小鼠肺组织中的病毒核酸阳性,将模型小鼠肺组织匀浆上清接种至MRC-5 细胞可造成细胞病变,说明模型小鼠肺组织中存在活病毒,符合病毒性肺炎的病原学表现。 模型小鼠 IL-6、IL-10、TNF-α 显著升高,IFN-γ 有升高趋势,与冠状病毒感染的肺炎表现一致[22-23]。 模型小鼠外周血淋巴细胞百分比减少可能与淋巴细胞被招募至感染部位并发生活化后凋亡有关[24-25],与临床上病毒性肺炎造成外周血淋巴细胞降低的现象一致[26-27]。
此外,与正常组相比,寒湿组小鼠也出现了一定程度的肺指数升高、肺组织炎性细胞浸润、淋巴细胞百分比降低、IL-6 水平升高趋势,提示单纯的寒湿刺激也可引起肺部炎症以及免疫功能减弱。
寒湿疫方包括麻黄、石膏、苦杏仁、羌活、葶苈子、贯众、地龙、徐长卿、藿香、佩兰、苍术、茯苓、白术、焦三仙、厚朴、焦槟榔、煨草果、生姜,能够发挥散寒、胜湿、化湿、燥湿、利湿、宣肺解表的作用,从而治疗呼吸道相关症状,调节脾胃相关证候[13,28],与寒湿疫毒袭肺证相适应。 用该复方对模型小鼠进行验证性给药治疗后,不仅中医证候相关的行为表征评分以及摄食饮水量得到明显改善,肺指数、病毒载量、血清胃肠激素及淋巴细胞比例、肺组织炎性因子水平也得到了明显恢复,说明该模型在寒湿疫毒袭肺证药效评价中具有一定的可靠性,并体现了中医药整体调节的作用特点。
综上,本研究显示,模型小鼠能够模拟寒湿疫毒袭肺证的临床变化,包括外观和行为表征、摄食和饮水量、肺部影像学和病理学变化、肺部炎性细胞因子水平和外周血淋巴细胞百分比等,在药效评价中具有可靠性,为治疗具有该证候的病毒性肺炎药物的应急筛选或日常研究,提供了一种可能的评价模型。
