红油香椿生长期主要活性物质及挥发性成分动态变化规律
2022-02-16史冠莹赵丽丽王晓敏蒋鹏飞王旭增王赵改
史冠莹,赵丽丽,王晓敏,张 乐,蒋鹏飞,王旭增,王赵改
(河南省农业科学院农副产品加工研究中心,河南 郑州 450000)
香椿(Toona sinensis(A.Juss.) Rome)属于楝科香椿属多年生植物,是我国特有的集食用、药用、材用为一身的木本植物,在全国22个省区均有规模化种植[1-2]。香椿由于其风味独特、营养价值高而深受消费者喜爱,是理想的绿色保健食品,具有很大的市场开发潜力[3-5]。香椿含有丰富的营养物质和多种植物次生代谢物质,包括氨基酸、蛋白质、可溶性糖、VC、多酚类、黄酮类、皂苷、萜类、生物碱、苯丙素类和含硫及含氮化合物等,这些化合物是香椿具有食用价值、医疗保健功能和抗菌杀虫作用的物质基础[6-8]。
产地气候、生长环境、生长期等因素均会对香椿中的物质组成及含量造成影响,进而影响香椿品质。目前研究主要集中在不同产地香椿营养成分及香气成分的影响,而不同生长期对香椿活性物质及挥发性成分的研究较少[9-11]。杨慧等[12]采用气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)技术对红油香椿嫩芽的不同生长期(嫩芽长度5~30 cm期间采摘)挥发性成分进行研究,共检测到挥发性化合物35 种,随着香椿嫩芽的不断生长,羰基类、含硫类、醇类整体均呈先上升后下降的趋势,烯类整体呈先下降后上升趋势,烃类、其他类均逐渐下降。朱永清等[13]通过GC-MS技术分析测定了“巴山红”香椿芽叶5个不同发育时期挥发性物质,结果显示在不同发育时期挥发性组分的种类及相对含量具有明显差异,对香椿芽叶呈味特性影响较大的物质主要集中在醇类、酯类、醛类和萜烯类化合物。
GC-MS是目前分析挥发性化合物中最常用的技术手段,广泛应用于香椿挥发性成分研究[14-17]。气相色谱-离子迁移谱(gas chromatography-ion mobility spectrometry,GC-IMS)技术是近年来新兴的一种分析方法,该技术是利用GC的高分离能力与IMS的高分辨、高灵敏度等优势,弥补了GC-MS对痕量小分子物质检测灵敏度与重现性不足的问题,且样品几乎不需要任何前处理,目前也广泛应用于食品风味分析、品质鉴定等不同领域中[18-20],但在香椿的挥发性物质分析研究中鲜见报道。GC-MS和GC-IMS两种技术结合可充分利用GC-IMS的快速灵敏性以及GC-MS的高效性,能更加全面科学地对不同生长期香椿的挥发性成分变化进行分析研究。
聚类分析(cluster analysis,CA)法又称群分析,是在没有给定划分类别的情况下,根据数据相似度进行样本分组的一种多元统计分析方法,能够以分类图的形式进行直观地系统分析[21]。主成分分析(principal component analysis,PCA)是一种多变量统计方法,其可降低由大量相关变量组成的数据集维数,并尽可能保留数据集中存在的变化[22]。
本研究以不同生长期的红油香椿为原料,比较分析不同生长期香椿中主要活性物质(总黄酮、总多糖、总皂苷、总生物碱)的含量变化,利用GC-MS和GC-IMS技术快速检测不同生长期红油香椿中挥发性化合物,并结合CA和PCA不同生长期红油香椿挥发性化合物的变化,从而为综合评价香椿的质量品质及香椿资源的综合利用开发提供科学依据。
1 材料与方法
1.1 材料与试剂
香椿叶采自河南新乡原阳县河南省农业科学院现代农业科技试验示范基地。于2019年4—10月每月采样,选取新鲜、无病虫害的香椿叶,切碎后加液氮研磨,得到香椿湿样,冷冻备用。
人参皂苷、盐酸小檗碱、芦丁(均为优级纯)北京索莱宝生物科技有限公司;无水葡萄糖 天津市化学试剂六厂三分厂;没食子酸标准品 天津市光复精细化工研究所;其他试剂均为国产分析纯;高纯氮气(纯度≥99.999%)由Chemtron制氮机制备;15 mL顶空瓶 浙江哈迈科技有限公司。
1.2 仪器与设备
ME204E型电子天平 梅特勒-托利多仪器(上海)有限公司;H1850R型高速冷冻离心机 湖南湘仪公司;SB-5200DTD型超声波清洗机 宁波新芝生物科技股份有限公司;QL-901型旋涡混合器 海门市其林贝尔仪器制造有限公司;GENESYS 10S型紫外-可见分光光度计 美国热电公司;7890A-5975C GC-MS联用仪、HP-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm) 美国安捷伦公司;50/30 μm二乙烯基苯/碳分子筛/聚二甲基硅氧烷(divinylbenzene/carboxen/polydimethylsiloxane,DVB/CAR/PDMS)固相微萃取头美国Supelco公司;FlavourSpec GC-IMS联用仪 德国G.A.S公司;MXT-5色谱柱(15 m×0.53 mm,0.53 μm)美国Restek公司。
1.3 方法
1.3.1 主要活性物质测定
1.3.1.1 黄酮提取及含量测定
精确称取冷冻香椿湿样(5.00±0.003)g置于带塞三角瓶中,加入20 倍体积的70%乙醇溶剂,基于前期多次预实验基础上,确定黄酮超声辅助提取条件:超声功率为180 W,温度为50 ℃,提取时间为40 min,重复提取2 次,抽滤除去滤渣,得到待测提取液。
总黄酮含量的测定采用硝酸铝显色法[23],略有改动。以芦丁为标准品,于波长510 nm处测定吸光度,以吸光度为纵坐标y,芦丁质量浓度为横坐标x,绘制标准曲线。将待测黄酮提取液样品按照上述方法测定吸光度,平行测定3 次。将测得的吸光度代入标准曲线计算得到样品质量浓度,换算出香椿样品总黄酮含量。
1.3.1.2 多糖提取及含量测定
经过多次预实验,确定多糖提取条件。精确称取冷冻香椿湿样(5.00±0.003)g,10 mL蒸馏水浸润样品,缓慢加入40 mL无水乙醇,同时使用涡旋振荡器振摇,使混合均匀,超声提取30 min,8 000 r/min离心10 min,弃去上清液;不溶物用50 mL水转移至三角瓶,超声提取30 min,提取2 次,除去沉淀,转移上清液至100 mL容量瓶中,定容到100 mL。此溶液为样品测定液。
总多糖含量的测定采用苯酚-硫酸显色法[24]。以无水葡萄糖为标准品,于波长490 nm处测定吸光度,以吸光度为纵坐标y,无水葡萄糖质量浓度为横坐标x,绘制标准曲线。将待测多糖提取液样品按照上述方法测定吸光度,平行测定3 次。将测得的吸光度代入标准曲线计算得到样品质量浓度,换算出香椿样品总多糖含量。
1.3.1.3 皂苷提取及含量测定
精确称取冷冻香椿湿样(5.00±0.003)g置于带塞三角瓶中,加入20 倍体积的70%乙醇溶剂,基于前期多次预实验基础上,确定皂苷超声辅助提取条件:超声功率为180 W,温度为50 ℃,提取时间为40 min,重复提取2 次,抽滤除去滤渣,得到待测提取液。
总皂苷含量的测定采用香草醛-冰乙酸比色法[25],略有改动。以人参皂苷为标准品,于波长560 nm处测定吸光度,以吸光度为纵坐标y,皂苷质量浓度为横坐标x,绘制标准曲线。将待测皂苷提取液样品按照上述方法测定吸光度,平行测定3 次。将测得的吸光度代入标准曲线计算得到样品质量浓度,换算出香椿样品总皂苷含量。
1.3.1.4 生物碱提取及含量测定
精确称取冷冻香椿湿样(5.00±0.003)g置于带塞三角瓶中,加入20 倍体积的70%乙醇溶剂,基于前期多次预实验基础上,确定生物碱超声辅助提取条件:超声功率180 W、温度50 ℃、提取时间40 min,重复提取2 次,抽滤除去滤渣,得到待测提取液。
总生物碱含量的测定采用分光光度法[26]。以盐酸小檗碱为标准品,于波长345 nm处测定吸光度,以吸光度为纵坐标y,盐酸小檗碱质量浓度为横坐标x,绘制标准曲线。将待测提取液样品按照上述方法测定吸光度,平行测定3 次。将测得的吸光度代入标准曲线计算得到样品质量浓度,换算出香椿样品总生物碱含量。
1.3.2 挥发性成分分析
1.3.2.1 GC-MS测定
顶空固相微萃取:准确称取(1.00±0.003)g冷冻香椿湿样于15 mL固相微萃取顶空瓶里,密封后于40 ℃水浴中平衡15 min,将250 ℃老化过的50/30 μm DVB/CAR/PDMS萃取头插入到顶空瓶中,40 ℃水浴萃取30 min后取出萃取头,再将萃取头插入GC-MS联用仪,250 ℃解吸5 min,同时启动仪器采集数据。
GC条件:HP-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm);载气He;进样口温度250 ℃,无分流比,柱流速1 mL/min。程序升温:初温40 ℃,保持3 min,以5 ℃/min升温至150 ℃,保持2 min,以8 ℃/min升至230 ℃,保持5 min结束。
MS条件:电子电离源;四极杆温度150 ℃;离子源温度230 ℃;辅助加热器250 ℃;质量扫描范围40~800 u。
1.3.2.2 GC-IMS测定
样品测定:准确称取(0.20±0.003)g冷冻香椿湿样,装入20 mL专用顶空进样瓶中,40 ℃孵化10 min,通过顶空进样用GC-IMS进行测定。
顶空进样条件:孵育温度40 ℃;孵育时间10.0 min;孵育转速250 r/min;顶空进样针温度80 ℃;进样体积200 μL,不分流模式;载气:高纯氮气(纯度≥99.999%);清洗时间0.5 min。
GC条件:MXT-5色谱柱(15 m×0.53 mm,0.53 μm);色谱柱温度60 ℃;载气:高纯氮气(纯度≥99.999%);载气流速程序:初始2.0 mL/min,保持2 min,在2~10 min线性增至5.0 mL/min,在10~20 min线性增至50.0 mL/min,在20~30 min线性增至100.0 mL/min。
IMS条件:放射源为β射线(氚,6.5 keV);正离子模式;漂移管长度9.8 cm;管内线性电压500 V/cm;漂移管温度45 ℃;漂移气为高纯氮气(纯度≥99.999%);漂移气流速150 mL/min。
1.3.2.3 定性与定量分析
GC-MS测定数据应用GC-MS仪器内置的NIST08.LIB谱库对GC-MS检测到的挥发性成分进行鉴定。GC-IMS测定数据采用GC-IMS仪器自带的GC×IMS Library Search定性分析软件对GC-IMS检测到的挥发性成分进行鉴定。
1.3.3 CA
将GC-MS鉴定出的7个生长期香椿样品(S1~S7)中的12个共有物质的相对含量作为变量,得到7×12阶原始数据,将其导入SPSS 19.0软件,采用组间连接法,以欧式距离平方为分类依据,相似度越大,2个样品之间的距离越近。
1.3.4 指纹图谱
为更直观且定量地比较不同生长期香椿样品中的挥发性化合物差异,采用GC-IMS设备内置的LAV软件的GalleryPlot插件,自动生成香椿生长期的指纹图谱。图中每一行代表一个生长期香椿样品中所含的挥发性化合物,每一列是不同生长期样品之间同一种挥发性化合物的差异。颜色的深浅代表挥发性化合物的含量,颜色越深,含量越高。
1.3.5 PCA
通过GC-IMS设备内置的LAV软件的Dynamic PCA插件对不同生长期的香椿样品进行PCA,以GC-IMS鉴定出的不同生长期14个香椿样品(每个生长期测定2 次)中的50 个挥发性成分对应的峰高为变量形成14×50阶原始数据,通过对数据特征的降维处理,进行PCA。
1.3.6 二维图谱定性分析
根据GC×IMS Library Search定性分析软件内置的IMS迁移时间数据库以及NIST2014保留指数数据库对不同生长期香椿样品中的挥发性成分进行二维定性。
1.4 数据处理
采用SPSS 19.0软件进行CA;Gallery plot软件绘制指纹图谱;Dynamic PCA1.1.0软件进行PCA;DPS软件进行数据方差分析,P<0.05,差异显著。分析软件LAV2.2.1和GC×IMS Library Search1.0.3为德国G.A.S公司。
2 结果与分析
2.1 生长期红油香椿的活性物质含量变化
2.1.1 标准曲线的建立
分别以芦丁、无水葡萄糖、人参皂苷及盐酸小檗碱为标准品,采用分光光度法建立总黄酮、多糖、皂苷及生物碱的标准曲线,得线性回归方程见表1。
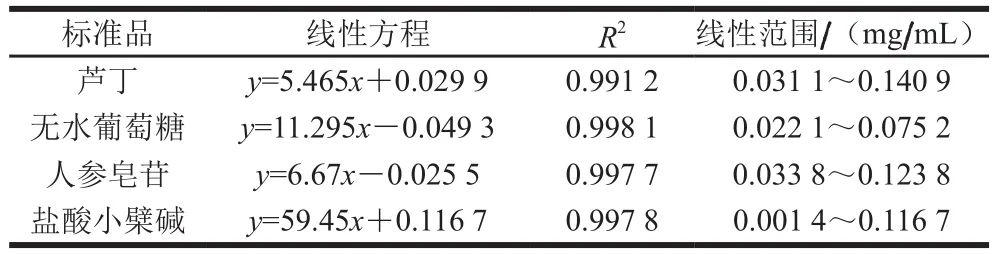
表1 活性物质回归方程Table 1 Regression equations for quantification of active substances
2.1.2 活性物质含量变化
取2019年4—10月每月采收的红油香椿叶共7 批,分析其含有的主要活性物质,结果如表2所示,在7 批不同采收期的红油香椿样品中,通过分析不同时期采收香椿叶中的4 种活性成分含量,发现均有明确的累积规律,其中总黄酮、总多糖和总生物碱的含量在10月达到最高,而总皂苷的含量在9月最高。各生长期红油香椿中4 种活性物质的含量变化整体呈现上升趋势,因此以活性物质为目标加工香椿类产品时,应以9—10月采集其老叶为宜,并且此生长期香椿叶产量也较大。
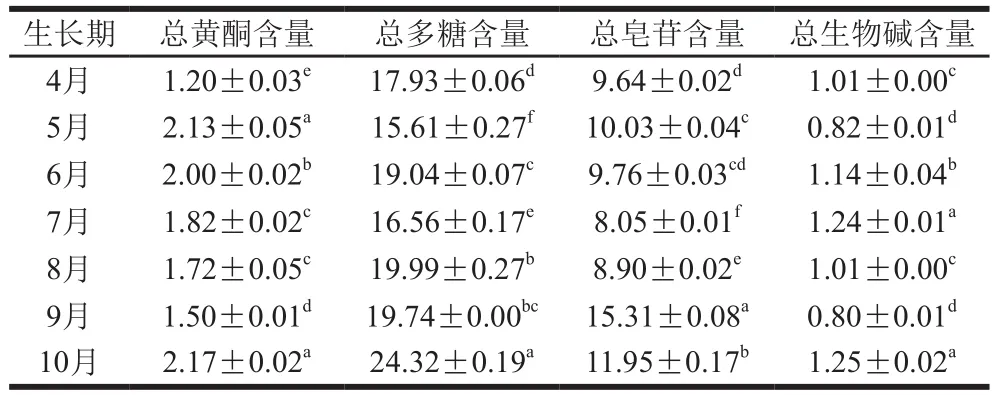
表2 不同生长期香椿活性成分比较Table 2 Contents of active components in T. sinensis leaves at different growth stages mg/g
2.2 基于GC-MS分析生长期香椿的挥发性成分
2.2.1 生长期红油香椿挥发性成分的变化规律
将阈值设为18,采用HS-SPME-GC-MS联用技术,对不同生长期红油香椿叶中的挥发性成分进行检测分析,同时与NIST08.LIB质谱库相匹配,得出各挥发性化合物的名称及相对含量如表3所示,匹配度80%以上,不同生长期的红油香椿叶样品中共检出109种挥发性化合物成分,其C链均在C6~C20之间,其中4月检出53种,5月检出32 种,6月检出48 种,7月检出45 种,8月检出63种,9月检出61 种,10月检出42 种。
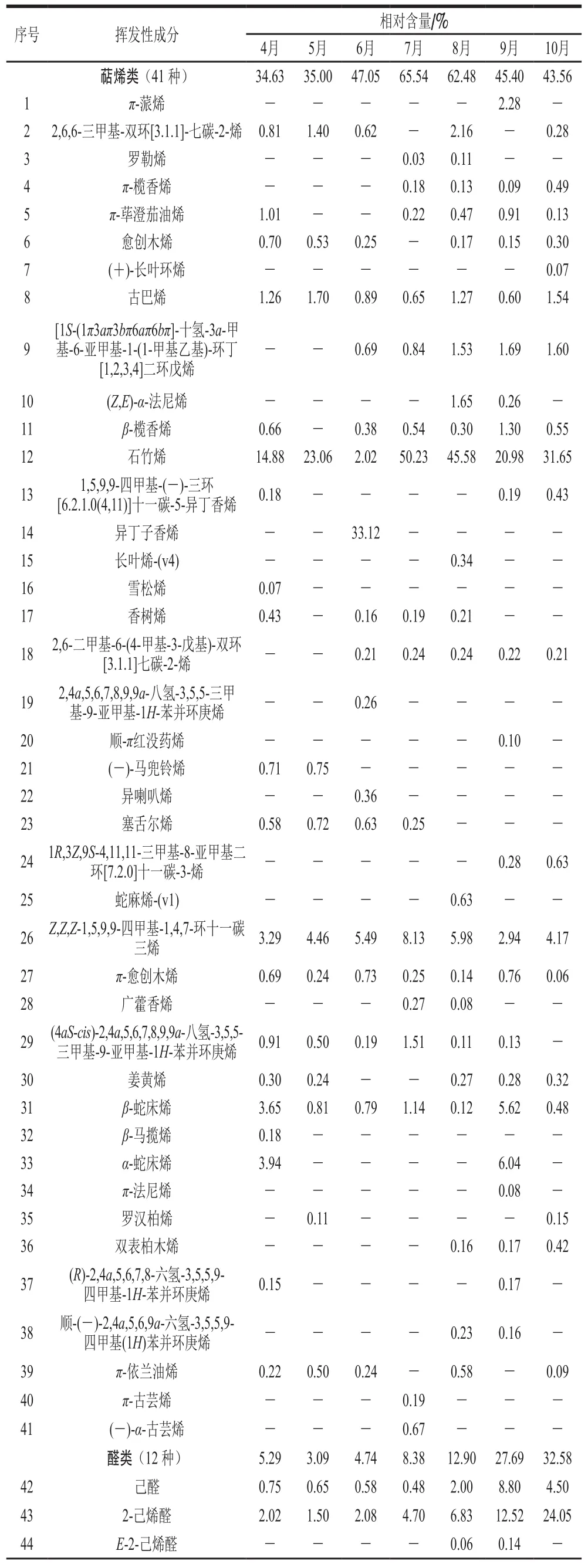
表3 生长期香椿挥发性成分及其相对含量Table 3 Volatile compounds and their relative contents in T. sinensis leaves during its growth period
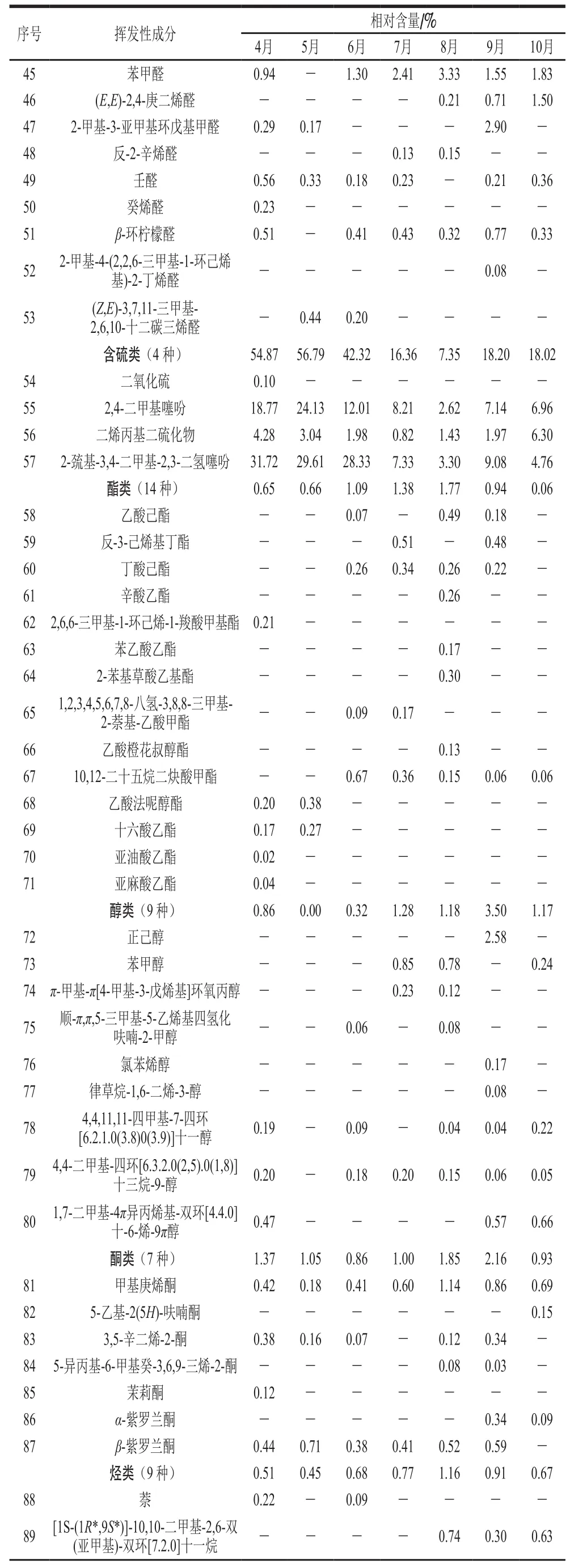
续表3
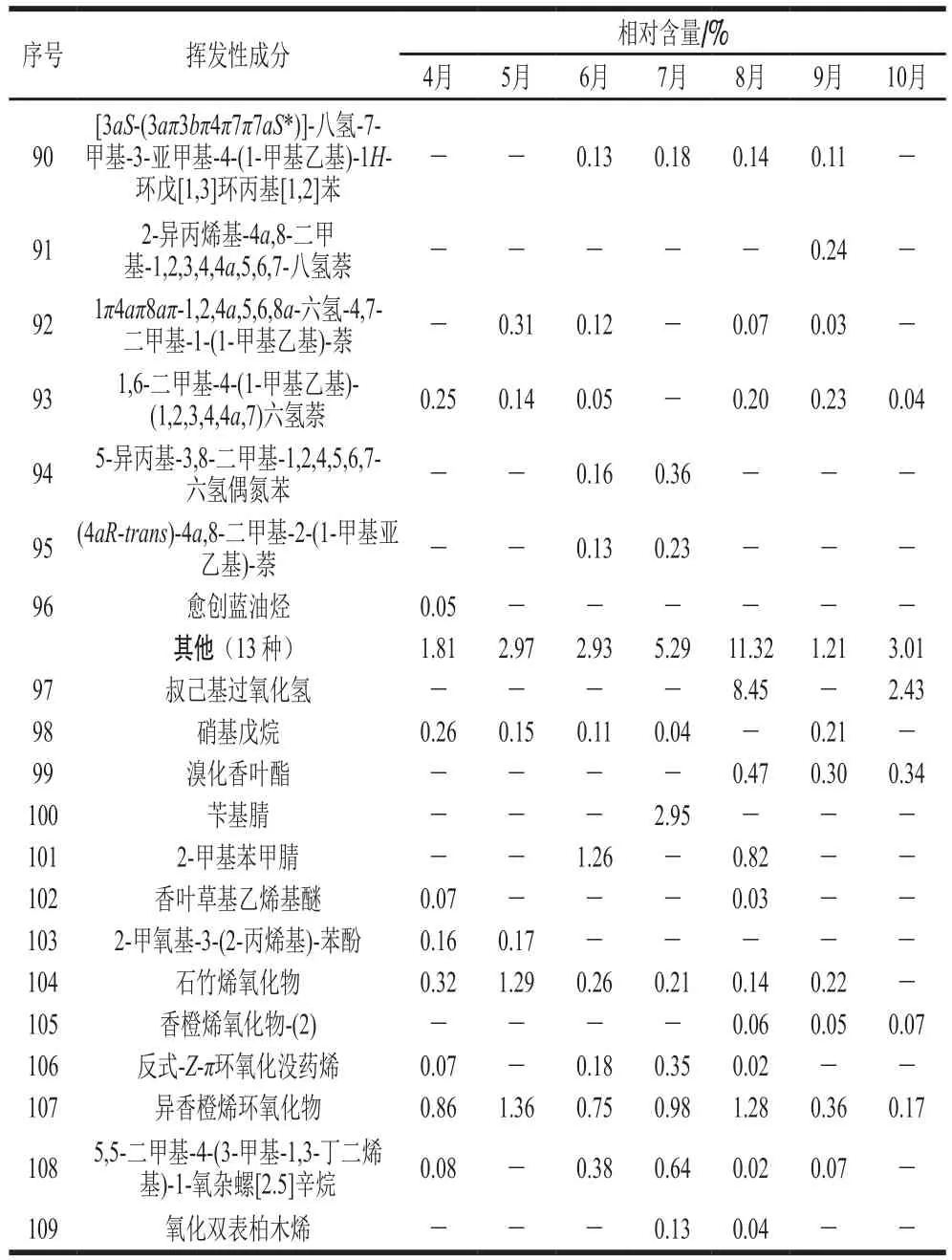
续表3
如表3所示,不同月份的红油香椿叶中挥发性化合物种类涉及萜烯类、醛类、含硫类、酯类、醇类、酮类、烃类及其他类(杂环类等)共8 类化合物。整个生长期中相对含量较高的为萜烯类、醛类和含硫类化合物,这3 类化合物在不同生长期样品中的相对含量之和在82.73%~94.87%之间,构成了香椿的主要香气物质。其中萜烯类化合物总含量在生长期整体呈现先上升再下降变化趋势,且在7月达到峰值;醛类化合物总含量在生长期整体呈现上升变化趋势,且在10月增至最大值;而含硫类化合物总含量在生长期整体呈现先下降再上升变化趋势,在5月达到峰值,而在8月最低,与萜烯类化合物变化趋势相反(图1)。
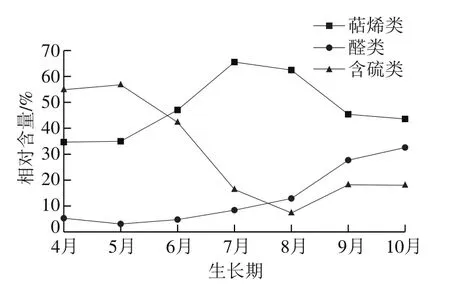
图1 生长期香椿主要香气成分含量变化Fig. 1 Changes in contents of aroma components in T. sinensis leaves during its growth period
红油香椿不同生长期中鉴定出共有化合物为12 种,其中萜烯类5 种(古巴烯、石竹烯、Z,Z,Z-1,5,9,9-四甲基-1,4,7-环十一碳三烯、π-愈创木烯、β-蛇床烯);醛类2 种(己醛、2-己烯醛);含硫类化合物3种(2,4-二甲基噻吩、二烯丙基二硫化物、2-巯基-3,4-二甲基-2,3-二氢噻吩);酮类1 种(甲基庚烯酮)和其他1 种(异香橙烯环氧化物)。12 种共有化合物在不同生长期样品中的相对含量之和占比在56.06%~90.75%之间,尤其是5月香椿叶中12 种共有化合物的相对含量之和占比高达90.75%,由此可见香椿叶中的香气成分随生长期变化有所差异,但主要香气构成上呈现一定的稳定性。进一步分析共有化合物的动态变化趋势,发现醛类物质2-己烯醛相对含量随生长期呈升高趋势,在10月达到峰值24.05%,与醛类物质总的变化趋势一致。萜烯类物质石竹烯相对含量整体呈先升后降的变化趋势,在7月达到峰值50.23%,与萜烯类物质总的变化趋势一致。含硫类物质2,4-二甲基噻吩相对含量整体呈先升后降的变化趋势,在5月达到峰值24.13%,2-巯基-3,4-二甲基-2,3-二氢噻吩相对含量随生长期呈下降趋势,在4月相对含量最高达31.72%。在12个共有物质中,石竹烯具有明显的辛香、木香[27],2-己烯醛具有典型的青草香气[28],二烯丙基二硫化物具有强烈的烤洋葱味[29],2-巯基-3,4-二甲基-2,3-二氢噻吩具有明显的煮熟洋葱味、类似香椿味[30],这些共有化合物对香椿的特征风味贡献较大,且总相对含量在5月香椿中达到最大值81.35%,这为香椿风味在食品中应用提供了参考依据。
2.2.2 生长期红油香椿共有挥发性成分CA
如图2所示,7个月份红油香椿样品可聚为2 类,7、8、9、10月样品聚为第1类,4、5、6月样品聚为第2类。当类间距为11时,根据第1类样品的差异又可将其分为2 类,7、8月样品聚为1 类,9、10月样品聚为1 类;当类间距为6时,根据第2类样品的差异可将其分为2 类,4、5月样品聚为1 类,6月样品单独聚为1 类。以上结果表明,不同生长期香椿共有挥发性成分的含量存在差异,CA可以将不同月的香椿样品区别开,聚为1 类的样品之间的相似度较高。
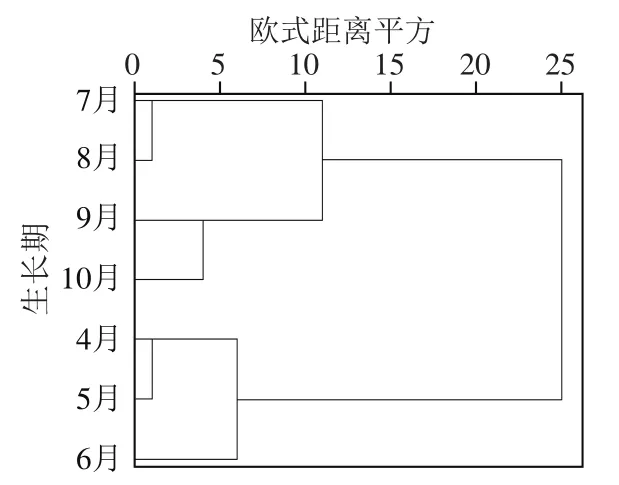
图2 香椿样品挥发性成分的CA树状图Fig. 2 Cluster analysis dendrogram of volatile components in T. sinensis leaves at different growth stages
2.3 基于GC-IMS分析生长期红油香椿的挥发性成分
2.3.1 生长期红油香椿中挥发性成分变化规律
不同生长期的红油香椿样品中的挥发性成分通过GC-IMS很好地分离,大部分信号出现在漂移时间为1.0~1.7 ms和保留时间为100~1 000 s的区域,在不同生长期红油香椿样品中共计鉴定出49种挥发性化合物(表4),部分化合物浓度高会产生二聚体,它们保留时间与单体相近,但迁移时间不同可区别开。49种挥发性化合物的碳链在C4~C10之间,主要包括醇类16 种、醛类14 种、萜烯类4 种、酯类4 种、酮类4 种、酸类2 种、含硫类2 种以及杂环化合物3种。
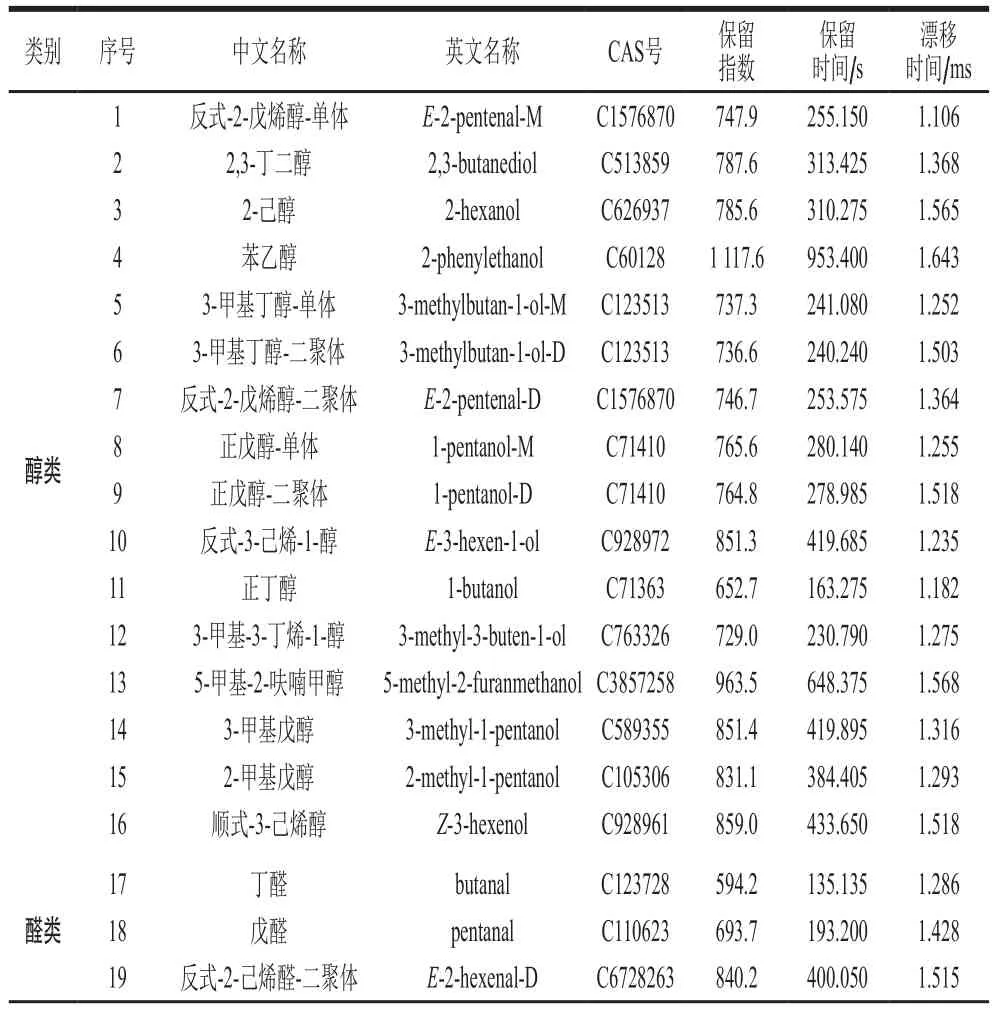
表4 GC-IMS鉴定生长期香椿挥发性成分Table 4 Identification of volatile compounds in T. sinensis leaves during its growth period by GC-IMS
续表4
由图3可以看出,随着生长期变化,红油香椿中一部分挥发性物质含量降低,甚至消失,而另一部分挥发性物质从无到有,含量增加,表明挥发性组分随生长期发生显著变化。A区域为7个生长期的共有挥发性化合物,主要为醇类和醛类化合物,包括2,3-丁二醇、反式-2-戊烯醇(单体)、2-己醇、5-甲基-2-呋喃甲醇、2-甲基戊醇、3-甲基戊醇、5-甲基糠醛(单体)、苯甲醛(单体)、反式-2-己烯醛(单体和二聚体)等。B区域中的物质有戊醛、2-乙基呋喃、2-乙酰基呋喃、2-乙基-6-甲基吡嗪、2,4,5-三甲基噻唑、苯乙醇、丁酸、柠檬烯等,这些物质主要存在于4月和5月样品中,尤其是杂环类化合物只在4月和5月样品中检测到。C区域物质在6、7月和8月样品中含量较高,尤其是5-甲基糠醛(二聚体)、苯乙醛、2-甲基丁醛(二聚体)和3-甲基丁醇(单体)等几种物质最为明显。D区域中挥发性物质主要存在于8、9月和10月样品中,包括正丁醇、顺式-3-己烯醇、苯甲醛(二聚体)、正戊醇(单体)、二乙基二硫、丙酸乙酯(二聚体)、反式-2-戊烯醇(二聚体)、正戊醇(二聚体)等。

图3 生长期香椿中挥发性化合物的指纹图谱Fig. 3 Fingerprints of volatile compounds in T. sinensis leaves during its growth period
2.3.2 生长期红油香椿挥发性成分PCA
如图4所示,前3个PC的累计方差贡献率为84%(PC1、PC2和PC3分别为48%、25%和为11%),表明前3个PC包含了不同生长期香椿样品挥发性成分的绝大部分信息,可以用于不同生长期的红油香椿挥发性成分分析。由图4可以直观地看出,不同样品间的差异,同一生长期样品相对距离较近或重叠,表明香椿样品检测重复性好,不同生长期样品有明显的间距,表明不同生长期香椿间的差异性明显。其中在PC1方向上,7个生长期样品明显分为3个部分,分别为4、5月样品,6、7月样品,以及8、9、10月样品,6、7月样品与其他生长期样品在PC2方向上也表现出明显的差异性。在PC3方向上,7个生长期样品分为3个部分,分别为4、6月和其他月。由此可见,PCA可以很好地将不同生长期的红油香椿进行区分,生长期可分为3个阶段,4—5、6—7月和8—10月。
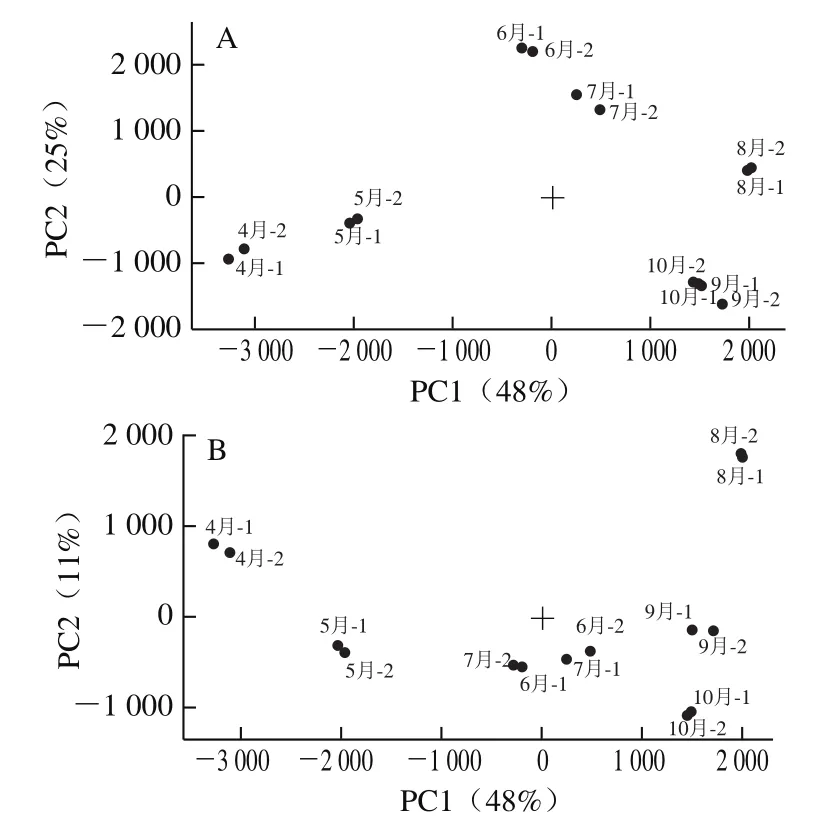
图4 不同生长期香椿样品的PCA图Fig. 4 PCA plots of T. sinensis leaves at different growth periods
3 结论与讨论
本研究对不同生长期红油香椿的主要活性成分及挥发性成分进行分析测定,结果表明,主要活性物质随生长期呈现出明显的累积规律,其中总黄酮、总多糖和总生物碱含量均在10月达到最高,总皂苷含量在9月达到最高。采用GC-MS和GC-IMS技术对挥发性成分变化进行分析,由于检测灵敏度、进样口温度等差异,GC-MS和GC-IMS技术在不同生长期的红油香椿中分别鉴定出109种和49种挥发性成分,其中共同检测出的挥发性成分只有5 种,包括蒎烯、反式-2-己烯醛、苯甲醛、(E,E)-2,4-庚二烯醛、乙酸乙酯。2 种技术鉴别出的挥发性成分呈现出明显的差异性,GC-MS技术检测出的为分子质量在C6~C20之间的挥发性成分,这类物质多为大分子且含量较高的挥发性成分;而GC-IMS技术检测出的为分子质量在C4~C10之间的挥发性成分,这类物质多为小分子、在常温下易挥发且含量低的挥发性成分。与传统的GC-MS方法相比,GC-IMS方法样品处理及分析温度较低,更能真实反映样品原始的状态。目前关于香椿挥发性成分的研究,大部分均采用GC-MS进行检测分析,对于分子质量小且含量极低的酮类、酸类、呋喃类等化合物很难被检测到,而本研究中采用GC-IMS能够很好地弥补GC-MS检测中存在的缺陷,此2 种技术相结合扩大了香椿样品中挥发性成分的检测范围,并且更加全面地反映香椿样品中挥发性成分随着生长期的变化情况,在今后的检测分析中具有较大的应用前景。综合分析认为随生长期变化,红油香椿中的主要活性物质及挥发性成分发生较大变化,应根据产品加工特性及用途选择采样时间进行开发利用。
