新疆地区驴乳源优良乳酸菌发酵剂的筛选及菌株益生特性
2022-02-16靳亚梅倪永清
杨 博,柏 吉,靳亚梅,王 欢,倪永清,*,李 谞,*
(1.石河子大学食品学院,新疆 石河子 832000;2.新农乳业有限责任公司,新疆 阿拉尔 843300)
凡是能利用葡萄糖或乳糖产生乳酸的细菌统称为乳酸菌[1]。乳酸菌能提高食品的营养价值,改善食品风味,增加食品的保藏性和附加值,是天然的防腐剂[2],被广泛应用于乳制品、肉制品和蔬菜制品等。
发酵乳制品是原料乳在特定微生物的作用下通过发酵制成的酸性乳制品,其中乳酸菌发酵剂的发酵性能(产酸、产黏、产香和后酸化等)[3]及益生特性(抑菌、抗氧化和免疫调节等)直接影响最终发酵乳制品的质量及风味好坏[4]。目前,发达国家对发酵剂的研究及产业化已经高度成熟[5]。我国具有得天独厚的微生物资源优势,开发出具有自主知识产权的优良乳酸菌发酵剂,使发酵剂的制备逐步形成专业化和规模化的工业生产体系,突破发达国家的行业垄断已是当务之急。
我国新疆地区的畜牧业发达,乳源丰富,该地区少数民族自古就有手工加工和食用发酵乳制品的传统,特色发酵乳制品大多为自然环境中使用动物原乳发酵而成[6]。研究发现,动物原乳(驴乳、骆驼乳等)和发酵乳制品中蕴藏着丰富的乳酸菌资源[7-9],是开发野生型优良乳酸菌及潜在益生菌的天然宝库。虽然发达国家有开发成熟的发酵剂,但由于技术垄断很难惠及不发达国家,尤其是经济落后的地区;同时,从消费群体的地域性以及肠道微生态理论出发,从本地食品更容易筛选到适应当地饮食习惯人群的益生性发酵剂[10],开发这些乳酸菌资源将有助于本地企业研发具有明显地域特色的功能性食品。
目前,新疆地区驴产业已初具规模,驴乳逐渐成为研究和开发利用的热点[11]。有研究认为,驴乳的营养价值与人乳相近,尤其是对一些疾病的治疗和抗菌活性效果明显,其营养价值、活性组分和免疫调节作用成为研究热点[12-14]。研究发现,原乳中蕴含了丰富的乳酸菌资源,但目前国内外报道的大部分乳酸菌发酵剂来自发酵乳品,针对动物原乳筛选的发酵剂报道较少[15],尤其与其他动物乳相比,关于驴乳源乳酸菌资源的报道更少。本研究从新疆哈密地区采集的驴乳中分离野生乳酸菌菌株,筛选优良的乳酸菌发酵剂,并测试菌株的益生特性,以期为开发我国具有自主知识产权的乳酸菌发酵剂,以及为研发具有地域特色的功能性发酵乳品、推动当地乳品行业发展奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
15个驴乳样品来源于新疆哈密地区巴里坤县的健康母驴。驴的品种均为新疆驴,喂养方式是家庭散养型,饲料主要为苜蓿、青干草和秸秆混合,日产乳约1~2 kg,用处主要是农作、拖货等。驴乳收集时,并无自动的挤乳设备,由牧民佩戴一次性无菌手套,用75%乙醇溶液浸泡的纱布擦拭母驴乳头及周围,并丢弃第1批乳,收集5 mL的驴乳于无菌离心管中,密封和记录后放入-20 ℃的车载冰箱,在24 h内运回实验室贮存于-20 ℃冰箱备用。
1.1.2 指示菌
致病性大肠埃希氏菌(CICC 10411)、肠毒素性大肠埃希氏菌(CICC 10421)、出血性大肠埃希氏菌(CICC 21530)、鼠伤寒沙门氏菌(CICC 10420)、单核细胞性李斯特菌(CGMCC 1.9136)、血清型肠炎沙门氏菌(CGMCC 1.10754)、金黄色葡萄球菌(CICC 21600)和标准菌株鼠李糖乳杆菌GG均购自于中国工业微生物菌种保存管理中心。
1.1.3 培养基与试剂
MRS(Man Rogosa Sharpe)肉汤培养基、MRS固体培养基(MRS肉汤添加1.7%的琼脂)、M17肉汤培养基及M17固体培养基(M17肉汤添加1.7%的琼脂)参照文献[16]配制;LB(Luria-Bertani)培养基、蛋白胨酵母葡萄糖(peptone yeast glucose,PYG)培养基、胰蛋白大豆琼脂(tryptic soy agar,TSA)培养基 海博生物技术有限公司。
邻苯三酚、浓盐酸、硫酸亚铁(均为分析纯)北京奥博星生物技术有限责任公司;脱脂乳粉 内蒙古伊利集团有限公司。
1.2 仪器与设备
DG520厌氧培养箱 英国DWS公司;5810R高速冷冻离心机 德国Eppendorf公司;UVmini-1240紫外分光光度计 日本岛津公司;TC-512聚合酶链式反应(polymerase chain reaction,PCR)仪 德国Biometra公司;凝胶成像系统 法国Vilber公司;相差显微镜上海光密仪器有限公司。
1.3 方法
1.3.1 驴乳样品中乳酸菌的分离纯化
先将MRS、M17培养基配好灭菌后倒平板,待其凝固,将采集的驴乳样品使用无菌生理盐水稀释,在稀释梯度为10-3、10-4、10-5的情况下分别吸取100 μL稀释液于平板上进行涂布,将涂布后的平板放入37 ℃的培养箱中倒置培养36 h[8]。每个平板挑取颜色、大小和形状均不同的单菌落进行镜检,保留细胞形态呈杆状或球状的菌落,连续转接划线培养3 次后,挑取纯的单菌落于MRS培养基上,37 ℃培养24 h,培养物进行革兰氏染色和接触酶实验,从而实现疑似乳酸菌的初步筛选、分离及纯化。将疑似乳酸菌活化、富集后,以2%接种量接种到12%灭菌脱脂乳中37 ℃培养,选择使脱脂乳凝乳完全,表面无乳清析出的菌株保藏至-80 ℃备用。
1.3.2 16S rRNA基因序列分析
将具备凝乳特性的菌株进行分子生物学鉴定,确定其种属。DNA的提取采用改良后的苯酚-氯仿-玻璃珠法[12]。利用27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-TACGGTTACCTTGTTACGACTT-3’)PCR通用引物对菌株进行基因扩增[16]。扩增条件为:35个循环(95 ℃预变性5 min,94 ℃变性30 s,55 ℃退火40 s,72 ℃延伸1 min),72 ℃终延伸10 min。吸取3 μL的PCR产物于1.5 g/100 mL琼脂糖凝胶电泳检测后,将余下PCR产物送至上海美吉公司测序。将所测的16S rRNA基因序列提交到GenBank数据库中,利用BLAST进行序列同源性分析,采用MEGA v.7.0软件建立发育树。
1.3.3 优良发酵剂筛选
1.3.3.1 凝乳时间确定、酸度测定及感官评价
菌株活化后,再经生理盐水洗涤和重悬,按2%接种量转接至脱脂乳中,37 ℃发酵培养,凝乳后记录凝乳时间并将其放入4 ℃冰箱冷藏,取冷藏24 h后的样品进行酸度测定和感官评价,其中酸度测定方法参考文献[7]。
组织经过培训的10 名食品专业的学生对样品的气味、外观、质地、口感和喜爱程度5个感官指标进行评价,每个指标均为20 分,具体评价标准参考文献[17]。
1.3.3.2 菌株产酸能力的测定
将乳酸菌活化后,再经洗涤和重悬后,按2%的接种量转接至脱脂乳中,37 ℃发酵培养。每隔2 h取样,测定可滴定酸,连续测定24 h,并作酸度随时间变化的产酸曲线,酸度测定参考文献[7]。
1.3.3.3 菌株后酸化能力的测定
将达到发酵终点的样品在4 ℃冷藏,分别于第1、4、8、12、16、20天取样测定滴定酸度。酸度测定参考文献[7]。
1.3.3.4 菌株产香能力的测定
参考苏媛宁等[18]的方法,测定后熟1 d后发酵乳的双乙酰和乙醛含量。
1.3.3.5 发酵乳中活菌数的测定
样品在4 ℃冷藏,分别于第1、4、8、12、16、20天取样稀释涂布,利用平板计数法测定活菌数。
1.3.4 菌株益生特性分析
1.3.4.1 模拟胃肠液实验
模拟胃液的配制:125 mmol/L NaCl、7 mmol/L KCl、45 mmol/L NaHCO3和3 g/L胃蛋白酶,用浓盐酸调节pH 2.5;模拟肠液的配制:45 mmol/L NaCl、1 g/L胰蛋白酶、3 g/L牛胆盐,用NaOH溶液调节pH 8.0,所配溶液均过0.22 μm滤膜除菌[19]。
菌株活化后,以1%的接种量接种于液体MRS培养基,37 ℃培养24 h后,3 000×g离心10 min后收集菌体,反复洗涤后重悬,再以1%的接种量接种于模拟胃液中,混匀,37 ℃培养,分别在0、90、180 min取样进行活菌计数;另吸取1 mL重悬液接种到9 mL模拟肠液中,37 ℃培养,分别在第120分钟和第240分钟取样进行活菌计数。阴性对照为液体MRS培养基,阳性对照为鼠李糖乳杆菌GG。3 次平行,统计结果[20]。
1.3.4.2 抑菌实验
无细胞发酵上清液(cell-free fermentation supernatant,CFCS)的制备:菌株活化后,以1%接种量接种于液体MRS培养基中,37 ℃培养24 h后,7 500×g离心10 min获得上清液,过0.45 μm滤膜除菌,pH值调节至6.5,4 ℃保存备用。此外,为确定CFCS中抑菌物质是否含有类细菌素物质,向CFCS中加入1 mg/mL蛋白酶K,37 ℃水浴2 h后,4 ℃保存备用[21]。
抑菌实验采用牛津杯法[22]。将致病性大肠杆菌(EC1)、肠毒素性大肠杆菌(EC2)、出血性大肠杆菌(EC3)和金黄色葡萄球菌(SA)接种于液体LB培养基中;将血清型肠炎沙门氏菌(SM1)和鼠伤寒沙门氏菌(SM2)接种于液体TSA培养基中;将李斯特菌(LS1)接种于液体PYG培养基中。以上致病菌均在37 ℃培养18 h,各取0.1 mL培养液稀释,得到浓度约为105~106CFU/mL的稀释液。分别取0.1 mL菌悬液均匀涂布在对应的培养基表面,于其表面上等距离放入4个牛津杯,其中3个加入0.2 mL CFCS或经蛋白酶处理的CFCS,余下1个加入无菌的MRS培养基(空白对照),4 ℃预扩散6~8 h后,37 ℃培养24 h,测定抑菌圈直径,每组3个平行,求其均值。
1.3.4.3 药敏实验
根据WHO推荐使用的方法[23],采用K-B纸片扩散法对菌株进行20 种常用抗生素的药敏实验。将菌悬液稀释至107~108CFU/mL,取0.12 mL于MRS固体培养基表面后,涂布均匀,待表面干燥后将抗生素药片贴于其表面,每个培养基均分贴4个药片,贴好后37 ℃倒置培养24 h,观察结果,测量抑菌圈直径,每种药片3个平行。
1.3.4.4 抗氧化活性测定
参考Shi Yunjia等[24]方法,略作修改,对菌株进行羟自由基、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基和超氧阴离子自由基清除实验。制备抗氧化活性测定样品[24]:菌株接种于液体MRS培养基中,37 ℃培养24 h后,9 000×g离心5 min,弃上清液,菌体用无菌水洗涤2 次,再重悬于无菌水中至菌浓度为109CFU/mL。
羟自由基清除实验:将1 mL 0.75 mmol/L 1,10-邻菲咯啉溶液、1 mL 0.75 mmol/L FeSO4溶液、1.5 mL 0.15 mol/L磷酸盐缓冲溶液和1 mL 0.01% H2O2溶液混合均匀后,立即加入1 mL CFCS,摇匀后37 ℃反应30 min,测定536 nm波长处吸光度,3 次平行。羟自由基清除率按式(1)计算:
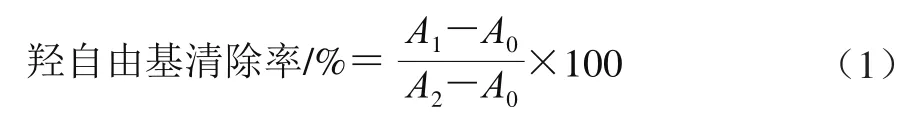
式中:A1为样品与自由基反应后的溶液吸光度;A0为水代替样品反应后的溶液吸光度;A2为水代替自由基反应后的溶液吸光度。
DPPH自由基清除实验:将1 mL 0.2 mmol/L DPPH-乙醇溶液和0.8 mL CFCS混合均匀,黑暗下反应30 min,测定517 nm波长处吸光度,3 次平行。DPPH自由基清除率按式(2)计算:

式中:A1为样品与自由基反应后的溶液吸光度;A0为水代替样品反应后的溶液吸光度。
超氧阴离子自由基清除实验:将0.2 mL 0.1 mol/L Tris-HCl缓冲液和0.8 mL CFCS混合均匀,测定320 nm波长处吸光度;再向混合液中加入0.1 mL 3 mmol/L邻苯三酚溶液,混合均匀后再次测定320 nm波长处吸光度。超氧阴离子自由基清除率按式(3)计算:
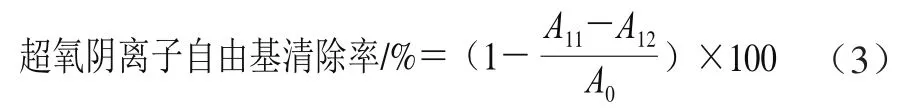
式中:A11为加入邻苯三酚的溶液吸光度;A12为未加入邻苯三酚的溶液吸光度;A0为水代替样品的溶液吸光度。
1.4 数据处理
实验数据处理采用SPSS 25软件进行分析,实验重复3 次,结果以表示,显著性分析使用Duncan检验(P<0.05,差异显著);使用Origin 9.0软件绘图,热图绘制采用Heml 1.0软件。
2 结果与分析
2.1 疑似乳酸菌菌株的分离
从15个驴乳样品中共分离出56 株纯培养物,通过肉眼观察菌落大小、颜色,镜检菌落形态为杆状或球状,以及革兰氏阳性和接触酶阴性确定38 株疑似乳酸菌,其中具有明显凝乳特性的菌株7 株。
2.2 16S rRNA基因序列分析结果
将7 株菌的16S rRNA部分基因序列提交至GenBank数据库进行同源性比对,选取相似性高的菌株序列构建的系统发育树见图1。可知,HL12-21、HL29-5、HL30-3、HL21-44、HL26-24、HL29-1和HL13-23分别与乳酸片球菌(Pediococcus acidilactici)、戊糖片球菌(Pediococcus pentosaceus)、蒙氏肠球菌(Enterococcus mundtii)、植物乳杆菌(Lactobacillus plantarum)、棒状乳杆菌(Lactobacillus coryniformis)、弯曲乳杆菌(Lactobacillus curvatus)和乳明串珠菌(Leuconostoc lactis)的亲缘关系最近,且序列相似性均高达100%。
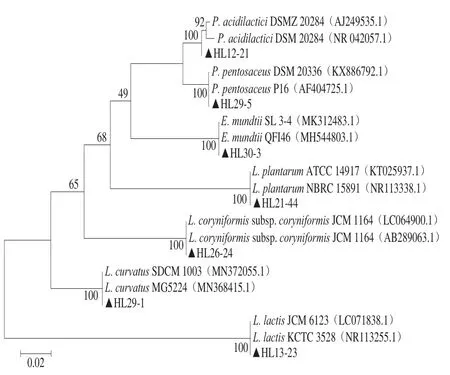
图1 基于16S rRNA基因序列的乳酸菌系统发育树Fig. 1 Phylogenetic tree of lactic acid bacteria based on 16S rRNA gene sequence
2.3 优良发酵剂筛选
2.3.1 凝乳时间、酸度及感官评价结果
凝乳时间的长短不仅体现了菌株的生长以及产酸特性,时间太短,则不利于酸乳香味的形成,若时间太长,影响生产成本[25]。由表1可知,7 株菌株的凝乳时间在13 h内,但发酵剂由多种菌制备,可以弥补部分菌株凝乳时间过长的缺陷,所以它们的凝乳时间均在可接受范围。
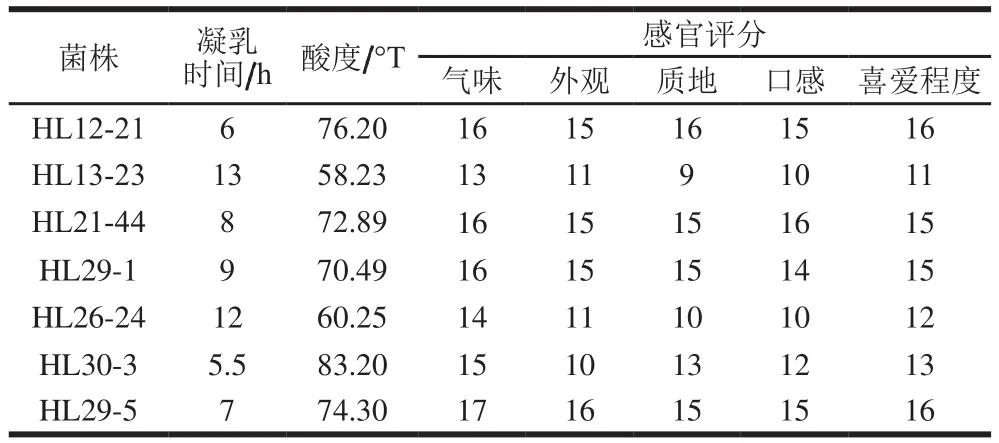
表1 7 株菌制备酸乳凝乳时间、酸度及感官评价结果Table 1 Milk coagulation times, acidities and sensory evaluation scores of milks fermented with seven selected strains
7 株菌制备酸乳4 ℃冷藏24 h后酸度在58~85 °T之间(表1),GB 19302—2010《发酵乳》[26]规定酸乳酸度应大于70 °T,虽然菌株HL26-24和HL13-23制备的酸乳酸度低于70 °T,但考虑到后期是复合发酵剂制备酸乳,因此可以弥补2 株菌产酸不足的缺陷。
感官评价是评价酸乳质量、口感和风味等重要指标[27],对菌株能否用于酸乳的生产至关重要。如表1所示,由菌株HL12-21、HL21-44、HL29-1和HL29-5分别制备的酸乳均色泽良好,呈乳白色,具有酸乳特有的风味,无气泡,无乳清析出,质地细腻且表面光滑,它们的综合评分最高;菌株HL30-3制备的酸乳色泽呈微黄色,具有酸乳特有的风味,虽表面有轻微的乳清析出,但质地细腻和无气泡;菌株HL13-23和HL26-24制备的酸乳色泽呈乳白色,具有酸乳特有的风味但有少许涩味。
2.3.2 产酸能力测定结果
菌株产酸能力是评价发酵剂的一项重要指标,不同菌株产酸能力不同,且产酸强弱会影响发酵乳的口感、风味和质量等,较弱的菌株将失去利用价值[28]。只有产酸速率适中的菌株,才能满足生产需求。由图2可看出,在6 h前,所有菌株的产酸速率均增加缓慢,但在6 h后,产酸速率迅速增加,并在18 h后趋于稳定。其中菌株HL30-3产酸速率速率最快,18 h内酸度达到105.38 °T,表明该菌产酸能力最强。在18 h内,菌株HL12-21、HL29-5、HL21-44、HL29-1的酸度分别由24.43、23.84、20.58、19.48 °T增加到84.12、79.28、78.56、76 °T,这4 株菌的产酸速率较快,表明它们产酸能力较强。菌株HL26-24和HL13-23的产酸速率较慢,在18 h后分别达到66、64.85 °T,二者产酸能力较弱,在生产中容易造成产品污染。
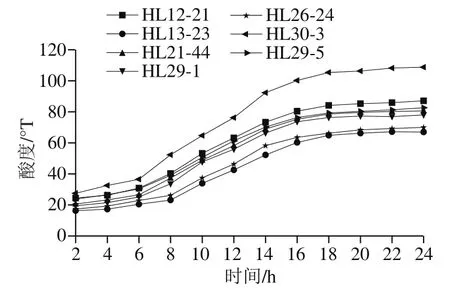
图2 乳酸菌的产酸曲线Fig. 2 Acid production curves of seven LAB strains
2.3.3 后酸化能力测定结果
在贮藏期间,后酸化是影响酸乳感官品质和风味特性的重要因素,过度的产酸将使发酵乳酸度太高,大量乳清析出,降低了产品的货架期[29],因此需选后酸化较弱的菌株作为发酵剂。如图3所示,4 ℃贮藏20 d后,7 株菌的酸度均呈上升的趋势,其中菌株HL30-3的酸度增加了17 °T,变化最大,后酸化较强,可能造成酸乳品质的下降和缩短货架期;菌株HL26-24、HL13-23的酸度变化较小,分别增加了4.8、3.27 °T,且它们最终酸度也低于65 °T,可能与菌株自身产酸较低有关;其余4 株菌的酸度增幅一般,在5~8 °T之间,表明除菌株HL30-3外,其余6 株菌具有较好的抗后酸化能力,不会影响酸乳的风味、口感和质地等。

图3 酸乳冷藏期间酸度的变化Fig. 3 Change in acidity of milks fermented with seven selected strains during cold storage
2.3.4 产香能力测定结果
乙醛和双乙酰是构成发酵乳典型风味的重要物质,可以依据二者的含量判断菌株的产香能力[6]。此外,形成香味物质的高峰一般在发酵结束后,但由于多种风味物质相互作用才能得到良好风味,所以需要12~24 h才能完成其产香过程[18],本实验的样品为后熟1 d后的发酵乳。实验所得双乙酰标准曲线的方程为Y=0.121 5X+0.023 8(R2=0.999 1,Y为OD335nm,X为双乙酰质量浓度/(mg/L))。如图4所示,菌株HL30-3、HL29-5、HL12-21、HL21-44和HL29-1的乙醛质量浓度较高,分别为18.45、17.48、15.38、12.2 mg/L和11.3 mg/L,其余2 株菌均低于10 mg/L,据报道乙醛含量与酸度呈正相关[27],本实验结果与之类似;7 株菌的双乙酰质量浓度较低,在2.28~4.8 mg/L之间,也有研究报道,产生香味物质能力强的菌株,一般双乙酰的含量较小[7]。除菌株HL13-23外,其余菌株的乙醛和双乙酰含量的比例均高于3∶1,一般认为乙醛与双乙酰含量之比大于3∶1时,且乙醛含量越高,酸乳的风味越好[29],表明菌株HL30-3、HL29-5、HL12-21、HL21-44和HL29-1产香能力较好且制备的酸乳风味较佳,这与感官评价结果类似。
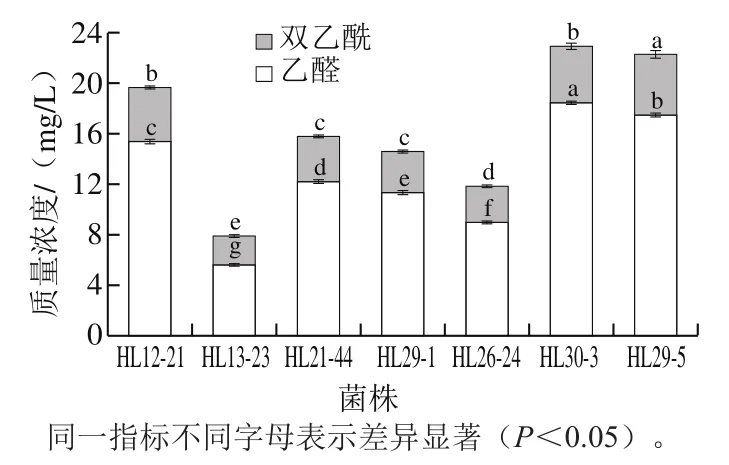
图4 菌株产香能力测定结果Fig. 4 Determination of aroma-producing capacity of the strains
2.3.5 发酵乳中活菌数分析
有研究表明,发酵乳的活菌数含量高于106CFU/mL才能在人体产生有益作用,也是体现活性乳酸菌制品具有保健功能的重要指标之一[30]。如图5所示,后熟1d后,所有菌株的活菌数均高于108CFU/mL,在1~4 d内,活菌数达到最高,可能是这些菌在冷藏前期还具有活性能利用乳中的残糖;随着贮藏时间的延长,所有菌株的活菌数均呈下降趋势,这是因为菌株所处介质酸度较高,贮藏温度低,抑制了它们的生长和繁殖。贮藏20 d后,除菌株HL26-24和HL13-23外,其余5 株菌株的活菌数仍高于106CFU/mL,满足相应的要求。

图5 贮藏期间活菌数变化Fig. 5 Changes in viable bacterial count during storage
2.4 菌株益生特性
2.4.1 模拟胃肠液实验结果
乳酸菌进行模拟胃肠液实验能更好地反映菌株在胃肠道环境中的存活情况,对胃肠液的耐受性是潜在益生菌的重要特性,菌株在受到胃酸(低pH值)和肠道环境(胆盐和胰酶)的影响后,保持足够数量对乳品工业的应用也非常重要[31]。对7 株菌与鼠李糖乳杆菌GG进行模拟胃肠液实验,结果见表2。菌株在模拟胃液中均能较好地存活,其中HL29-1、HL30-3、HL29-5和鼠李糖乳杆菌GG的存活情况最好,经过180 min处理后的活菌数仍在107CFU/mL以上。此外,相比模拟胃液而言,模拟肠液对菌株的影响更显著。在模拟肠液中处理120 min后,除HL26-24和鼠李糖乳杆菌GG的活菌数降低至107~108CFU/mL外,其余6 株菌的活菌数在108CFU/mL以上;处理240 min后,活菌数均出现了不同程度的下降,其中HL12-21、HL21-44和HL29-5的活菌数降低至107~108CFU/mL,其余菌的活菌数降低至107CFU/mL以下。因为对低pH值或高胆汁的抗性机制取决于物种和菌株[32],部分菌株的模拟胃肠液耐受性差异明显。综合模拟胃肠液实验结果,与鼠李糖乳杆菌GG相比,菌株HL12-21、HL13-23、HL21-44、HL30-3和HL29-5能在胃肠道环境中较好地生存。
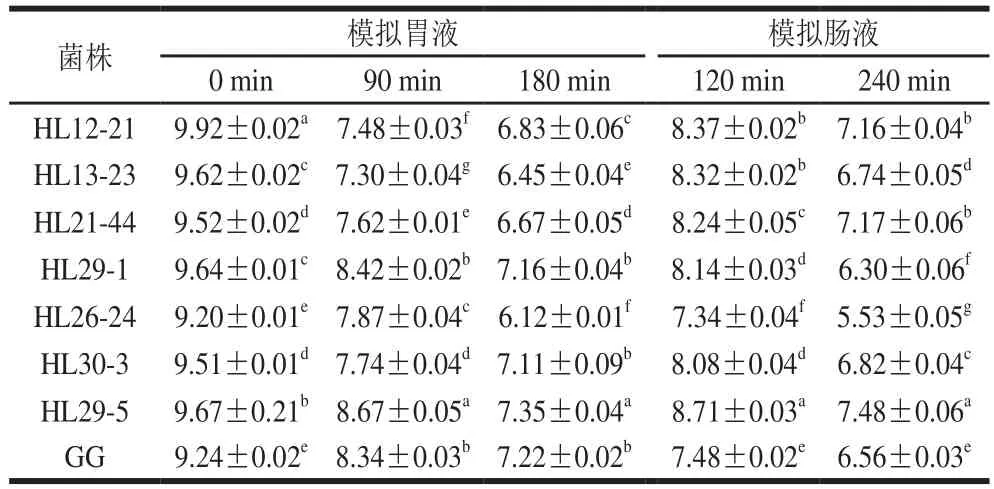
表2 乳酸菌在模拟胃液和肠液中的活菌计数结果Table 2 Viable counts of lactic acid bacteria when exposed to simulated gastric and intestinal juice lg(CFU/mL)
2.4.2 抑菌实验结果
乳酸菌所产的抑菌物质较多,如H2O2、有机酸、CO2和细菌素等[33]。本实验利用经调酸处理的CFCS以及在调酸基础上加入蛋白酶K的CFCS对致病菌进行抑菌能力的测定,结果见图6,颜色从蓝色到红色的渐变过程代表了抑菌圈直径的递增。经排酸处理后,由热图横向看,相比鼠李糖乳杆菌GG,菌株HL30-3、HL13-23和HL29-5的红、橙色区域最多且无深蓝色区域,表明这3 株菌的抑菌谱较广及抑菌能力更强;而其余菌株多为蓝色区域,表明它们抑菌谱较窄且抑菌能力一般。纵向看,红、橙色区域主要集中在EC1、EC2、LS1和SA的区域中,表明大部分菌株对致病性、肠毒素性大肠埃希氏菌、单核细胞性李斯特菌和金黄色葡萄球菌有较好的抑菌能力。
当在调酸基础上加入蛋白酶K处理后,由图6可知,菌株HL30-3和HL29-5的大多数颜色区域变为蓝色,而其余菌株的颜色区域变化较小。由于抗菌化合物可以竞争性排斥病原体在肠道的生存和表达,且对蛋白酶敏感[21],因此菌株HL30-3和HL29-5的抑菌作用可能源自发酵过程产生的类细菌素,而其余菌的抑菌作用可能主要源自H2O2和CO2等,且抑菌活性可能依赖于物种和菌株[34]。总体来说,与鼠李糖乳杆菌GG相比,菌株HL30-3、HL13-23和HL29-5抑菌能力强。
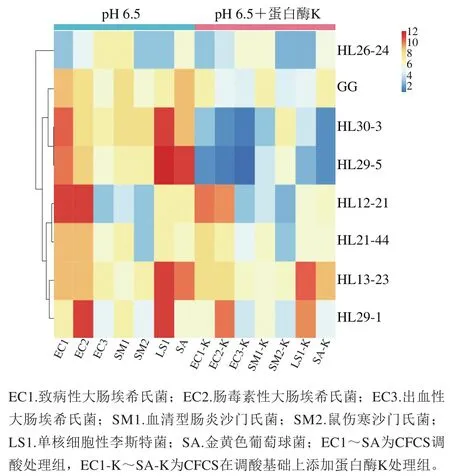
图6 基于抑菌圈直径对乳酸菌抑菌能力的热图分析Fig. 6 Heatmap analysis of anti-pathogen activity of lactic acid bacteria based on the diameters of the zone of inhibition
2.4.3 药敏实验结果
益生菌对抗生素的耐受性会对人体安全性产生较大影响[35]。益生菌在拮抗致病菌时,若耐药性基因转移到致病菌后,致病菌将产生耐药性[23]。即使乳酸菌被广泛认为是安全的,但仍需评估其安全性。选用20 种常见抗生素对8 株菌进行药敏实验,结果判定参照CLSI 2015版标准执行,结果见图7。热图通过不同的颜色梯度表示抑菌圈直径大小,可反映出乳酸菌的抗生素耐药情况,颜色从红色到蓝色的过程代表抑菌圈直径的递减,整体可知,蓝色区域主要集中在卡那霉素、阿卡米星、环丙沙星、诺氟沙星、多黏菌素、万古霉素和替考拉林,表明这7 种抗生素对大部分菌株无抑制作用,表现出耐药性,菌株对卡那霉素的耐药性已经在部分研究中报道过,可能是缺乏细胞色素介导的药物吸收电子传递机制和细胞膜的不渗透性造成[21],对万古霉素的耐药性被认为是由于D-Ala-D-lactate取代了存在于肽聚糖中的正常靶标D-Ala-D-Ala[36],对其他抗生素的耐药性可能是由于该抗生素在乳酸菌细胞中缺乏靶位。横向看,菌株HL30-3、HL29-5和鼠李糖乳杆菌GG的大部分区域处在红、绿色之间,表明大部分抗生素对这3 株菌有抑制作用;菌株HL21-44、HL26-24和HL29-1部分区域处在红、绿色之间,表明部分抗生素对它们有抑制作用;菌株HL12-21和HL13-23较多区域为蓝色,表明它们对较多抗生素产生耐药性。纵向看,头孢噻肟、四环素、米诺环素、利福平、氯霉素、红霉素、克林霉素、羟氨苄青霉素、青霉素、苯唑西林、链霉素、氯苄西林、庆大霉素的大部分区域处在红、绿色之间,即大部分菌株对它们表现敏感或中度敏感,证实了乳酸菌对这些抗生素的耐药性普遍较低,与相关的研究报道一致[37];而其余7 种抗生素的大部分区域为蓝色,即大部分菌株对它们表现耐药。
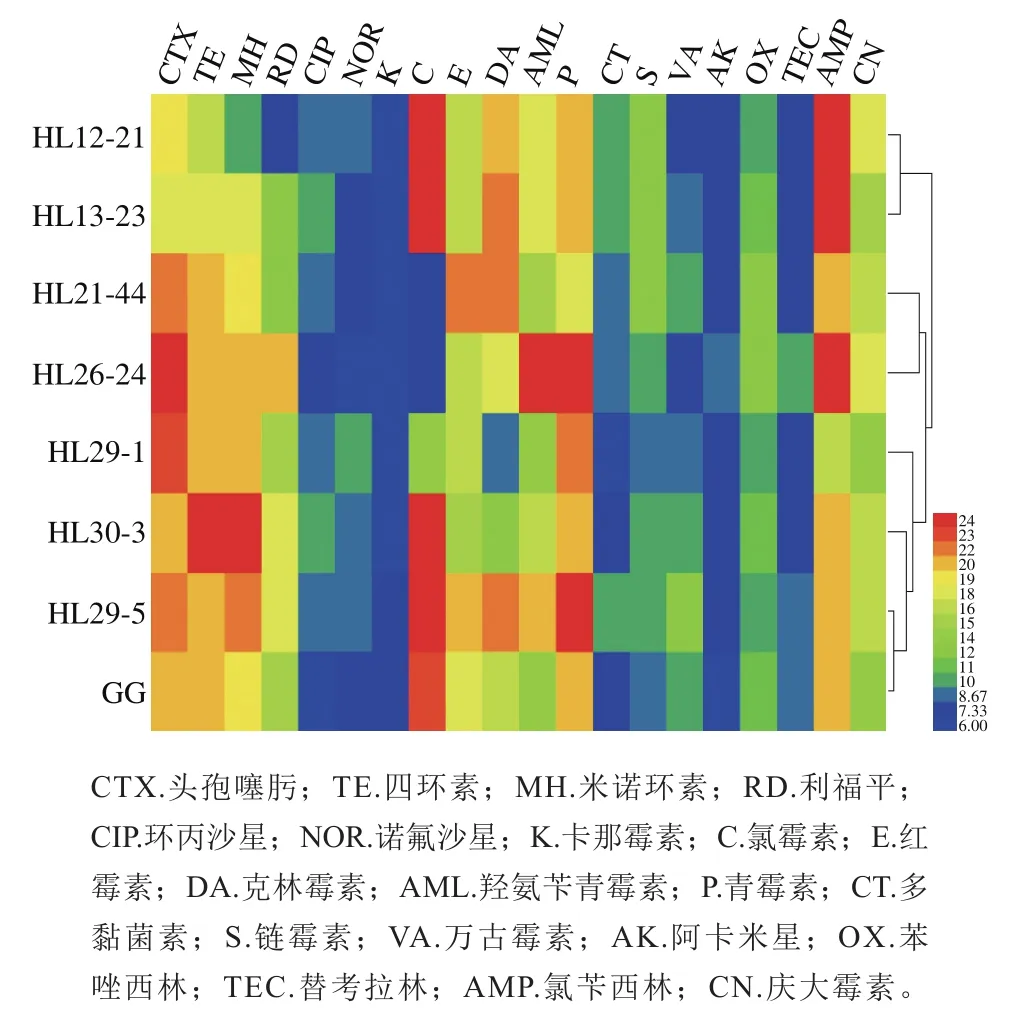
图7 基于抑菌圈直径对乳酸菌的抗生素耐药性的热图分析Fig. 7 Heatmap analysis of the antibiotic tolerance of lactic acid bacteria based on the diameters of the zone of inhibition
2.4.4 抗氧化活性测定结果
机体内的羟自由基、DPPH自由基和超氧阴离子自由基等自由基氧化性强,产生的氧化应激反应会导致DNA、蛋白质、小细胞分子等损伤,进而对机体造成氧化损伤[38]。因此,评价菌株的抗氧化活性极其重要。有研究报道,仅通过单一自由基清除率判定菌株的抗氧化活性准确性不高,为提高结果的有效性,可综合对多种自由基的清除率判定[25]。采用乳酸菌的活细胞悬浮液进行抗氧化活性实验,结果如图8所示,菌浓度为109CFU/mL时,8 株菌对3种自由基均有一定的清除能力,清除率均超过10%,表明它们具有一定的抗氧化活性,可能是因为这些菌株的细胞内存在金属离子Cu2+和Fe2+等天然螯合剂,金属离子被螯合后,使过氧化反应减缓及细胞表面存在的蛋白质、多糖等化合物具有清除自由基的作用[39-40]。对比3种自由基清除率,8 株菌对超氧阴离子自由基的清除率最高,可能是菌体产生较多的超氧化物歧化酶,而该酶具有清除超氧阴离子自由基的能力[38]。此外,与标准菌株鼠李糖乳杆菌GG相比,菌株HL21-44、HL29-5和HL30-3对3种自由基的清除率均较高且超过30%,表明这3 株菌的抗氧化活性强于对照菌株。抗氧化活性好的菌株可作为潜在的抗氧化菌株应用于功能食品开发,有助于预防和控制氧化应激相关疾病。
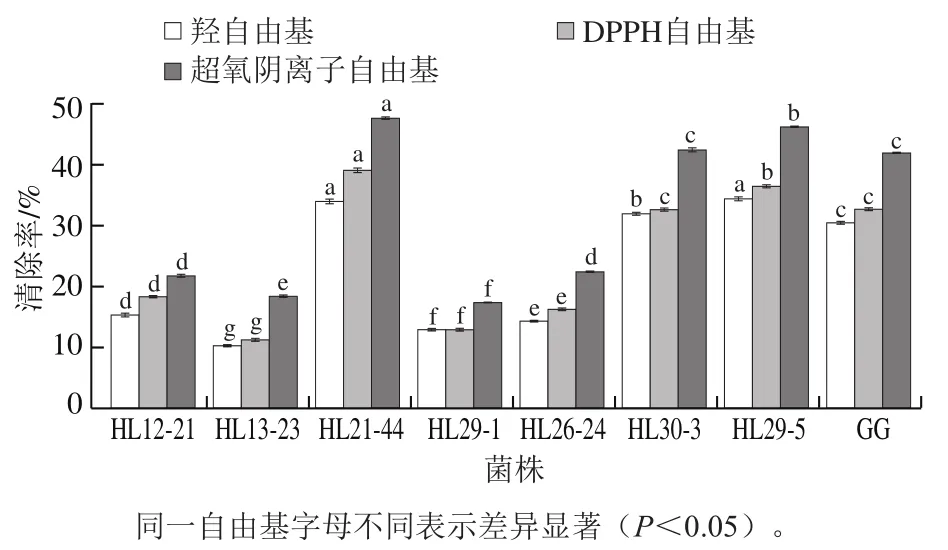
图8 菌株的抗氧化活性Fig. 8 Antioxidant activity of the strains
3 结 论
本研究结合乳酸菌的传统分离鉴定方法,从新疆哈密地区采集的驴乳中纯化分离出38 株疑似乳酸菌,其中7 株菌具有明显凝乳性能,经16S rRNA基因测序鉴定菌株HL12-21、HL29-5、HL30-3、HL21-44、HL26-24、HL29-1和HL13-23分别为P. acidilactici、P. pentosaceus、E. mundtii、L. plantarum、L. coryniformis、L. curvatus和L. lactis。对7 株菌的凝乳时间、产酸能力、后酸化能力、产香能力、感官特性和冷藏期间活菌数等指标检测显示,7 株菌的凝乳时间短,其中菌株HL30-3具有较好的产酸、产香能力,但后酸化过强可能造成酸乳品质的下降和缩短货架期;菌株HL13-23和HL26-24具有较弱的后酸化,但产酸和产香能力较差,不能满足实际生产需求;菌株HL12-21、HL29-5、HL21-44和HL29-1具有更好的产酸、产香能力及弱的后酸化,单菌发酵乳的色泽、质地及风味综合评分最高,且4 ℃贮藏20 d后,活菌数仍保持在106CFU/mL以上,符合优良发酵剂的基本特征。此外,比较了7 株分离菌株和益生菌鼠李糖乳杆菌GG对模拟胃肠液的耐受性,以及抑菌谱、抗生素耐药、抗氧化活性,结果表明菌株HL29-5和HL30-3对以上益生菌筛选指标表现更优,尤其对羟自由基、DPPH自由基和超氧阴离子自由基的清除率最高(超过30%)。本研究表明驴乳是筛选优良乳酸菌发酵剂的良好来源,其中P. pentosaceusHL29-5具有作为益生性发酵剂的潜力,并为后续研发具有地域特色的发酵乳制品提供了菌株资源,为推动当地乳品行业发展奠定了基础。
