牛免疫球蛋白G的体外人源唾液酸化及Fc片段的制备
2022-02-16李天慧陈春旭陈贵杰曾晓雄
李天慧,陈春旭,2,陈贵杰,孙 怡,曾晓雄,*
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.安徽科技学院食品工程学院,安徽 凤阳 233100)
免疫球蛋白G(immunoglobulin G,IgG)作为一种重要的免疫活性物质[1],不仅存在于体液中,也是牛初乳中的主要抗体之一[2],其主要功能是负责识别、中和以及消除病原体和有毒抗原带来的危害[3]。IgG由具有可变和恒定结构域的2 条相同重链和轻链组成[4],其识别结合功能主要发生在抗原结合片段(Fab)的可变域,而可结晶片段(Fc)的恒定域则与效应分子和细胞的相互作用相关[5]。作为一种糖蛋白,IgG的糖基化结构与其功能紧密相关。IgG的糖基化在其Fab与Fc片段均可以发生,Fc片段包含至少2个保守的N-糖基化位点[1],而Fab片段存在15%~25%的N-糖基化[6]。IgG的N-糖基化已被证明与疾病的发生和发展密切相关[7-8]。例如,IgG的末端半乳糖和唾液酸含量可作为炎性疾病子宫内膜异位症诊断的补充参数[9];改变IgG的糖基化类型可作为治疗溶骨性骨质疾病的一种治疗手段[10]。此外,并非只有内源性IgG可以参与免疫调节,外源性IgG对人体也有积极作用。Kaneko等[3]发现唾液酸化IgG对于类风湿性关节炎小鼠有良好的治疗效果;Pagan等[11]设计并构建了2 种可溶性糖基转移酶,可在体内将内源性IgG转化为抗炎介质。本课题组最近的研究发现,完整进入结肠的唾液酸化IgG能够通过调节菌株共生关系显著促进成人肠道中双歧杆菌的增殖[12-13]。因此,作为糖基化结构的一种,唾液酸化IgG有着重要的研究价值。
尽管唾液酸化IgG具有相当大的潜在功能,但仅有5%~10%的IgG的N-糖链末端被唾液酸修饰[14]。而且人源与其他动物来源的唾液酸并不相同,人源IgG(human IgG,hIgG)的唾液酸为N-乙酰神经氨酸(N-acetylneuraminic acid,Neu5Ac),动物源如牛IgG(bovine IgG,bIgG)中的唾液酸主要为N-羟乙酰神经氨酸(N-glycolylneuraminic acid,Neu5Gc)。有研究表明非人源的唾液酸与某些疾病如癌症或慢性炎症有关[15-16]。不仅完整的唾液酸化hIgG有着积极的营养功能,其Fc片段也具备抗炎活性。Fc片段是发挥抗炎作用的主要活性成分[3,11,17-18],通常利用木瓜蛋白酶酶切IgG并纯化制备Fc片段[19-21]。因此,本研究拟通过神经氨酸酶将bIgG中Neu5Gc残基水解,利用β-1,4-半乳糖基转移酶(β-1,4-galactosyltransferase,B4GALT1)和α-2,6-唾液酸转移酶(α-2,6-sialyltransferase,ST6GAL1)提高bIgG的Neu5Ac水平,实现bIgG的hIgG转化,并使用木瓜蛋白酶及Protein G蛋白柱制备纯化hIgG的Fc片段,为后续研究唾液酸化hIgG及其Fc片段的生物活性(如抗炎症和调节肠道微生物等活性)提供基础。
1 材料与方法
1.1 材料与试剂
bIgG 北京索莱宝科技有限公司;神经氨酸酶(50 000 U/mL) 美国NEB公司;B4GALT1、尿苷二磷酸半乳糖(uridine 5’-diphosphogalactose,UDP-Gal)、胞苷一磷酸-N-乙酰神经氨酸(cytidine monophosphospate-sialic acid,CMP-SA) 广州昂飞美仑生物科技有限公司;ST6GAL1(≥5 U/mg)美国Sigma公司;木瓜蛋白酶(≥2 000 U/mg)生工生物工程(上海)股份有限公司;Protein G蛋白柱上海翌圣生物公司;1,2-二氨基-4,5-亚甲基二氧基苯双盐酸盐(1,2-diamino-4,5-methylenedioxybenzene dihydrochloride,DMB)、Neu5Gc、Neu5Ac 上海源叶生物科技有限公司;Fc片段标准品 美国Jackson ImmunoResearch公司;其他试剂均为市售分析纯。
1.2 仪器与设备
LC-20高效液相色谱(high performance liquid chromatography,HPLC)仪、Inertsil ODS-3色谱柱(4.6 mm×250 mm,5 μm)、InertSustain C18色谱柱(4.6 mm×250 mm,5 μm) 日本岛津公司;TSK-gel G4000 PWXL色谱柱(7.8 mm×300 mm) 日本东曹株式会社;PowPacTM高电流电泳仪 美国Bio-Rad公司。
1.3 方法
1.3.1 bIgG中唾液酸含量的测定及神经氨酸酶水解条件的优化
1.3.1.1 Neu5Gc、Neu5Ac系列标准溶液的配制
准确称量Neu5Gc、Neu5Ac标准品各10 mg,分别用超纯水溶解并定容至500 mL容量瓶中,配制成质量浓度20 μg/mL的标准母液。吸取标准母液各500 μL配制2 种标准品质量浓度均为10 μg/mL的混合标准母液,梯度稀释后配制成2 种标准品质量浓度梯度均为0.000 64、0.003 2、0.016、0.08、0.4、2、10 μg/mL的系列Neu5Gc、Neu5Ac标准溶液。
1.3.1.2 bIgG中唾液酸的酸水解优化
根据文献[20]的方法并作适当修改。称取一定量bIgG干粉,配制1 mg/mL IgG溶液,取300 mL IgG溶液加入100 μL 0.1 mol/L三氟乙酸(trifluoroacetic acid,TFA)或100 μL 2 mol/L乙酸溶液于80 ℃水浴1 h进行唾液酸残基水解。
1.3.1.3 神经氨酸酶水解bIgG唾液酸残基条件的优化
根据文献[3]的方法并作适当修改。对神经氨酸酶水解bIgG唾液酸残基的反应条件进行优化与选择。选择4、20、40、50 mg/mL bIgG,加入170 U/mL神经氨酸酶,反应体系为5.0 mmol/L CaCl2、50.0 mmol/L醋酸钠的缓冲溶液,pH 7.5,反应48 h。
1.3.1.4 衍生反应
取1.3.1.2节酸水解产物和1.3.1.3节酶水解产物,加入等体积甲醇,并蒸发至干,加300 μL超纯水复溶后,加入50 μL DMB衍生液(8 mmol/L DMB、14 mmol/L连二亚硫酸钠、0.8 mol/Lβ-巯基乙醇、1.5 mol/L冰醋酸)[22],50 ℃避光反应2.5 h,产物以0.45 μm滤膜过滤,用于HPLC分析。
1.3.1.5 HPLC分析
使用InertSustain C18色谱柱对bIgG中2 种唾液酸进行分离和检测,柱温30 ℃,荧光检测器激发波长373 nm、发射波长448 nm,流动相为V(甲醇)∶V(乙腈)∶V(超纯水)=7∶8∶85,流速0.9 mL/min,进样量20 μL。分别以Neu5Gc、Neu5Ac标准溶液质量浓度为横坐标,相应峰面积为纵坐标绘制标准曲线,根据标准曲线方程计算Neu5Gc、Neu5Ac含量,结果以每毫克bIgG计。
1.3.2 Protein G蛋白柱纯化
将唾液酸酶水解后的bIgG经过Protein G抗体纯化柱纯化去除神经氨酸酶、唾液酸等,首先用5 倍柱体积的pH 7.0 20 mmol/L Na2HPO4缓冲液平衡层析柱,然后将样品加到平衡好的Protein G柱中,上样量30.0 mg IgG,保证目的蛋白与树脂充分接触,收集流出液;用10~15 倍柱体积的pH 7.0 20 mmol/L Na2HPO4缓冲液清洗,去除非特异性吸附的杂蛋白;最后使用5~10 倍柱体积的pH 3.0 0.1 mol/L甘氨酸缓冲液进行洗脱,收集洗脱液,即为目的蛋白组分。
1.3.3 体外半乳糖基化和唾液酸糖基化
参考文献[18,23]报道的方法并作适当修改。反应体系中底物IgG终质量浓度7.5 mg/mL、UDP-Gal终浓度2 mmol/L、CMP-SA终浓度2 mmol/L、B4GALT1和ST6GAL1添加量分别为25 mU/10 mg(以IgG质量计),反应缓冲液为50 mmol/L Tris-HCl缓冲液(含10 mmol/L MgCl2),pH 7.5、37 ℃反应48 h。根据文献[24-25]的方法,采用反相离子对液相色谱(reversed phase ion-pair chromatography,RPIC)法分析反应产物,流动相为V(0.01 mmol/L磷酸钾缓冲液(pH 6.5)-1.45 mmol/L四丁基硫酸氢铵)∶V(乙腈)=97∶3,色谱柱为Inertsil ODS-3色谱柱,流速0.8 mL/min,检测波长254 nm。
1.3.4 Fc片段制备条件的优化
参考Guerrier等[26]报道的方法,对木瓜蛋白酶酶解由bIgG转化的hIgG制备Fc片段的条件进行优化。
1.3.4.1 半胱氨酸溶液浓度对Fc片段制备的影响
称取5 份10 mg制备的hIgG溶解于1.0 mL 0.1 mol/L磷酸缓冲溶液(含0.5 mg/mL木瓜蛋白酶,pH 7.0)中,hIgG质量浓度10 mg/mL,再分别加入20.0 μL 0.1 mol/L EDTA溶液(pH 7.0)和终浓度为0、10、20、40、80 mmol/L半胱氨酸溶液,置于37 ℃水浴锅中酶解4 h,反应结束后加入0.2 mol/L碘乙酰胺溶液100 μL,冰浴0.5 h终止反应。制备5%浓缩胶和12%分离胶,浓缩胶电压80 V、电泳30 min,分离胶电压120 V、电泳60 min,随后对蛋白胶进行染色、脱色等步骤进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfatepolyacrylamide gel electrophoresis,SDS-PAGE)分析。
1.3.4.2 酶添加量对Fc片段制备的影响
称取3 份10 mg制备的hIgG分别溶解于1.0 mL 0.1 mol/L磷酸缓冲溶液(其中m(木瓜蛋白酶)∶m(hIgG)分别为0.025、0.05、0.1,pH 7.0)中,hIgG质量浓度为10 mg/mL,再加入20.0 μL 0.1 mol/L EDTA溶液(pH 7.0)和终浓度10.0 mmol/L半胱氨酸溶液,置于37 ℃水浴锅中酶解4 h,反应结束后加入0.2 mol/L碘乙酰胺溶液100 μL,冰浴0.5 h终止反应。然后按1.3.4.1节步骤进行SDS-PAGE分析。
1.3.4.3 酶解时间对Fc片段制备的影响
称取4 份10.0 mg制备的hIgG溶解于1.0 mL 0.1 mol/L磷酸缓冲溶液(含0.5 mg/mL木瓜蛋白酶,pH 7.0)中,hIgG质量浓度为10 mg/mL,再加入20.0 μL 0.1 mol/L EDTA溶液(pH 7.0)和终浓度10.0 mmol/L半胱氨酸溶液,置于37 ℃水浴锅中分别酶解2、3、4、5 h,反应结束后加入0.2 mol/L碘乙酰胺溶液100 μL,冰浴0.5 h终止反应。然后按1.3.4.1节步骤进行SDS-PAGE分析。
1.3.5 HPLC定量检测hIgG及其Fc片段
根据文献[11]报道的方法,使用TSK-gel G4000 PWXL色谱柱,流动相为含0.3 mol/L NaCl的20 mmol/L磷酸盐缓冲液,流速0.6 mL/min,柱箱温度30 ℃,进样量20 μL,检测波长280 nm。
1.4 数据统计与分析
2 结果与分析
2.1 bIgG中唾液酸残基的含量
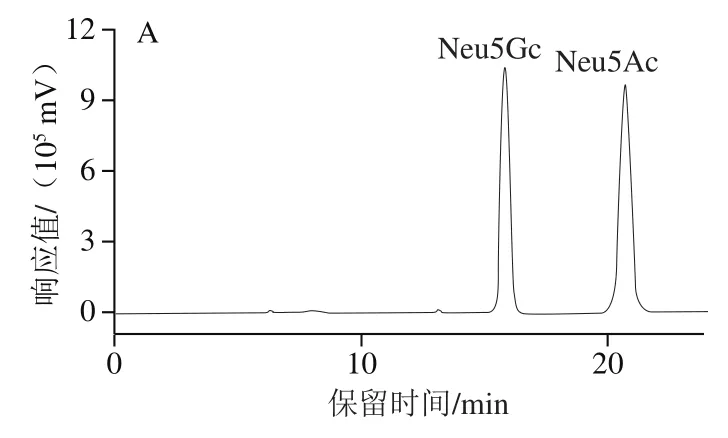
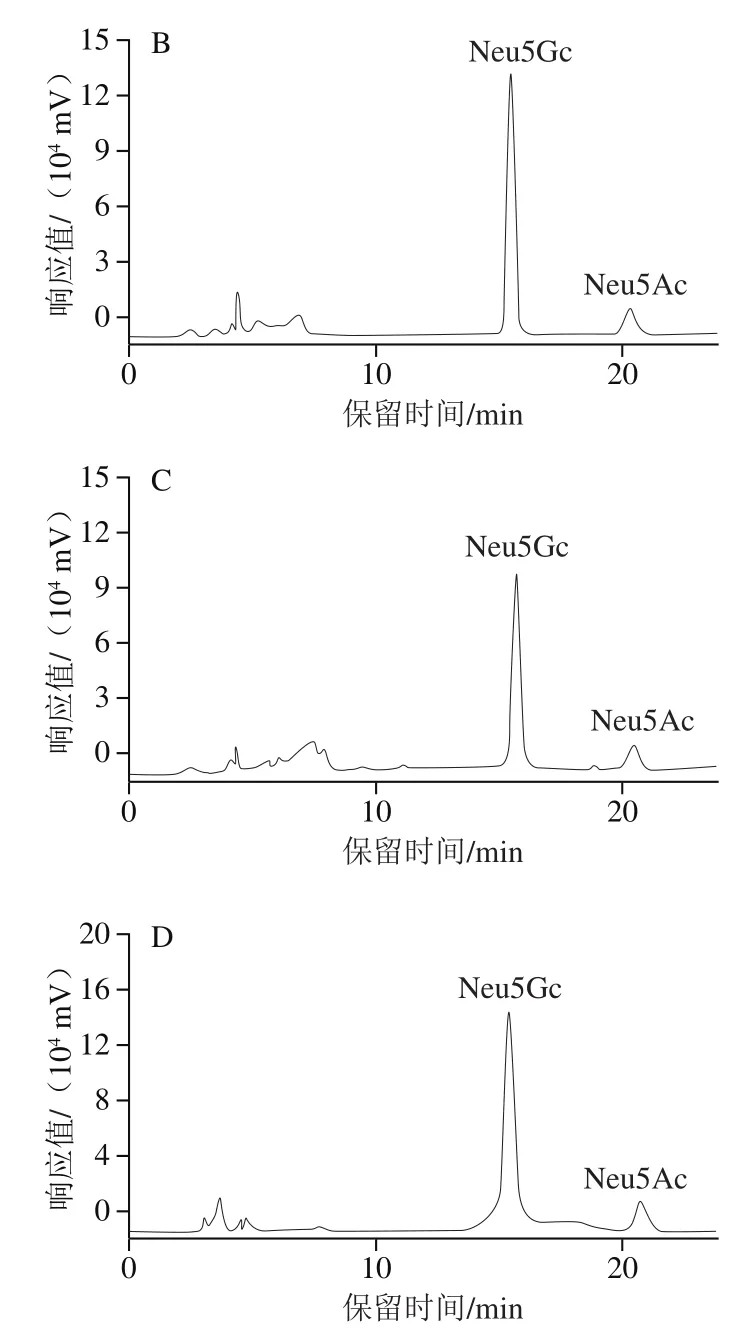
图1 Neu5Gc和Neu5Ac标准品(A)、0.1 mol/L TFA水解样品(B)、2.0 mol/L乙酸水解样品(C)、170 U/mL神经氨酸酶水解样品(D)HPLC图Fig. 1 HPLC chromatograms of Neu5Gc and Neu5Ac standards (A),0.1 mol/L TFA-hydrolyzed sample (B), 2.0 mol/L acetic acid-hydrolyzed sample (C), 170 U/mL neuraminidase-hydrolyzed sample (D)
如图1所示,在15.6 min和20.5 min出现2个峰分别为Neu5Gc和Neu5Ac,不存在明显拖尾现象,分离效果良好。将2 种唾液酸标准溶液进行DMB衍生反应后进行HPLC检测,分别以Neu5Gc、Neu5Ac标准溶液质量浓度为横坐标,相应峰面积为纵坐标绘制标准曲线,得到方程:Neu5Gc:y=7×106x-11 215(R2=0.999 9);Neu5Ac:y=9×106x+341 812(R2=0.999 3),在质量浓度0.000 64~10 μg/mL范围内均线性良好。
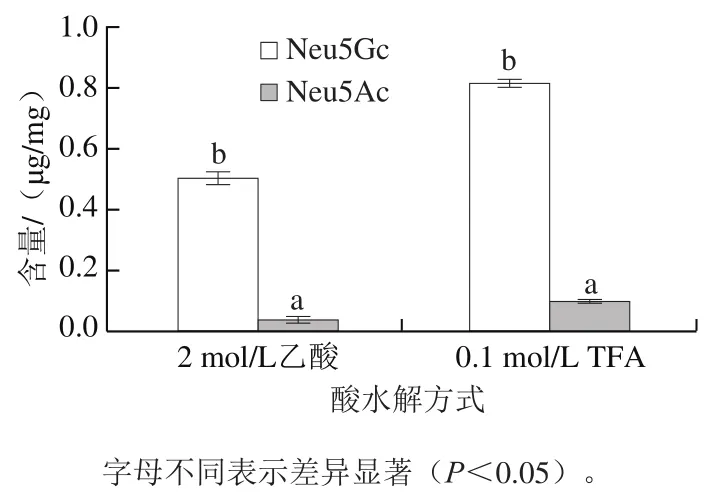
图2 TFA与乙酸水解方式下bIgG中唾液酸含量Fig. 2 Sialic acid contents in bIgG hydrolyzed by TFA or acetic acid
如图2所示,对比0.1 mol/L TFA和2.0 mol/L乙酸2 种酸水解方式下bIgG中唾液酸残基的水解情况发现,0.1 mol/L TFA水解更加彻底。当采用0.1 mol/L TFA水解bIgG时,HPLC检测结果表明,bIgG中Neu5Gc含量为(0.816±0.009)μg/mg,Neu5Ac含量为(0.099±0.003)μg/mg,即1 mol bIgG中所含2 种唾液酸总物质的量为(0.424±0.006)mol,其中n(Neu5Gc)∶n(Neu5Ac)为7.8∶1,Neu5Ac含量远低于Neu5Gc,说明在bIgG中Neu5Gc是唾液酸最主要的存在形式。Ma Li等[27]检测得到中国6 家厂商生产的每1 mol静脉注射人免疫球蛋白的唾液酸化水平为0.875~1.085 mol。表明bIgG的唾液酸化程度低于hIgG的唾液酸化程度。
2.2 神经氨酸酶水解bIgG中唾液酸残基条件的优化结果
为优化神经氨酸酶水解bIgG中唾液酸残基条件,固定神经氨酸酶添加量(170 U/mL),当bIgG质量浓度分别为4、20、40、50 mg/mL时,将0.1 mol/L TFA酸水解bIgG得到Neu5Gc的解离率视作100%。由表1可知,当bIgG质量浓度为4 mg/mL时,170 U/mL神经氨酸酶水解bIgG较为彻底,与0.1 mol/L TFA水解效果相当;随着bIgG质量浓度的升高,解离率下降,这可能是由于当底物bIgG质量浓度超出一定范围后,酶促反应速率不再增大,产物Neu5Gc物质的量达到一定值,计算所得的Neu5Gc解离效率随之下降。因此,以4 mg/mL作为神经氨酸酶酶解反应中bIgG质量浓度。利用酶法将Neu5Gc从bIgG末端解离,与酸水解相比,酶水解对底物更加专一,且这一反应能够在一定程度上降低通过食用动物源食品摄入Neu5Gc造成的致癌等潜在风险[28-30]。
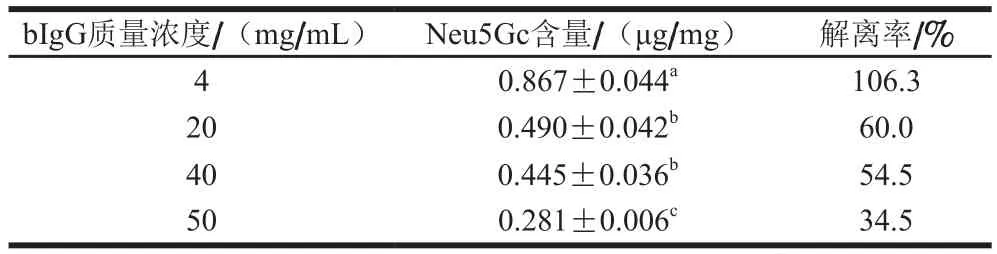
表1 不同bIgG质量浓度的神经氨酸酶水解样品中Neu5Gc含量Table 1 Neu5Gc contents in neuraminidase-hydrolyzed samples with different bIgG concentrations
2.3 hIgG的合成
为除去神经氨酸酶和游离的唾液酸等杂质的影响,bIgG经酶水解后用Protein G蛋白柱进行纯化,纯化后样品再利用B4GALT1、ST6GAL1和供体UDP-Gal、CMP-SA合成hIgG。由于UDP-Gal和CMP-SA被相应的转移酶将半乳糖和Neu5Ac被转移至IgG[31-32],同时产生UDP和CMP,因此利用RPIC检测UDP和CMP水平,对供体转移效果进行间接检测。
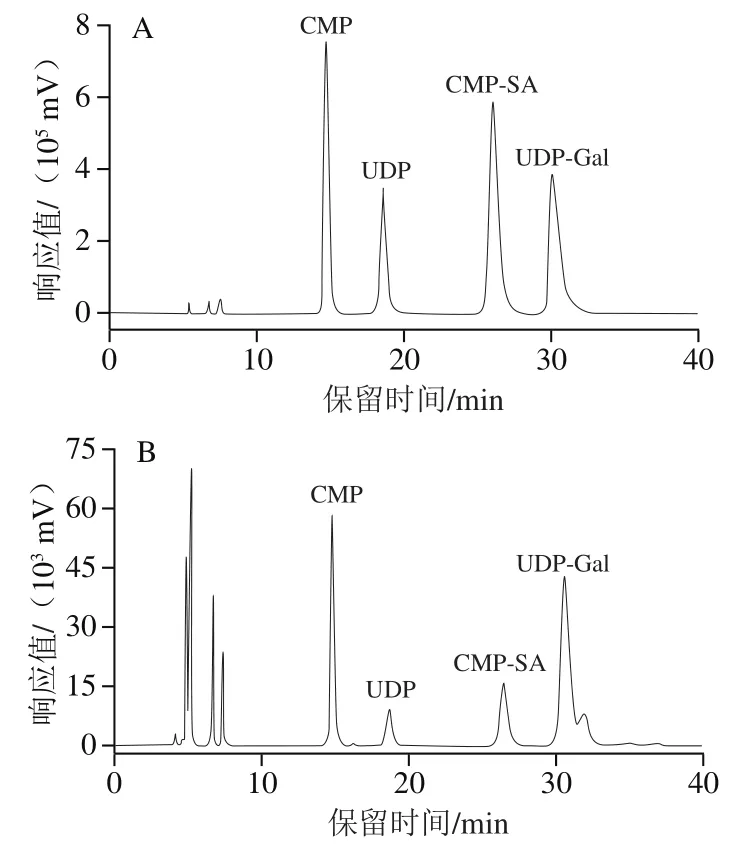
图3 核苷酸与核苷酸糖标准品(A)、体外糖基化后hIgG样品中游离核苷酸与核苷酸糖(B)的RPIC图Fig. 3 Reversed-phase ion-pair chromatograms of nucleotide sugars and nucleotide standards (A), and free nucleotides and nucleotide sugars in in vitro glycosylated hIgG samples (B)

表2 核苷酸与核苷酸糖的标准曲线Table 2 Standard curves for nucleotides and nucleotide sugars
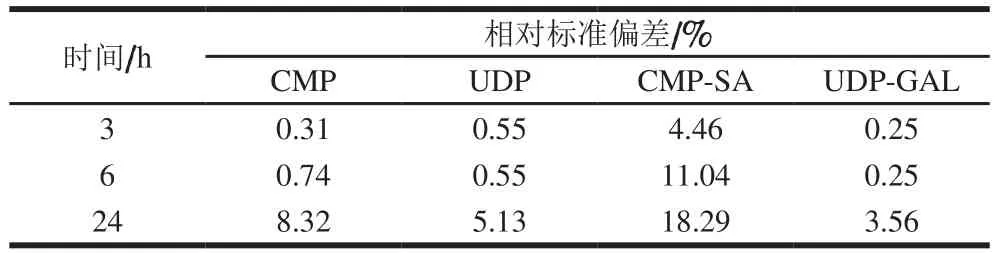
表3 反应结束后不同时间点检测样品中游离核苷酸与核苷酸糖含量的相对标准偏差Table 3 Relative standard deviations for free nucleotides and nucleotide sugars in samples analyzed at different times after reaction
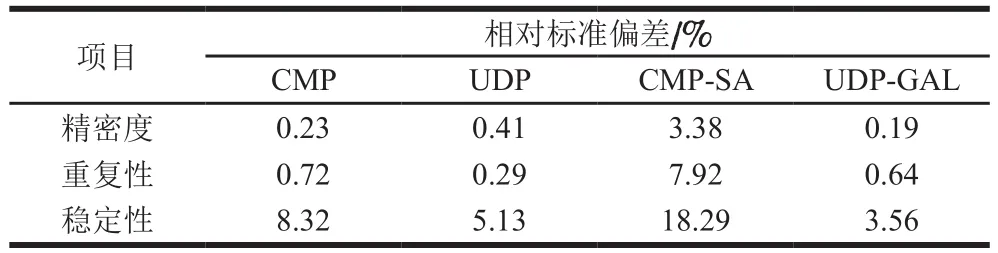
表4 RPIC法检测样品中核苷酸与核苷酸糖含量的精密度、重复性和稳定性结果Table 4 Results of precision, repeatability and stability of RPIC for the determination of nucleotides and nucleotide sugars
由图3可知,CMP、UDP、CMP-SA、UDP-Gal分别在第14.7、18.6、26.4、30.5分钟时出峰,分离明显,标准曲线如表2所示,在0.05~1 mmol/L范围内线性关系良好。反应结束后不同时间点检测样品中游离核苷酸与核苷酸糖的含量,由表3可知,样品中核苷酸类物质含量检测结果的相对标准偏差在反应结束后0~3 h内较好,因此实验样品应在3 h内进行HPLC测定。此外,方法的精密度和重复性也较好(表4)。在此基础上,对体外糖基化hIgG样品中游离核苷酸与核苷酸糖含量进行分析,以增加的游离CMP和UDP物质的量作为转移糖基的物质的量进行计算,结果表明,平均每分子IgG约增加了8.4个半乳糖残基和42个唾液酸残基。唾液酸残基的转移效果明显优于半乳糖残基的转移效果,这可能与bIgG中Neu5Gc残基被水解后,暴露出半乳糖残基,不利于半乳糖残基的转移有关。本实验利用2 种糖基转移酶将半乳糖和Neu5Ac转移至IgG,为制备抗炎症介质提供了思路。
2.4 酶解hIgG制备Fc片段的条件优化结果
2.4.1 半胱氨酸浓度
木瓜蛋白酶是一种巯基蛋白酶,因此需要还原剂激活蛋白酶以发生反应,但过量的激活剂会将IgG进一步还原为更小的片段[33]。如图4所示,不添加半胱氨酸的酶解产物与添加半胱氨酸的酶解产物条带明显不同,添加半胱氨酸后,F(ab’)2片段(约110 kDa)转化为Fab片段[33]。随着半胱氨酸浓度增加,完整的hIgG条带(150.0 kDa)灰度明显变浅,说明酶解程度增加。但同时2 条Fc条带灰度也随着激活剂半胱氨酸浓度的增加而减小,可能是半胱氨酸的还原作用将双链Fc片段还原为单链或更小的片段。当半胱氨酸浓度为20、40、80 mmol/L时,高分子质量Fc片段已不明显,因此选择10 mmol/L作为激活剂半胱氨酸的浓度。
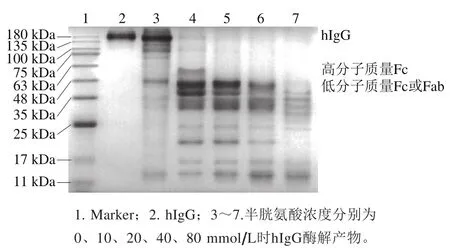
图4 不同半胱氨酸浓度下木瓜蛋白酶水解hIgG产物的非还原SDS-PAGE图谱Fig. 4 Non-reducing SDS-PAGE profile of hIgG hydrolyzed by papain with different cysteine concentrations
2.4.2 木瓜蛋白酶添加量和酶解时间
由图5可知,随着木瓜蛋白酶添加量的增加,hIgG条带逐渐变浅;随着酶解效率进一步升高,高分子质量Fc条带变浅,这可能是由于木瓜蛋白酶作用于次级酶切位点将Fc片段水解为更小的片段。通常认为,木瓜蛋白酶水解IgG分为多个步骤,主要酶切位点位于铰链区,而Fc片段中也存在2个次级酶切位点,分别位于C段第14位和第105位氨基酸残基处。因此,Fc片段可进一步被水解为3个片段:C端短片段(约3.0 kDa)、包含2个CH3结构域的片段(约21.0 kDa)以及包含2个CH2结构域和铰链区的片段(约28.0 kDa)[34]。由此推测,随着酶添加量的增加,木瓜蛋白酶作用于Fc片段的次级酶切位点将其水解为更小的片段。因此,选择m(木瓜蛋白酶):m(hIgG)为0.05作为木瓜蛋白酶最适添加量,以在保证酶解效率的同时得到较高纯度的Fc片段。
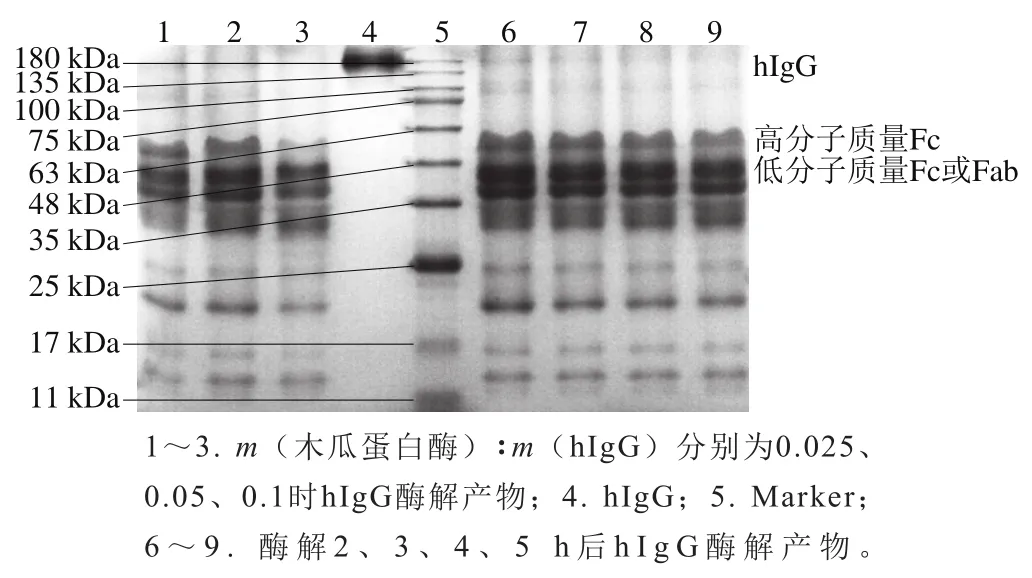
图5 不同酶添加量和酶解时间下木瓜蛋白酶水解hIgG产物的非还原SDS-PAGE图谱Fig. 5 Non-reducing SDS-PAGE profiles of papain hydrolyzed hIgG products at different enzyme dosages and hydrolysis times
此外,随着酶解时间的延长,hIgG条带逐渐变浅,说明hIgG被酶解的更加彻底,但是不同酶解时间2 条Fc片段条带灰度差异并不明显,且酶解2 h后,Fc片段条带已较为明显,为避免酶解时间过长导致木瓜蛋白酶作用于次级酶切位点使Fc片段被进一步酶解为更小片段或被半胱氨酸还原剂还原成单链[35],因此选择酶解时间为3 h。
综合对激活剂半胱氨酸浓度、木瓜蛋白酶添加量和酶解时间的条件优化,最终优化条件为:10 mg/mL hIgG、m(木瓜蛋白酶)∶m(hIgG)=0.05、10 mmol/L半胱氨酸、2 mmol/L EDTA溶液、pH 7、酶解时间3 h。
2.5 hIgG及其Fc片段得率
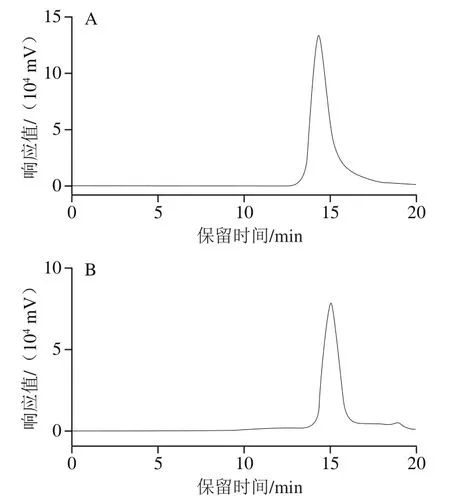
图6 hIgG(A)和hIgG Fc片段(B)的HPLC图Fig. 6 HPLC chromatograms of hIgG (A) and Fc fragment (B)

表5 hIgG和hIgG Fc片段标准曲线Table 5 Standard curves for hIgG and Fc fragment
采用HPLC方法对hIgG及hIgG Fc片段进行定量分析,如图6所示,hIgG和hIgG Fc片段的保留时间分别为14.2 min和15.1 min,hIgG和hIgG Fc片段标准曲线方程如表5所示,在0.07~4.5 mg/mL质量浓度范围内线性良好。根据标准曲线方程计算,95.0 mg bIgG最终得到67.2 mg体外糖基化hIgG,得率为71.7%,40.0 mg体外糖基化hIgG原料经过木瓜蛋白酶水解后可以得到8.3 mg Fc片段,Fc片段得率为20.8%。理论上,Fc片段分子质量约为IgG的1/3,则40.0 mg hIgG中的Fc片段质量为13.3 mg,而实验检测所得仅为8.3 mg,造成损失的原因可能由于Protein G蛋白柱与hIgG的结合力有限,也可能是部分亚型hIgG与Protein G蛋白柱结合力较弱导致[36-37]。尽管制备过程伴随着部分损失,但通过该方法能够获得比天然IgG唾液酸化程度更高的IgG。
3 结 论
本研究采用体外糖基化方法制备唾液酸化hIgG,首先使用优化的神经氨酸酶水解条件将bIgG的Neu5Gc残基酶解,避免了这种非人源唾液酸形式的潜在危害,然后利用B4GALT1和ST6GAL1这2 种糖基转移酶将半乳糖和Neu5Ac转移至bIgG,并经过对木瓜蛋白酶酶解hIgG条件的优化与选择,制备体外糖基化hIgG的Fc片段。结果表明,制备的hIgG分子增加了8.4个半乳糖残基和42个Neu5Ac残基,在10 mg/mL hIgG、m(木瓜蛋白酶)∶m(hIgG)=0.05、10 mmol/L半胱氨酸溶液、2 mmol/L EDTA溶液、pH 7.0条件下酶解3 h可制得较高纯度的hIgG Fc片段,最终hIgG得率为71.7%,Fc片段得率为20.8%。本研究为避免动物源食品的潜在风险开启了新思路,为研究体外糖基化IgG及其Fc片段的生物活性提供了基础,有助于动物源食品人源化产品的开发利用和动物源产品的营养价值评价。
