功能性乳酸菌发酵黑豆麦麸酸面团面包的营养及烘焙特性
2022-02-16曹伟超张宾乐OmediJacobOJOBI邹奇波黄卫宁高铁成
曹伟超,张宾乐,Omedi Jacob OJOBI,黄 璟,陈 诚,邹奇波,黄卫宁,*,李 宁,高铁成
(1.江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;2.张家港福吉佳食品股份有限公司暨江南大学福临门烘焙研究所,江苏 无锡 214122;3.广州焙乐道食品有限公司,广东 广州 511400)
烘焙食品是世界主流食品[1],其中面包类产品是常见的主食食品之一。随着人们消费水平的升级,传统白面包已经无法满足市场需求。近年来,以植物蛋白及膳食纤维为代表的天然植物基配料已成为烘焙食品领域的研究热点。黑豆是一种优质的植物性蛋白源,其蛋白质含量高达40%,并且具有合理的氨基酸组成模式[2]。麦麸含有丰富的膳食纤维,作为一种成本低廉的功能性成分,麦麸具有极大的资源优势[3]。
然而,黑豆蛋白不同于小麦蛋白,因此无法形成具有黏弹特性的面筋网络;麦麸通过物理及化学两种途径破坏面团的稳定性[4],两者均会导致面包品质严重劣化。另一方面,黑豆及麦麸中的植酸含量较高,植酸会与蛋白质相结合进而降低蛋白质的生物利用率[5]。这些因素都极大限制着黑豆及麦麸在面包中的应用。酸面团发酵技术是一种传统的生物技术,它能够改善面包的营养及感官品质[6]。Messia等[7]应用一株短乳杆菌预发酵麦麸以降低麦麸对面筋网络的破坏作用。在Xu Yan等[8]的研究中,乳酸菌发酵使蚕豆蛋白的流变学特性得到明显改善。本课题组已定向筛选出数株乳酸菌并用于降解豆类中的抗营养因子。尽管已有研究[9-10]将各类传统作物应用于酸面团体系,但以兼顾高蛋白及高纤维优势的复配植物基原料作为发酵基质的研究仍鲜见报道。
本研究拟将黑豆及麦麸的高蛋白、高纤维优势与酸面团发酵技术相结合,在两种配料总体替代率为面粉质量15%的基础上,利用两株不同功能特性的乳酸菌作为发酵剂制作高纤维黑豆酸面团面包。探究发酵处理对植酸、黑豆蛋白及麦麸纤维的影响,分析面筋的水合情况,比较面包面团的物性及微观结构差异,同时对面包的营养及感官品质进行评估,旨在开发利用黑豆、麦麸资源,提高面包的营养价值,为复配植物基酸面团发酵技术的工业化应用提供一定的理论参考。
1 材料与方法
1.1 材料与试剂
黑豆粉 阜新佳麦粮品有限公司;90型面包粉河北参花面粉有限公司;麦麸粉 山东禾谷食品有限公司;高产植酸酶乳酸片球菌(Pediococcus acidilactici)L-19筛选自自然发酵黑豆粉;产β-葡萄糖苷酶戊糖片球菌(Pediococcus pentosaceus)J-28筛选自酒曲;胃蛋白酶(3 000~3 500 U/mg)、胰蛋白酶(4 000 U/mg) 合肥博美生物科技有限责任公司;α-淀粉酶(40 000 U/g)、淀粉葡萄糖苷酶(98 U/mg) 上海源叶生物科技有限公司;BCA蛋白浓度测定试剂盒(增强型) 上海碧云天生物技术有限公司;OCT冷冻切片包埋剂(SAKURA 4583型) 北京索莱宝科技有限公司。
1.2 仪器与设备
5K5SS型和面机、SPC-40SP型醒发箱、SM-503型烤箱新麦机械(无锡)有限公司;FE20型pH计 梅特勒仪器(上海)有限公司;2515型高效液相色谱仪(配置2489紫外检测器) 美国Waters公司;TU-1810型紫外分光光度计 北京普析通用仪器有限责任公司;Mixolab混合实验仪、F3流变发酵仪 法国肖邦技术有限公司;拉伸仪 德国Brabender公司;MesoMR23-060V-I型低场核磁共振(low field-nuclear magnetic resonance,LF-NMR)分析仪 苏州纽迈分析仪器有限公司;CT3型质构仪 美国Brookfield公司。
1.3 方法
1.3.1 酸面团的制备
取乳酸片球菌L-19及戊糖片球菌J-28菌悬液各100 μL分别接种至5 mL MRS培养液中,37 ℃培养16 h,8 000 r/min离心5 min,用无菌生理盐水洗涤菌泥2 次。将菌泥重悬于无菌水,分别接种至黑豆麦麸复配基质(黑豆粉与麦麸粉质量比为5∶4,面团得率(DY)为300%,DY/%=(m水+m粉)/m粉×100,每100 g酸面团接种10 mL MRS培养液中获得的菌泥量),30 ℃培养24 h,制得酸面团。
1.3.2 菌株生长曲线的测定
取10 g不同发酵时间的酸面团(每隔2 h取样1 次),加入90 mL去离子水混合均匀,梯度稀释后取100 μL涂布于MRS琼脂平板上,37 ℃培养48 h,观察并进行菌落计数。
1.3.3 酸面团pH值及可滴定酸(total titratable acid,TTA)的测定
参照马子琳等[11]的方法进行。取10 g不同发酵时间酸面团于锥形瓶中,加入90 mL去离子水,磁力搅拌30 min,静置10 min后测定样品溶液pH值。然后用0.1 mol/L NaOH溶液滴定至样品溶液pH值达到8.6,TTA含量以消耗的NaOH溶液体积(mL)表示。
1.3.4 有机酸的测定
取5 g酸面团样品与20 mL 0.01 mol/L KH2PO4混匀,10 000 r/min离心5 min,上清液过0.22 μm有机系滤膜待测。色谱柱:Aqueous C18柱(4.6 mm×250 mm,5 μm);流动相:10 mmol/L KH2PO4(用磷酸调节pH值至2.6);柱温30 ℃;流速1.0 mL/min;进样量20 μL;紫外检测波长210 nm。分别配制质量浓度为0.25、0.5、0.75、1.00、1.25 mg/mL的乳酸及乙酸标准溶液,在上述色谱条件下测定,以峰面积为纵坐标、标准溶液质量浓度为横坐标绘制标准曲线,通过标准曲线计算样品中的乳酸及乙酸含量。
1.3.5 生物酶活性的测定
1.3.5.1 植酸酶活性
参照GB/T 18634—2009《饲用植酸酶活性的测定 分光光度法》并作修改。取5 g酸面团样品,加入20 mL 0.25 mol/L乙酸钠缓冲液(调节pH值与酸面团相同),磁力搅拌15 min,6 000 r/min离心5 min,保留上清液待测。取0.2 mL待测液与1.8 mL乙酸钠缓冲液混匀,37 ℃预热5 min,加入4 mL 7.5 mmol/L植酸钠溶液,37 ℃酶解30 min,加入4 mL终止及显色液(30%硝酸溶液、100 g/L钼酸铵溶液、2.35 g/L偏钒酸铵溶液按2∶1∶1体积比混合,现配现用),测定415 nm波长处吸光度,以磷酸二氢钾作为标准物绘制标准曲线。植酸酶活性定义为在37 ℃条件下,每分钟释放1 μmol无机磷为一个酶活力单位,以U表示。
1.3.5.2β-葡萄糖苷酶活性
参照杨文丹[4]的方法并作修改。将5 g酸面团样品与5 mL 0.1 mol/L乙酸钠缓冲液(调节pH值与酸面团相同)振荡提取30 min,10 000 r/min离心12 min,保留上清液待测。取0.4 mL待测液与3.6 mL乙酸钠缓冲液混合并于40 ℃预热5 min,加入0.2 mL 20 mmol/L对硝基苯基-β-D-吡喃葡萄糖苷溶液,40 ℃酶解10 min,加入1 mL 1 mol/L Na2CO3溶液终止反应,测定400 nm波长处吸光度,以对硝基苯酚作为标准物绘制标准曲线。β-葡萄糖苷酶活性定义为在40 ℃条件下,每分钟释放1 nmol/mL对硝基苯酚为一个酶活力单位,以U表示。
1.3.6 植酸含量的测定
参照罗昆等[12]的方法进行。
1.3.7 膳食纤维含量的测定
参照GB 5009.88—2014《食品中膳食纤维的测定》及Goñi等[13]的方法并作修改。取0.3 g酸面团样品,加入10 mL 0.08 mol/L HCl-KCl缓冲液(pH 1.5)与0.2 mL 0.3 mg/mL胃蛋白酶溶液,40 ℃水浴1 h。用1 mol/L NaOH溶液调节pH值至7.5并加入1 mL 5 mg/mL胰蛋白酶溶液,37 ℃水浴振荡6 h。加入10 mL 0.1 mol/L Tris-马来酸缓冲液(pH 6.9)与1 mL 120 mg/mLα-淀粉酶溶液,37 ℃水浴16 h,3 000×g离心15 min,将沉淀用5 mL去离子水洗涤2 次,然后于105 ℃干燥过夜,冷却称质量,即为不可溶性膳食纤维含量。同时,将离心得到的上清液与洗涤液混合,加入10 mL 0.2 mol/L乙酸钠缓冲液(pH 4.75)与0.1 mL 2 mg/mL淀粉葡萄糖苷酶溶液,60 ℃水浴振荡45 min,过滤得到滤液,并按滤液体积加入4 倍体积预热至60 ℃体积分数95%乙醇溶液,室温下沉淀1 h,抽滤,滤渣于105 ℃干燥过夜,冷却称质量,即为可溶性膳食纤维含量。总膳食纤维含量为不可溶性膳食纤维含量与可溶性膳食纤维含量之和。
1.3.8 面包面团的物性分析
1.3.8.1 热机械学性质
参照王凤等[14]的方法,采用Mixolab混合实验仪测定面团的热机械学性质。根据Chopin+协议,设置复配原料的水分含量,并按照达到最佳稠度时的扭矩为1.1 N·m的要求加入相应质量的原料粉及水。测定参数为:初始温度30 ℃,保温8 min,然后以4 ℃/min的速率升温至90 ℃,保温8 min后,再以4 ℃/min的速率降温至50 ℃,搅拌速率保持80 r/min。
1.3.8.2 拉伸特性
参照GB/T 14615—2019《粮油检验 小麦粉面团流变学特性测试 拉伸仪法》,采用拉伸仪测定面团的拉伸特性。取150 g搅拌完成的面团放入揉团器中揉圆,然后小心取出面团后再放入搓条辊中搓成条柱状,将其置于拉伸仪的醒发室中醒发1 h,取出面团,置于测力系统的托架上进行测试。
1.3.8.3 发酵流变特性
采用流变发酵仪进行测定。取250 g搅拌完成的面团放入可移动发酵篮,铺平后加上2 000 g砝码,然后置于预热至38 ℃的发酵流变仪中测试,测试时间为3 h。
1.3.9 LF-NMR测定面团中的水分分布
准确称取5 g面团样品,用聚四氟乙烯保鲜膜包裹后置于专用25 mm核磁管中,采用CPMG脉冲序列测定自旋-自旋弛豫时间(T2)。样品采集参数:接收机带宽100 kHz,回波个数10 000,180°间隔时间0.250 ms,重复时间2 000 ms,前置放大增益1,重复次数32。经LF-NMR分析软件反演得T2曲线,设置迭代次数为100 000。应用磁共振成像仪拍摄面团中质子密度的伪彩图像。
1.3.10 激光共聚焦显微观察面团微观结构
取5 mm×5 mm×5 mm大小的面团,用冷冻包埋剂将其固定于冷冻切片机专用托盘,-80 ℃冷冻1 h。将冻结后的样品切成10 mm薄片并置于载玻片上,用罗丹明B(1.3×10-5g/mL)染色1 min,去离子水洗涤后用激光共聚焦显微镜观察面团微观结构,放大倍数为200 倍。
1.3.11 面包的制作
按照表1所示面包配方,将小麦粉、黑豆粉、麦麸粉、即发干酵母倒入搅拌缸,加入预先与水混匀的糖、盐和酸面团,慢打3 min、快打1 min,将黄油裹入面团中慢打3 min,接着快打至面团可拉出透明薄膜,38 ℃、相对湿度85%下醒发2 h,上火170 ℃、下火220 ℃烘烤16 min,室温下冷却2 h后进行参数测定。小麦面包、黑豆麦麸面包、L-19酸面团面包、J-28酸面团面包依次记作WB、BBB、L-19SB、J-28SB。

表1 面包配方Table 1 Formulations of bread
1.3.12 面包的比容、质构及芯囊结构分析
比容:将烘焙出炉的面包于室温下冷却2 h,采用油菜籽替代法测定面包体积。面包比容按式(1)计算:

质构:将烘焙出炉的面包于室温下冷却2 h,用面包切片机将面包切成厚度10 mm的薄片,取位于面包最中间的两片进行叠放,然后使用质构仪进行测定。测定参数:探头型号P/36,测试前速率1.0 mm/s,测试速率3.0 mm/s,测试后速率3.0 mm/s,压缩形变量50%,感应力5 g,2 次压缩时间间隔1 s。
芯囊结构分析:使用扫描仪对面包芯囊的切面进行扫描,再应用Image J软件处理得到面包芯囊的二值化模式图及相关参数。气孔稠密度以单位面积中的气孔数表示;气孔表面积分数以气孔面积占切面总面积的百分比表示。
1.3.13 面包营养评价
1.3.13.1 游离氨基酸
取1 g面包芯囊的冻干样品,加入25 mL 5 g/100 mL三氯乙酸溶液超声(80 Hz)提取20 min,10 000 r/min离心30 min,上清液过0.22 μm滤膜。色谱柱:ODS Hypersil色谱柱(250 mm×4.6 mm,5 μm);流动相:V(醋酸钠)∶V(甲醇)∶V(乙腈)=1∶2∶2;流速0.8 mL/min;进样量20 μL;柱温40 ℃;紫外检测波长338 nm。
1.3.13.2 蛋白质含量
取1 g面包芯囊的冻干样品,加入10 mL去离子水,用1 mol/L NaOH溶液调节pH值至9.5并振荡提取40 min,8 000 r/min离心10 min,保留上清液。将沉淀重悬于5 mL去离子水并重复提取2 次,混合所有上清液。用1 mol/L HCl溶液调节上清液pH值至4.5,8 000 r/min离心10 min,收集沉淀并重悬于5 mL去离子水,调节pH值至7.0即为待测液。采用BCA蛋白测定试剂盒测定待测液中的蛋白质含量。
1.3.13.3 体外蛋白消化率
参照罗昆等[12]的方法并作修改。取1 g面包芯囊的冻干样品,加入15 mL 20 mg/mL胃蛋白酶溶液(0.5 mol/L HCl溶液调节pH值至1.5),37 ℃振荡1 h。用0.2 mol/L NaOH溶液将pH值调节至7.0,加入15 mL 5 mg/mL胰蛋白酶溶液,37 ℃振荡1 h。加入5 mL 10 g/100 mL三氯乙酸溶液,混匀静置1 h,10 000 r/min离心15 min保留上清液,采用BCA蛋白测定试剂盒测定上清液中的蛋白质含量,体外蛋白消化率按照式(2)计算:

1.3.13.4 膳食纤维含量
按照1.3.7节方法测定。
1.4 数据处理
采用Excel 2013与Origin 8.5软件进行数据处理及图表绘制,通过SPSS 16.0软件进行显著性和方差分析,显著性水平为P<0.05,差异显著。
2 结果与分析
2.1 酸面团发酵过程中菌株生长曲线
由图1可知,两株乳酸菌在短暂停滞后进入对数生长期,表明两株菌对黑豆麦麸基质均具有较强的适应性。L-19经10 h对数增长后趋于稳定,菌落数达10(lg(CFU/g))左右,而J-28在发酵6 h即进入稳定期,菌落总数维持在9.5(lg(CFU/g))左右。该结果说明J-28具有较强的竞争力,能够迅速成为酸面团体系中的优势菌群,但发酵后期的环境更有利于L-19生长。在本实验中,两株乳酸菌生长至24 h仍未出现衰亡现象,具有较长的生长稳定期,表明黑豆麦麸能够为其生长提供充分的营养物质。稳定期是微生物充分积累代谢产物的阶段,较长的稳定期有利于菌株作用于发酵基质[15]。
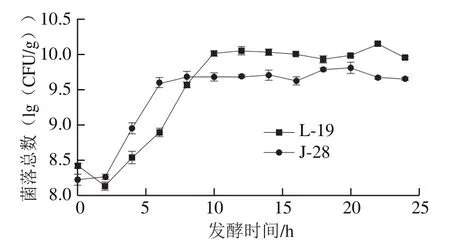
图1 酸面团发酵过程中菌株生长曲线Fig. 1 Growth curves of the strains during fermentation of sourdough
2.2 酸面团发酵过程中pH值、TTA及有机酸的变化
乳酸菌的酸化作用是酸面团配料发挥功能特性的基础,研究体系的酸化过程具有重要意义。由图2a可知,两种酸面团均在发酵前10 h内迅速酸化,随后pH值趋于平缓,在发酵18 h达到稳定。pH值的降低是乳酸菌释放多种有机酸的作用结果[16],但代谢物的积累也会通过反馈调节减缓酸化过程。在发酵终点,两种酸面团的pH值相近,但J-28酸面团的TTA含量显著高于L-19酸面团(P<0.05),这主要源于两株菌的有机酸代谢差异。图2b表明L-19在发酵过程中以合成乳酸为主,而J-28除了合成乳酸外还产生大量乙酸,相比乳酸,乙酸的缓冲范围更广,因此滴定时消耗更多的碱液[17]。有机酸的形成及pH值的变化会影响体系中的生物酶活性,与最终产品的品质密切相关[6]。Koistinen等[18]研究认为,酸化能力强的乳酸菌更适用于粗加工作物发酵。
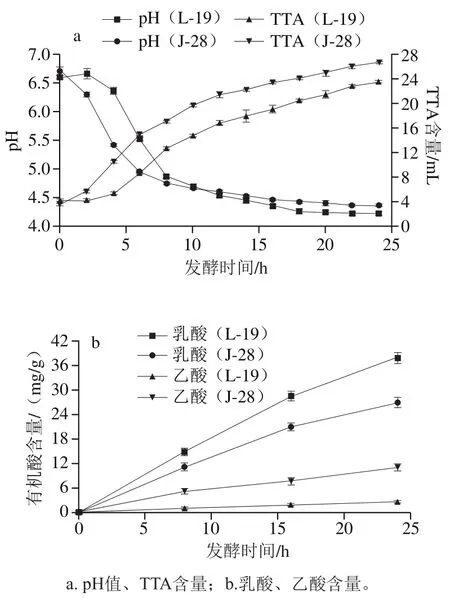
图2 酸面团发酵过程中pH值、TTA和有机酸含量的变化Fig. 2 Changes in pH, TTA and organic acid content of sourdough during fermentation
2.3 酸面团发酵过程中β-葡萄糖苷酶及植酸酶活性的变化
由图3可知,在发酵初期,L-19酸面团中的植酸酶活力逐渐增强,直至第12小时植酸酶活力出现跃变,并持续上升至发酵结束。酸面团体系中的植酸酶可分为两种,一种是天然存在于植物中的内源性植酸酶,另一种是菌株生长代谢过程中合成的微生物酶,Kozlowska等[19]发现外源性微生物植酸酶的活力显著高于植物性植酸酶。因此,发酵第12小时植酸酶活力的跃变可能主要源自L-19进入稳定期后大量分泌微生物植酸酶。J-28酸面团中的β-葡萄糖苷酶活力呈现先上升后下降的趋势,β-葡萄糖苷酶活力在发酵第8小时达到最高,随后迅速下降,最终恢复至发酵前的水平。β-葡萄糖苷酶的最适pH值在5.0~6.0之间[20],因此发酵后期过度酸化反而会抑制其活性,该结果与体系的pH值变化一致。
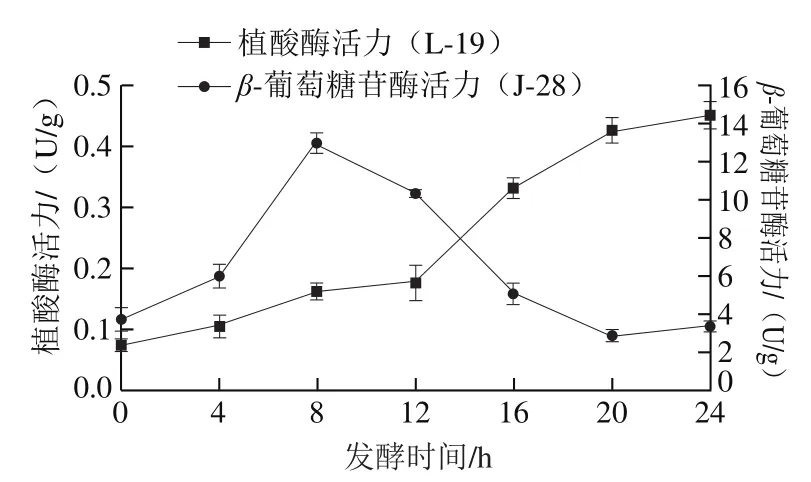
图3 酸面团发酵过程中β-葡萄糖苷酶及植酸酶活性的变化Fig. 3 Changes in β-glucosidase and phytase activity of sourdough during fermentation
2.4 酸面团发酵过程中植酸及膳食纤维含量的变化
基于两株乳酸菌的产酶特性,本实验着重分析酸面团发酵过程中植酸及膳食纤维含量的变化(表2)。经过24 h发酵后,L-19酸面团及J-28酸面团中的植酸含量分别较发酵前降低了81.08%、59.79%,表明乳酸菌能够有效降解植酸,其中L-19的作用更为显著,该结果与预期相符,这是由于L-19具有定向降解植酸的功能特性。在发酵过程中,不溶性膳食纤维逐渐转变为可溶性,两种酸面团中的可溶性膳食纤维质量分数由发酵前的1.66%分别提高至发酵24 h的2.03%、2.83%。乳酸菌发酵能够激活麦麸中的多种天然纤维酶,其中内切葡聚糖酶可将难溶性长链纤维分子降解为可溶性小分子[4],而β-葡萄糖苷酶的作用是进一步水解寡糖以消除次级产物对内切葡聚糖酶的抑制,是纤维素降解过程中重要的限速酶[4]。本实验中高产β-葡萄糖苷酶的J-28表现出更高的纤维降解率,这与成奕瑾等[21]的研究结果一致。

表2 酸面团发酵过程中植酸及膳食纤维含量Table 2 Changes in contents of phytic acid and dietary fiber of sourdough during fermentation
2.5 面包面团的热机械学性质、拉伸及发酵流变特性
由表3可知,与WB相比,添加黑豆及麦麸提高了面团吸水率,延长面团形成时间。这是因为黑豆蛋白及麦麸纤维都具有高吸水性的特点,两者对水分的竞争会干扰面筋网络的形成。相比WB,BBB的弱化度显著增大(P<0.05),表明黑豆及麦麸不利于面团稳定,而乳酸菌发酵能够在一定程度上缓解该现象。Park等[22]发现高负电性的植酸会干扰麦谷蛋白交联,实验中乳酸菌对植酸的高度降解有利于降低其干扰作用。此外,不溶性膳食纤维向可溶性膳食纤维的转化也有助于提高面团强度[7]。最大拉伸比反映面团弹性与延展性之间的平衡,L-19SB的最大拉伸比与WB最为接近,表明两者具有相似的黏弹特性。与BBB相比,经乳酸菌发酵后,面团中的CO2生成量显著上升,这是因为发酵过程中淀粉、蛋白质等营养成分水解为小分子,利于酵母代谢产气[6]。

表3 面包面团的热机械学性质、拉伸及发酵流变特性Table 3 Thermomechanical, tensile and fermentation rheological characteristics of bread doughs
2.6 面包面团中的水分分布
为进一步探究黑豆及麦麸对面筋水合的影响,采用LF-NMR及其成像技术分析面团中的水分分布。图4是典型的T2曲线,T21、T22和T23分别代表结合水、不易流动水及自由水[23]。相比WB,BBB的T22峰向右偏移,表明水分子流动性增强。这可能是因为黑豆及麦麸主要依靠外围亲水基团吸附水分子,而面筋蛋白能与水分子发生溶剂化作用,促使大量水分子进入胶体内部[24],对水分子的束缚力更强。经乳酸菌发酵后,质子峰偏移幅度变小,部分自由水向不易流动水转变,表明面团组分与水分子结合地更加紧密。核磁共振成像的质子信号能够直观地反映面筋的水合程度,信号强度高的红色区域越多,代表水分子的流动性越强[25],相应面筋的水合程度越低。由图5可知,WB中的水分分布均匀,水分流动性弱。相反,BBB的面筋水合不完全,存在大面积自由水,而黑豆及麦麸的发酵降解有利于面筋充分水合。
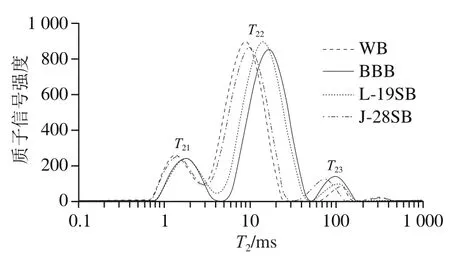
图4 面团的T2曲线Fig. 4 T2 time curves of doughs
图5 面团中的水分分布Fig. 5 Water distribution of doughs
2.7 面包面团的微观结构
由图6可知,WB中的面筋结构分支度高、分布均匀,整体呈现为致密、连续的网状结构。相比WB,BBB的面筋网络中存在较大的间隙,呈现松散、不规则的片状分布,表明黑豆及麦麸的添加会破坏面筋网络的完整性。豆类蛋白在搅打过程中会与醇溶蛋白及麦谷蛋白形成“醇溶蛋白-豆类蛋白-麦谷蛋白”复合体,而这种复合体会损害面筋的功能特性[24]。此外,麦麸颗粒不仅会直接刺破面筋薄膜,还会通过阿魏酸与面筋蛋白交联,从而阻碍面筋网络的形成[4]。Perez等[26]在添加大豆蛋白的面团中同样观察到片状聚合物,这些聚合物源于大豆蛋白与面筋蛋白间形成的交联,不利于形成完整的面筋网络。经乳酸菌发酵后,面筋的断裂结构基本消失,间隙区域明显减少,这可能是因为黑豆蛋白降解为小分子肽或氨基酸,因此与面筋蛋白的相互作用减弱,形成黑豆蛋白-面筋蛋白聚合物的概率降低。同时,大分子纤维的降解也有利于面筋网络的形成[4]。连续、完整的面筋网络赋予面团独特的黏弹特性,该结果与面团的物性分析一致。

图6 面包面团激光共聚焦微观结构图Fig. 6 Laser scanning confocal microscopy images of doughs
2.8 面包的比容、质构及芯囊结构分析
由表4可知,相比BBB,L-19SB与J-28SB的比容分别提高4.96%和9.22%,面包芯囊硬度分别降低12.61%和16.8%,表明酸面团面包更加蓬松、柔软。面包的比容取决于面团中CO2体积及面团自身的流变特性[27],乳酸菌发酵有利于CO2积累,提高面团延展性,确保面团在烘焙过程中充分膨胀。气孔稠密度及其面积分数反映面包芯囊组织的细腻性及蓬松性。相比WB,BBB的气孔稠密度及面积分数显著下降,宏观表现为粗糙、松散的组织结构,相反,酸面团面包中无规则大孔洞较少,气孔相对细腻均一,内部组织更为致密(图7)。该现象与面筋微观结构的观察结果相似。

表4 面包的比容、质构及芯囊结构Table 4 Specific volume, texture and crumb structure of breads

图7 面包芯囊的组织结构Fig. 7 Structure of bread crumbs
2.9 面包中的游离氨基酸含量
蛋白质的水解是酸面团发酵过程中最重要的技术特征,黑豆蛋白的水解对于游离氨基酸的释放具有重要意义。由图8可知,L-19SB及J-28SB中的总游离氨基酸含量分别为BBB的1.61 倍和1.22 倍,必需氨基酸的增幅更为显著,分别为2.84 倍和2.11 倍。该结果说明乳酸菌发酵不仅能够有效富集游离氨基酸,同时优化了面包中的氨基酸组成模式。在4 种面包中,WB的赖氨酸含量最低,仅为2.99 mg/g,添加黑豆及麦麸的面包其赖氨酸含量增加至8.39 mg/g。经发酵后,两种酸面团面包的赖氨酸含量分别达到14.17 mg/g和10.12 mg/g。赖氨酸是谷类作物的第1限制性氨基酸[28],实验表明黑豆麦麸酸面团的添加能够弥补普通小麦面包中赖氨酸不足的劣势。在本实验中,酪氨酸、丝氨酸及精氨酸的含量在发酵后出现不同程度的降低,这可能是菌株生长代谢过程中消耗所致。
图8 面包中的游离氨基酸含量Fig. 8 Contents of free amino acids in breads
2.10 面包的蛋白质、膳食纤维含量及体外蛋白消化率
由表5可知,L-19SB和J-28SB两种酸面团面包的总膳食纤维质量分数均高于6%,满足欧盟营养与健康法规中关于高膳食纤维食品的定义。在蛋白质方面,BBB的蛋白质质量分数高达14.24%,相比WB提高了22.54%。经乳酸菌发酵后,两种酸面团面包的蛋白质含量略有降低,但与发酵前无显著差异,表明发酵处理对蛋白损耗的影响较小。体外蛋白消化率是评价食品营养特性的关键指标,与蛋白质含量相结合能够更全面地表征蛋白质的营养价值[29]。相比BBB,两种酸面团面包的体外蛋白消化率显著提高,表明乳酸菌发酵能够降低植酸的抗营养作用。此外,发酵过程中蛋白质的部分水解使其对消化酶更加敏感[30],因此易于消化吸收。
表5 面包的蛋白质、膳食纤维含量及体外蛋白消化率Table 5 Protein and dietary fiber contents and in vitro protein digestibility of breads %
3 结 论
研究表明,利用功能性乳酸菌L-19及J-28作为发酵剂制作的黑豆麦麸酸面团有利于改善面包的营养及感官品质。在黑豆麦麸基质中,乳酸菌L-19及J-28生长良好,酸化能力强,两者表现出不同的产酶特性。经发酵后,黑豆麦麸中的植酸得到有效降解,难溶性膳食纤维向可溶性转变。黑豆及麦麸不利于面团的形成及稳定,并且破坏面团弹性与延展性之间的平衡,而乳酸菌发酵能够降低黑豆麦麸产生的不利影响,赋予面团良好的流变特性。LF-NMR分析及激光共聚焦观察的结果表明,黑豆蛋白及麦麸纤维改变面团中的水分分布,干扰面筋水合,导致面筋蛋白无法形成连续的网络结构。在感官方面,两种酸面团面包蓬松、柔软,芯囊组织细腻、均一。营养评价表明,黑豆麦麸面包具有高纤维、高蛋白特征,乳酸菌发酵能够进一步优化面包的氨基酸组成模式,提高体外蛋白消化率。
