特异性水解αs1-酪蛋白过敏原IgE作用表位aa 83~105的蛋白酶筛选
2022-02-16吕晓哲丛艳君张倩倩李邻峰高吉安邱学宇
刘 迪,吕晓哲,丛艳君,*,张倩倩,李邻峰,梁 萌,高吉安,邱学宇
(1.北京工商大学食品与健康学院,北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京 100048;2.北京友谊医院皮肤科,北京 100050)
食物过敏已经成为一个严重的健康问题,其发病率不断上升,影响了全球6%~13%的人口,其中约1/3由牛乳过敏引起[1-2]。我国最新流行病学调查表明,约有2.69%的婴幼儿对牛乳过敏[3]。在过去十年中,世界范围内牛乳过敏的发病率不断上升,其原因仍不清楚,推测与婴儿用牛奶配方粉喂养的比例增加有关[4]。在食品领域,解决这一问题最主要的方法是通过食品加工方式(如热处理、酶解、发酵等)破坏或修饰牛奶过敏原的结构,开发低致敏婴幼儿配方粉[5]。
牛乳αs1-酪蛋白引起过敏的本质原因是B细胞作用表位的存在。Chatchatee等[6]以牛乳过敏患者血清为探针,识别牛乳αs1-酪蛋白作用表位,发现有9 个IgE和6个IgG抗体结合表位,其中序列aa 69~78和aa 173~194为优势IgE结合表位。Spuergin等[7]用牛乳过敏患者混合血清识别αs1-酪蛋白IgE作用表位序列为aa 19~30、aa 93~98和aa 141~150。部分水解乳蛋白质水解物虽然已经被应用于婴儿配方奶粉的生产,但是由于蛋白酶水解过敏原作用表位缺乏特异性,使得乳蛋白质水解物依然具有致敏性[8-9],此外,乳蛋白质水解物会产生大量的苦味肽,因此筛选特异性水解过敏原作用表位的蛋白酶具有重要的现实意义。
本研究综合考虑国内外文献报道的αs1-酪蛋白作用表位序列及课题组前期研究结论,以SEEIVPNSVEQKHIQKEDVPSER为半抗原,偶联牛血清白蛋白(bovine serum albumin,BSA)制备完全抗原后,免疫BALB/c小鼠,制备单克隆抗体,建立间接竞争酶联免疫吸附测定方法(enzyme linked immunosorbent assay,ELISA),筛选有效水解过敏原作用表位的蛋白酶,同时制备αs1-酪蛋白单克隆抗体作为对照。以期为新型低致敏性婴儿配方奶粉的开发提供研究思路与参考依据。
1 材料与方法
1.1 材料与试剂
αs1-酪蛋白作用表位 杭州中肽生化有限公司;磷酸二氢钠、磷酸氢二钠 西陇化工股份有限公司;低分子质量标准蛋白 天根生化科技(北京)有限公司;羊抗鼠IgG 北京友谊中联公司;96 孔酶标板北京拜尔迪生物技术有限公司;聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜 美国Millipore公司;Tris、甘氨酸、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、考马斯亮蓝、吐温-20、30%过氧化氢、三氯乙酸、乙腈、乙醇、三氟乙酸、N-乙酰半胱氨酸国药集团化学试剂有限公司;丙烯酰胺、甲叉双丙烯酰胺、四甲基乙二胺、β-巯基乙醇、BSA、二甲基亚砜、氨基黑、4-氯-1-萘酚、甘油、胃蛋白酶、3,3’,5,5’-四甲基联苯胺、咖啡因、αs1-酪蛋白(纯度≥70%) 美国Sigma公司;L-酪氨酸、福林试剂、乳酸钠、邻苯二甲醛、L-亮氨酸 上海源叶生物技术公司;乳酸 北京百灵威科技公司;碱性蛋白酶、复合蛋白酶、中性蛋白酶、木瓜蛋白酶 丹麦诺维信公司;蛋白酶M 日本天野酶制剂公司。
1.2 仪器与设备
紫外分光光度计 日本Hitachi公司;SH-2磁力搅拌器 北京东方开物科学器材公司;BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;KHB ST-360酶标仪 上海科华实验系统有限公司;DYY-7C型电泳仪、电热恒温水浴锅 北京市六一仪器厂;PHS-3C型pH计 上海仪电科学仪器股份公司;SHZ-C水浴恒温振荡器 上海龙跃仪器设备有限公司;1260高效液相色谱(high performance liquid chromatography,HPLC)仪美国安捷伦公司。
1.3 方法
1.3.1 作用表位的合成、纯化、鉴定及完全抗原的制备与鉴定
采用Fmoc固相肽合成法,将C-末端氨基酸连接到Wang树脂上,采用常规Fmoc法进行逐步缩合。合成结束后,用强酸将序列从固相载体上切割下来,经HPLC纯化,质谱鉴定,冷冻干燥后备用[10]。
采用HPLC和质谱进行分析。色谱柱:C18柱(4.6 mm×150 mm,5 μm);流动相:A为0.1%三氟乙酸溶液;B为80%乙腈溶液,并添加体积分数为0.09%的三氟乙酸。采用体积分数梯度洗脱程序:0~20 min,85%~65% A、15%~45% B;流速1.0 mL/min;检测波长220 nm;柱温20 ℃。质谱条件[10]:采用电喷雾离子源;喷雾压力15 psi;干燥气温度350 ℃;流速5 L/min;扫描质量范围m/z500~2 200。
利用戊二醛法将纯化过的合成多肽与BSA偶联,得到完全抗原[11]。利用紫外光谱扫描法测定完全抗原的偶联比[11]。合成多肽、BSA及两者偶联后的完全抗原在紫外区均能产生明显吸收峰。将合成多肽、BSA和完全抗原用PBS配成一定浓度溶液后,分别在190~1 100 nm全波长下进行光谱扫描。通过比色法分别测定合成多肽(A)、BSA(B)和完全抗原(C)分别在A和B最大吸收峰波长(m、n)处的吸光度,即AAm、AAn、ABm、ABn、ACm、ACn。根据朗伯-比尔定律,按照公式A=kcl(A为吸光度;c为吸光物质浓度/(mol/L);l为样品的吸收光程即吸收层厚度/cm;k为摩尔吸收系数/(L/(mol·cm)))计算A物质与B物质分别在其吸收峰波长处的摩尔分子消光值,即kAm、kAn、kBm、kBn。按式(1)计算A物质和B物质的摩尔分子比(即合成多肽与BSA的偶联比):
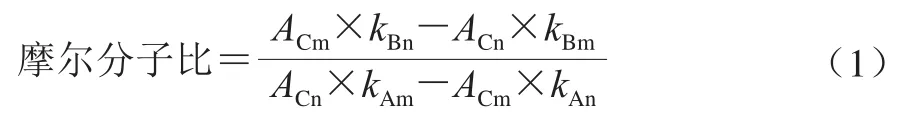
1.3.2 克隆抗体制备、亚型鉴定、效价测定及抗体特异性鉴定
委托外单位制备,总体步骤如下:SEEIVPNSVEQKHIQKEDVPSER偶联BSA制备完全抗原后,免疫BALB/c小鼠,4 次免疫后取小鼠脾细胞与NS-1骨髓瘤细胞相融合,筛选出阳性杂交瘤细胞并进行多次亚克隆,待细胞活性达到最佳状态时,将杂交瘤细胞注射到BALB/c小鼠的腹腔内,等到可以明显地观察到小鼠腹部隆起时,收集腹水。同时制备αs1-酪蛋白的单克隆抗体作为对照。最后得到完全抗原的单克隆抗体和αs1-酪蛋白单克隆抗体。
采用小鼠IgG1、IgG2、IgG2a、IgE ELISA试剂盒鉴定亚型,按照使用说明书操作。采用间接ELISA测定单克隆抗体的效价。通过方阵法测定,抗原包被质量浓度均为5 μg/mL,单克隆抗体依次按1∶5 000、1∶10 000、1∶20 000、1∶40 000、1∶80 000、1∶160 000、1∶320 000、1∶640 000倍数稀释。以未被免疫正常小鼠的腹水作为阴性对照。
采用免疫印迹法鉴定单克隆抗体的特异性[12]。首先进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)分离αs1-酪蛋白、脱脂牛乳、大豆分离蛋白,电转印成功后,进行免疫印迹实验。将分离胶上的蛋白转印到PVDF膜上,进而在膜上完成免疫印迹反应,一抗为完全抗原和αs1-酪蛋白两种蛋白对应的单克隆抗体,二抗为HRP-羊抗小鼠IgG,以4-氯-1-萘酚为底物显色液[13]。
1.3.3 间接竞争ELISA抑制曲线的建立以及方法精确性和重复性确定
按照间接竞争ELISA程序,在优化包被抗原和单克隆抗体最适工作浓度、酶标二抗最适工作浓度的基础上,建立间接竞争ELISA抑制曲线。将αs1-酪蛋白标准品按1 280、640、320、160、80、40、20、10、0 ng/mL梯度稀释,以αs1-酪蛋白质量浓度对数为横坐标,以竞争抑制率为纵坐标,绘制标准曲线。分别以作用表位单克隆抗体和αs1-酪蛋白单克隆抗体为一抗,其中竞争抑制率通过OD值计算,如式(2)所示:
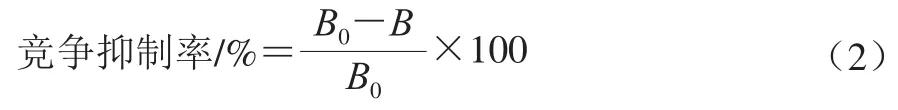
式中:B为各质量浓度αs1-酪蛋白竞争抑制时的OD值;B0为无αs1-酪蛋白竞争抑制时的OD值。
随机选择10 个孔进行零竞争抗原间接竞争ELISA检测,计算450 nm波长处吸光度的平均值(D0)和标准差(SD),按照式(3)计算检出限(limit of detection,LOD):
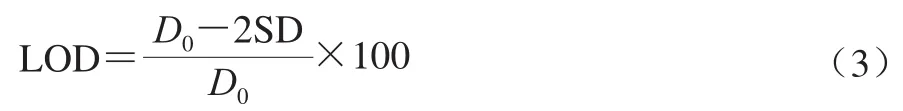
在标准曲线上得出对应抗原质量浓度为此方法的LOD[14]。以批内误差和批间误差评价该竞争抑制曲线建立方法的精确度和重复性。
1.3.4 水解液抗原残留量的测定
将αs1-酪蛋白不同酶解液冻干粉,加入抗原稀释液(pH 9.6的50 mmol/L碳酸盐溶液),稀释到抑制曲线线性范围,应用已经建立的间接竞争ELISA,测定水解液的抗原残留量。
1.3.5 水解液水解度、苦味值及分子质量分布的测定
利用邻苯二甲醛(1,2-phthalic dicarboxaldehyde,OPA)法测定酶解物的水解度[15],参考GB 5009.124-2016《食品中氨基酸的测定》。水解度计算如式(4)所示:
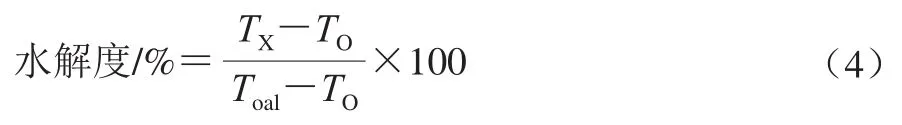
式中:TX为水解产物的游离氨基含量/(μmol/mL);TO为未水解样品的游离氨基含量/(μmol/mL);Toal为蛋白质样品中游离氨基的总量/(μmol/mL)。
苦味值测定采用感官评价法[16]。在评价本研究样品之前,使用参考溶液对小组成员进行口味强度校准:咖啡因配制成0、3、6、9、12、15 g/L的溶液,其苦味值分别定义为0、2、4、6、8、10。评定员用蒸馏水漱口后,取酶解液1.0 mL左右置于口中,5~10 s后吐出,蒸馏水漱口,间隔30 s后再品评下一个样品。以6 名品尝者(均为不吸烟者)按照上面的基准评分,最后得出平均值表示苦味程度。
水解物分子质量分布采用HPLC法。色谱条件:色谱柱TSKgel 2000 SWXL(300 mm×7.8 mm),流动相为乙腈-水-三氟乙酸(45∶55∶0.1,V/V),在220 nm波长下检测,流速0.5 mL/min,柱温30 ℃,进样量10.0 μL。以甘氨酸(相对分子质量75)、甘氨酸-甘氨酸-甘氨酸(相对分子质量189)、甘氨酸-甘氨酸-酪氨酸-精氨酸(相对分子质量451)、杆菌肽(相对分子质量1 432)、抑肽酶(相对分子质量6 512)、细胞色素(相对分子质量12 384)为标准品[17]。
1.4 数据分析
每组实验都设置空白对照,且均做3 次平行、3 次重复实验,采用微软Excel 2010软件进行图表制作,采用SPSS 17.0进行数据分析。
2 结果与分析
2.1 作用表位的纯化、鉴定以及完全抗原的鉴定
通过HPLC对合成后的作用表位SEEIVPNSVEQKHIQKEDVPSER(aa 83~105)进行纯化,纯度可达到92.664%,同时用质谱法测定多肽的相对分子质量,为2 781.1,如图1所示,验证合成多肽的准确性。

图1 合成作用表位的HPLC(A)和质谱(B)图Fig. 1 HPLC chromatogram (A) and mass spectrum (B) of synthetic epitope
将合成作用表位、BSA和完全抗原分别在190~1 100 nm全波长下进行光谱扫描,结果如图2所示,蛋白BSA在278 nm波长处有最大吸收峰;合成作用表位在196 nm波长处有最大吸收峰;完全抗原在190~1 100 nm波长处具有合成作用表位和BSA的特征吸收峰,并且有相应的光谱叠加情况。因此合成作用表位和BSA偶联成功。根据公式计算合成作用表位与BSA的摩尔分子比即偶联比为6.31。
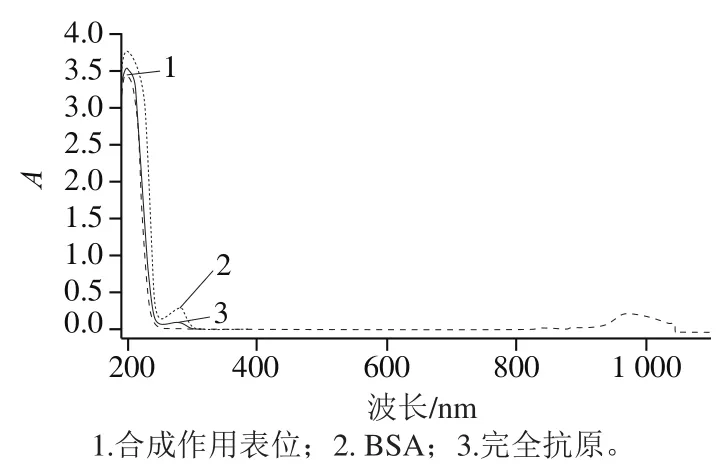
图2 合成作用表位、BSA和完全抗原的紫外扫描光谱图Fig. 2 UV absorption spectra of synthetic peptide, BSA and complete antigen
2.2 单克隆抗体的制备与鉴定
制备的抗体按照ELISA试剂盒说明书操作,鉴定其亚型为IgG1。用间接ELISA法测定作用表位单克隆抗体的效价,结果如表1所示。未被免疫的小鼠血清作为阴性对照,检测时以OD抗体/OD对照>2.1且OD抗体>0.2判定检测结果为阳性,OD抗体/OD对照<2.1或OD抗体<0.2判定检测结果为阴性。在抗体稀释倍数大于等于320 000时,OD抗体/OD对照大于2.1,但当稀释倍数为640 000时,抗体的OD值小于0.2,因此由作用表位制备的单克隆抗体效价可达到1∶320 000,同时测定αs1-酪蛋白抗体效价为1∶320 000。
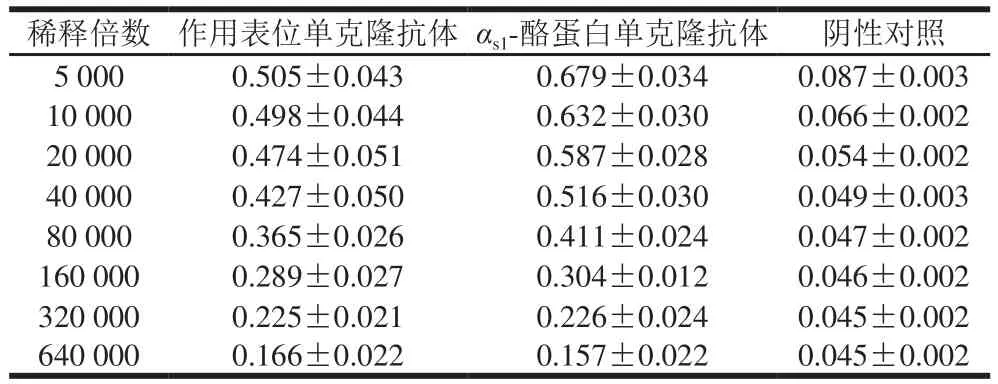
表1 作用表位、αs1-酪蛋白单克隆抗体效价的OD值Table 1 OD values of monoclonal antibody titers of αs1-casein and epitopes
αs1-酪蛋白、脱脂牛乳、大豆分离蛋白的SDS-PAGE如图3所示。泳道3为脱脂牛乳,条带从上至下分别为乳铁传递蛋白、血清白蛋白、免疫球蛋白、α-酪蛋白、β-酪蛋白、κ-酪蛋白、β-乳球蛋白和α-乳白蛋白。泳道4为大豆蛋白,条带从上至下分别为α’亚基、α亚基、β亚基、A3、11S酸性链、38 kDa、11S碱性链、14.4 kDa蛋白。

图3 SDS-PAGE图谱Fig. 3 SDS-PAGE profile
通过电转印将凝胶上的蛋白条带转印到PVDF膜上,然后用氨基黑染色观察到清晰的图谱,保证蛋白完全转印到膜上。进而对作用表位和αs1-酪蛋白的单克隆抗体特异性进行鉴定,结果见图4,作用表位和αs1-酪蛋白的单克隆抗体与αs1-酪蛋白、脱脂牛乳中的αs1-酪蛋白均发生了特异性免疫反应,而与大豆分离蛋白没有发生反应。同时,为了排除假阳性反应,用小鼠阴性血清进行免疫印迹抑制实验,阴性小鼠血清与αs1-酪蛋白、脱脂牛乳、大豆分离蛋白均不发生反应。
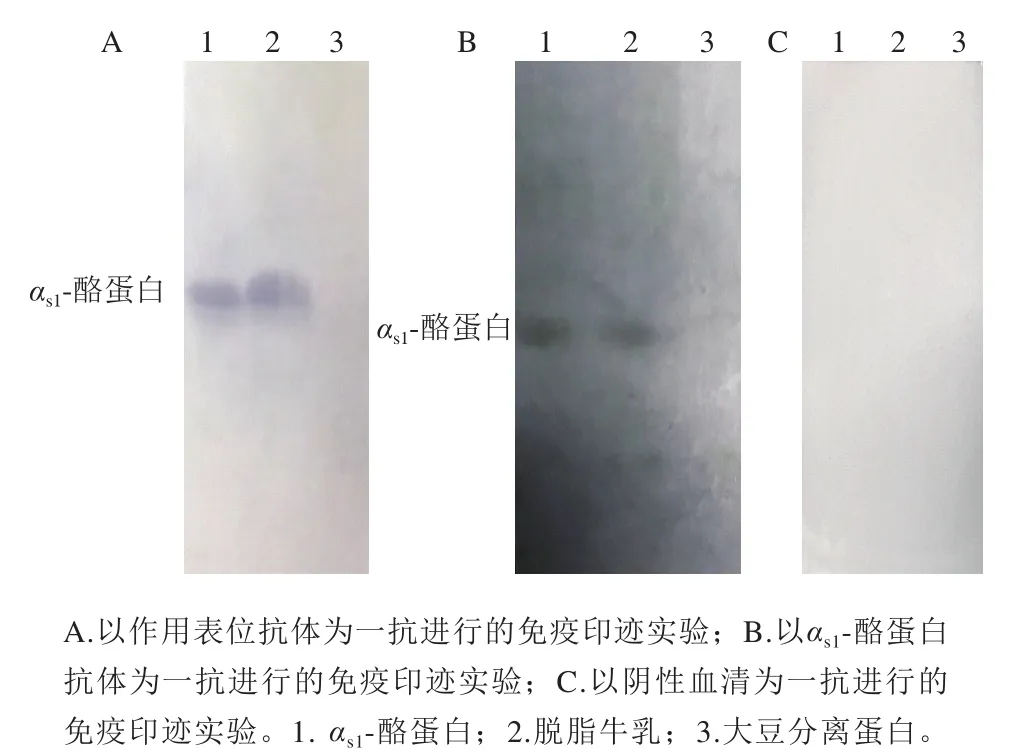
图4 作用表位单克隆抗体、αs1-酪蛋白单克隆抗体和阴性血清的免疫印迹图Fig. 4 Immunoblotting of monoclonal antibody against epitope or αs1-casein and negative sera
2.3 间接竞争ELISA的建立
当一抗为作用表位的单克隆抗体,抗原质量浓度为0~640 ng/mL时,建立标准曲线呈现较好的线性关系,如图5A所示,线性回归方程为y=-9.22x+100.78(R2=0.989 1),LOD为10.49 ng/mL。当一抗为αs1-酪蛋白的单克隆抗体时,抗原质量浓度为40~1 280 ng/mL时,建立标准曲线呈现较好的线性关系,如图5B所示,线性回归方程为y=-23.44x+135.77(R2=0.969 7),LOD为60.50 ng/mL。
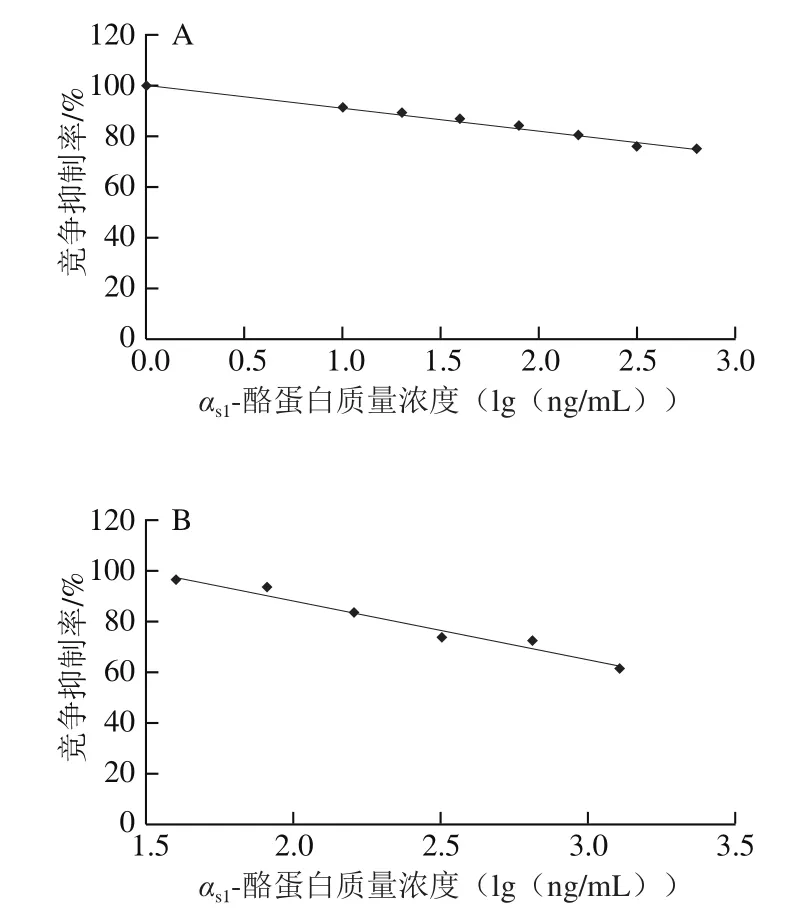
图5 作用表位单克隆抗体(A)和αs1-酪蛋白单克隆抗体(B)的间接竞争ELISA抑制曲线Fig. 5 Indirect competitive ELISA inhibition curves of monoclonal antibody against epitope (A) and αs1-casein (B)
以作用表位单克隆抗体作为一抗时,将αs1-酪蛋白设计5个质量浓度梯度,每个质量浓度3 次平行,3 次重复,ELISA在所用试剂、反应条件和检测设备完全相同的条件下进行,计算标准差,以其孔间变异系数表示批内误差,变异系数在1.159%~4.406%范围内,说明方法精确性良好。在不同时间用不同酶标板重复3 次。计算出标准差和变异系数,以其批间变异系数表示批间误差。变异系数在0.826%~4.362%范围内,说明方法重复性良好。
以αs1-酪蛋白的单克隆抗体作为一抗时,孔间变异系数在0.828%~5.191%范围内,批间变异系数在0.099%~4.849%范围内,说明方法精确性重复性均较好。
2.4 不同特性蛋白酶特异性水解αs1-酪蛋白过敏原作用表位分析
将未水解αs1-酪蛋白溶液稀释到间接竞争ELISA抑制曲线的检出范围内。按照间接竞争ELISA法程序,应用作用表位单克隆抗体和αs1-酪蛋白单克隆抗体作为一抗,检测抗原含量如表2所示。

表2 未水解αs1-酪蛋白溶液的抗原残留量Table 2 Antigen contents of αs1-casein solution not hydrolyzed by protease
如图6所示,6 种酶解液中抗原残留量随酶添加量的增加而减少。作用表位单克隆抗体和αs1-酪蛋白单克隆抗体所测的各酶解液中抗原残留量的减少效果排序不同。当作用表位单克隆抗体为一抗,6 种蛋白酶解液在相同的蛋白酶添加量时,抗原残留量从大到小为蛋白酶M>中性蛋白酶>复合蛋白酶>胃蛋白酶>碱性蛋白酶>木瓜蛋白酶。当αs1-酪蛋白单克隆抗体为一抗时,当加酶量在2 000~3 500 U/g时,6 种蛋白酶解液抗原残留量从大到小为胃蛋白酶>碱性蛋白酶>蛋白酶M>复合蛋白酶>中性蛋白酶>木瓜蛋白酶。

图6 作用表位单克隆抗体(A)和αs1-酪蛋白单克隆抗体(B)测定的水解液抗原残留量Fig. 6 Antigen residues of hydrolysates measured using monoclonal antibody against epitope (A) and αs1-casein (B)
用感官评价法对各蛋白酶水解液的苦味值进行测定,结果如图7所示。酸性蛋白酶中的胃蛋白酶解液苦味值最高,可到达10.0。碱性蛋白酶苦味值较高,可达8.5。在中性蛋白酶中,复合蛋白酶、中性蛋白酶水解液的苦味值较高,均在7.0~8.0。而木瓜蛋白酶解液的苦味值在其中较低,为4.0~5.0,苦味值最低的是蛋白酶M水解物,在1.0~2.0。
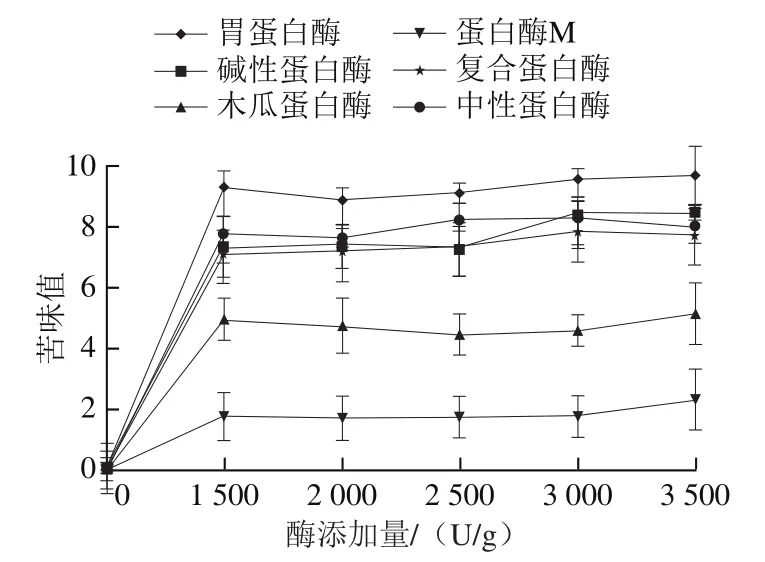
图7 不同种类蛋白酶水解αs1-酪蛋白的苦味值Fig. 7 Bitterness values of αs1-casein hydrolyzed by different proteases
用HPLC法对蛋白酶水解液的分子质量分布情况进行检测,结果如图8所示。本研究代表性附上了木瓜蛋白酶水解物的分子质量分布情况。以标准品相对分子质量的对数(lgMr)对保留时间(t)作图得到相对分子质量校正曲线方程:lgMr=-0.252 8t+7.098 4。根据标准品分子质量在校正曲线上对应的时间划分各酶解液中不同分子质量的分布情况。共划分7 部分,每部分所占比例为标准品对应时间(t)之间的峰面积与总峰面积比例。
木瓜蛋白酶水解物中<75 Da的组分所占比例随酶添加量的增大而增大,在11.1%~12.7%之间。75~189 Da组分随酶添加量变化不明显,在1.4%~1.7%。189~451 Da组分所占比例随酶添加量的增大显著增大(P<0.05),在37.8%~48.7%之间,并且是整个酶解物中占比最大的一部分。然而木瓜蛋白酶水解物中451~1 432 Da组分所占比例随酶添加量的增大而减小,变化范围在33.1%~37.4%之间。1 432~6 512 Da组分所占比例随酶添加量的增大显著减小(P<0.05),在3.8%~10.1%之间。6 512~12 384 Da组分在酶解物液中所占比例很小,并随加酶量增大而减小,占比范围在0.21%~1.4%之间。最后,>12 384 Da组分在酶解液中占比非常小,在0.04%~0.23%。总之,随加酶量的增多,木瓜蛋白酶水解液中分子质量<451 Da组分所占的比例随之增大,分子质量>451 Da的组分占比随之减小。
同时,利用OPA法测定各蛋白酶水解物的水解度,结果如图9所示。一般认为,轻度水解蛋白的水解度为10%以下,深度水解蛋白的水解度为20%以上。酸性蛋白酶中胃蛋白酶的水解度最低,属于轻度水解。碱性蛋白酶水解度较低,在加酶量低于3 500 U/g时,均为轻度水解。木瓜蛋白酶在1 500~3 500 U/g时,水解度在10%~15%之间,蛋白酶M为深度水解,中性蛋白酶在1 500~3 500 U/g水解度比较稳定,在10%左右。复合蛋白酶水解度随添加量增加呈上升趋势,在3 500 U/g时,水解度为13%。
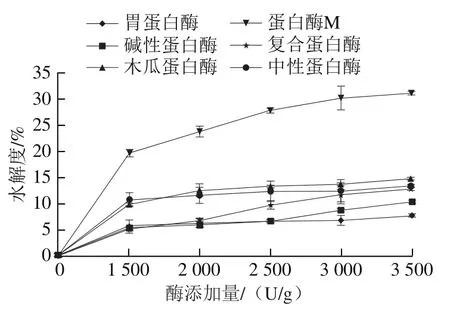
图9 不同种类蛋白酶水解αs1-酪蛋白的水解度Fig. 9 Degrees of hydrolysis of αs1-casein hydrolyzed by different proteases
3 讨 论
本课题组前期随机合成αs1-酪蛋白重叠15肽,用牛乳过敏患者血清识别αs1-酪蛋白IgE作用表位为aa 6~20、aa 11~25、aa 21~35、aa 26~40、aa 91~105、aa 126~140、aa 141~155、aa 171~185、aa 186~200[13,18]。围绕这些致敏区域,同时考虑偶联载体后序列尽可能的暴露,确定aa 83~105(SEEIVPNSVEQKHIQKEDVPSER)序列为本研究的目标作用表位,应用DNAStar软件的Protean 程序预测序列的亲水性均大于0,表示这个序列有比较高的亲水性能;同时序列中的表面可及性绝大部分大于1,表示易发生折叠同时暴露在外面;抗原指数均大于0,则表示这个序列形成表位的可能性很高[19],验证了其可行性。
BSA、匙孔血蓝蛋白是常用的制备完全抗原的偶联载体,其中,BSA因其理化性质稳定、价廉易得、无致敏性,在不同pH值和离子强度以及在含某些有机溶剂的情况下仍保持较大的溶解度[20],因此作为本研究的偶联载体。
本研究用αs1-酪蛋白作用表位的完全抗原免疫BALB/c小鼠,成功制备出单克隆抗体,同时制备αs1-酪蛋白全蛋白单克隆抗体作为对照,利用αs1-酪蛋白抗原表位制备的单克隆抗体效价高、特异性强、与大豆蛋白不发生交叉反应。利用此抗体建立的间接竞争ELISA优势明显,LOD为10.49 ng/mL,且其检测方法精确性、重复性较好,能够有效用于检测牛乳过敏原,具有推广应用价值。
酶解法是采用特定蛋白酶在最适温度和pH值下对蛋白质进行的酶解反应,反应条件温和,对氨基酸破坏少,而且随着制酶工艺不断成熟,蛋白酶种类逐渐丰富,成本降低,故酶解法是最常用的降低致敏蛋白的方法[21]。Ahmad等[22]用胰蛋白酶、α-胰凝乳蛋白酶及不同pH值(pH 2.2和pH 5.5)下的胃蛋白酶对水牛αs1-酪蛋白进行水解,间接ELISA检测到这几种酶分别将抗原性降低85%、63%、60%和38%。但是如果蛋白酶水解过敏原未能完全破坏作用表位,则蛋白质水解物依然具有致敏性,部分水解配方粉或深度水解配方粉已经市场销售,但是由于含有过敏原残留物,仍可引起过敏反应[23-24]。同时水解乳蛋白配方粉也具有较多的优势,在相同浓度以及相同氨基酸组成的条件下,人体对肽的吸收,尤其是小肽(二肽、三肽)速度比游离氨基酸快[25]。水解乳蛋白婴儿配方粉由于蛋白质来源、水解程度、蛋白酶种类、辅助加工技术(如非热加工)和肽谱不同而有差异,筛选特异性水解过敏原作用表位的蛋白酶是关键[16]。
从6 种蛋白酶的水解位点分析,胃蛋白酶水解位点为芳香族氨基酸(酪氨酸、苯丙氨酸)羧基端和氨基端,亮氨酸、精氨酸羧基端;木瓜蛋白酶水解位点为赖氨酸、精氨酸、苯丙氨酸羧基端;碱性蛋白酶-地衣芽孢杆菌水解位点为丝氨酸、甘氨酸、芳香族氨基酸(酪氨酸、苯丙氨酸、色氨酸)的肽键;中性蛋白酶-枯草芽孢杆菌涉及疏水氨基酸(色氨酸、苯丙氨酸、缬氨酸、亮氨酸、异亮氨酸、丙氨酸和蛋氨酸)的肽键;复合蛋白酶-枯草芽孢杆菌为广泛特异性;蛋白酶M水解天冬氨酸和谷氨酰胺肽键[26-28]。αs1-酪蛋白作用表位氨基酸序列为丝氨酸-谷氨酸-谷氨酸-异亮氨酸-缬氨酸-脯氨酸-天冬酰胺-丝氨酸-缬氨酸-谷氨酸-谷氨酰胺-赖氨酸-组氨酸-异亮氨酸-谷氨酰胺-赖氨酸-谷氨酸-天冬氨酸-缬氨酸-脯氨酸-丝氨酸-谷氨酸-精氨酸,可见,除胃蛋白酶,其他5 种蛋白酶都有可能特异性水解作用表位,但是从抗原残留量数据来看,以作用表位单克隆抗体为一抗时,木瓜蛋白酶和碱性蛋白酶水解液中抗原残留量较小,说明蛋白酶水解位点不是有效判断蛋白酶特异性水解作用表位的依据,这可能与复杂的蛋白酶水解体系有关系。并且各种蛋白酶水解液中抗原残留量的规律还需要进一步通过动物实验来验证。本研究探索了筛选特异性水解αs1-酪蛋白过敏原单一作用表位的方法,实际上,αs1-酪蛋白有多条B细胞作用表位,需要进一步分析水解其他作用表位的有效蛋白酶,再综合考虑制定彻底特异性水解αs1-酪蛋白过敏原作用表位的方法。
蛋白酶水解乳蛋白过敏原降低致敏性的同时,也产生了苦味肽,如何有效脱苦是课题组下一步的研究内容。研究表明,乳酸菌发酵过程中的水解作用不仅降低了乳蛋白的抗原性,并且水解物口感良好,富集有较多生物活性物质[29-30]。鼠李糖乳杆菌GG添加到适度水解配方粉中时有明显的益处,降低了特应性皮炎的严重程度,减少了肠道炎症,更快地诱导了患有牛乳蛋白过敏婴儿的耐受性,并改善了过敏性结肠炎的恢复[31-32]。因此建议将乳酸菌或益生菌应用于配方粉生产,辅助脱敏的同时提高产品适口性。
4 结 论
通过固相合成法合成αs1-酪蛋白致敏作用表位SEEIVPNSVEQKHIQKEDVPSER,再以作用表位的完全抗原免疫BALB/c小鼠,成功制备单克隆抗体,在优化条件的基础上,绘制竞争抑制曲线,建立间接竞争ELISA,该方法优势明显,LOD为10.49 ng/mL,且其检测方法精确性、重复性较好,能够有效用于检测牛乳过敏原。初步筛选到木瓜蛋白酶和碱性蛋白酶可有效水解αs1-酪蛋白致敏作用表位。本研究结果可为生产新型低致敏婴儿配方奶粉提供技术支持和新思路。
