β-酪蛋白的功能特性及其在婴儿配方乳粉中的应用研究进展
2020-04-21陈文亮苏米亚贾宏信齐晓彦
陈文亮,苏米亚,贾宏信,齐晓彦
(光明乳业股份有限公司,乳业生物技术国家重点实验室,上海 200436)
β-酪蛋白广泛存在于哺乳动物(牛、山羊、牦牛、马、兔等)和人的乳汁(母乳)中,在牛乳中占总蛋白质的24%~28%(约占总酪蛋白的45%),在母乳中占总蛋白质的15%~30%(占总酪蛋白的50%~85%),100 mL成熟母乳中大约含有0.4 mgβ-酪蛋白[1-2],因此β-酪蛋白是母乳的主要蛋白质成分。近年来许多研究发现,母乳中含有多种来源于β-酪蛋白的天然乳源生物活性肽,对新生儿具有免疫调节、抗氧化和饱腹等多种不同生理功能。由于母乳与牛乳中的β-酪蛋白构成存在差异,并且β-酪蛋白具有多种亚型,各亚型具有不同的生理功能,因此牛乳β-酪蛋白并不能简单替代母乳β-酪蛋白。母乳是婴儿配方乳粉的黄金标准,在模拟母乳β-酪蛋白构成的基础上,进一步在活性肽水平上模拟母乳组成,使婴幼儿配方乳粉中的生物活性肽水平接近母乳,能够进一步满足婴儿对蛋白质类营养的需求。本文论述β-酪蛋白的结构特点、性质、各功能特性及其在婴幼儿配方乳粉中的应用研究进展,为婴儿配方乳粉产品开发提供参考。
1β-酪蛋白的结构及性质
1.1 β-酪蛋白的氨基酸组成
β-酪蛋白分子由一定数量的氨基酸残基组成。在分子水平上,牛乳β-酪蛋白与人乳β-酪蛋白存在明显差异。牛乳β-酪蛋白是完全磷酸化的分子,含有209 个氨基酸残基,磷酸化前的一级结构分子质量为23.6 kDa,而5 个Ser残基(Ser15、Ser17、Ser18、Ser19和Ser35,前4 个Ser残基形成磷酸化中心)磷酸化后的分子质量为24.0 kDa,非磷酸化β-酪蛋白的等电点为5.1,由于磷酸化,其等电点会降至4.7以下[3]。
β-酪蛋白在所有酪蛋白中疏水性最强,这是由于它含有不带电荷且具有强疏水性的C端以及携带负电荷磷酸化丝氨酸簇的N端。β-酪蛋白在乳液中形成胶粒状物质,并能与磷离子、钙离子形成稳定的微胶粒结构,因此可以提高乳中的钙、磷含量。β-酪蛋白具有较强的双亲性,其N端残基1~40带有β-酪蛋白分子的全部净电荷,疏水性低,仅含有2 个脯氨酸残基,中间段,即残基41~135,所带电荷少,疏水性中等,而C端残基136~209含有许多非极性残基,所带电荷少,疏水性高[2]。牛乳β-酪蛋白(A2型)的带电荷氨基酸残基分布如图1所示,氨基酸组成如图2所示。
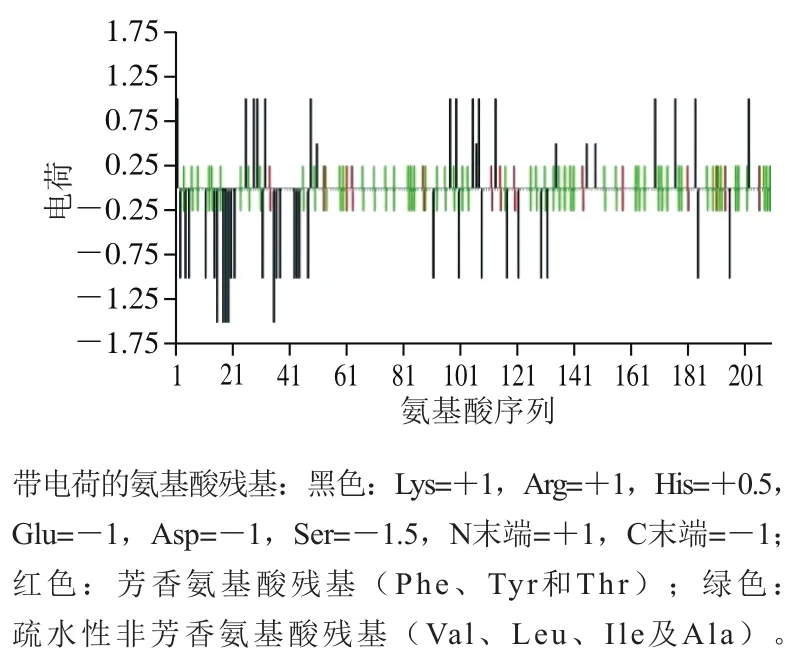
图1 牛乳β-酪蛋白(A2型)带电荷氨基酸残基分布[2]Fig. 1 Distribution of charged amino acid residues in cow milk β-casein (type A2)[2]

图2 牛乳β-酪蛋白(A2型)氨基酸组成[2]Fig. 2 Amino acid sequence of cow milk β-casein (type A2)[2]
与牛乳β-酪蛋白分子不同,人乳β-酪蛋白含有226 个氨基酸残基,分子质量为25.38 kDa[4]。人乳β-酪蛋白是具有多种磷酸化形式的分子,每个不同磷酸化形式的β-酪蛋白分子所含的有机磷酸基团最少为0 个,最多为5 个,其中双磷酸化β-酪蛋白约占人乳β-酪蛋白总量的30%,是主要成分之一,因此,双磷酸化β-酪蛋白的性质和缔合方式是人乳β-酪蛋白胶束结构和功能的重要决定因素[5]。人乳β-酪蛋白的氨基酸组成如图3所示。

图3 人乳β-酪蛋白的氨基酸组成[6]Fig. 3 Amino acid sequence of human milk β-casein[6]
由于蛋白质空间结构及氨基酸组成差异,酪蛋白存在多种变体,β-酪蛋白是其中重要的一种,而β-酪蛋白本身也具有多种亚型结构[7]。根据β-酪蛋白分子结构中相应位置上氨基酸的变化,可以确定每种β-酪蛋白的亚型;目前已发现牛乳β-酪蛋白分子具有13 种亚型结构,包括A1、A2、A3、A4、B、C、D、E、F、G、H1、H2及I型,其中最为常见的亚型结构是A1型和A2型(二者为一对共显性等位基因),其次为B型,其他类型则较少见;以A2型作为初始型或原始型,可以比较其他类型与A2型的差异:A1型是A2型氨基酸链67位由Pro变为His;A3型是106位由His变为Gln;B型是67位由Pro变为His,122位由Ser变为Arg;C型是37位由Glu变为Lys,67位由Pro变为His;D型是18位由Ser变为Lys;E型是36位由Glu变为Lys;F型是67位由Pro变为His,152位由Pro变为Leu;G型是67位由Pro变为His,137或138位由Pro变为Leu;H1型是25位由Arg变为Cys,88位由Leu变为Ile;H2型是72位由Gln变为Glu,93位由Met变为Leu,114位与169位间的Gln变为Glu;I型是93位由Met变为Leu[8]。牛乳β-酪蛋白亚型结构通常是A1或A2型,2 种β-酪蛋白的结构示意图及酶解位点如图4所示[9]。A1型和A2型牛乳β-酪蛋白酶解时会产生具有不同生理功能的肽段,它们对人类健康的作用还存在争议[10]。人乳β-酪蛋白的亚型结构较少,目前仅发现存在A1、A2和B型[11]。
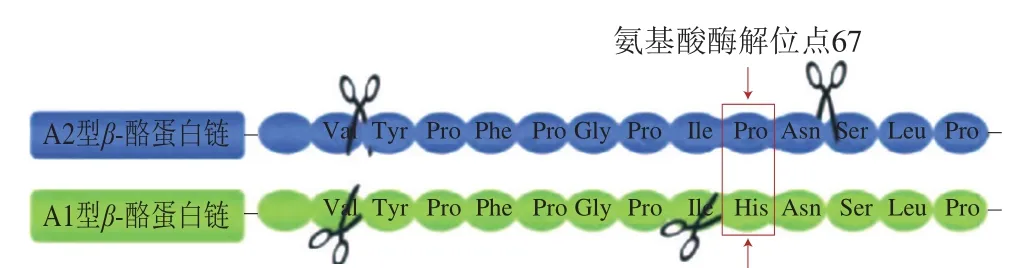
图4 A1、A2型牛乳β-酪蛋白结构示意图及酶解位点[9]Fig. 4 Protein chains of cow milk β-casein variants type A1, A2 and their enzymatic cleavage sites[9]
1.2 β-酪蛋白的空间结构
β-酪蛋白的空间结构对其生物活性非常重要。β-酪蛋白的空间结构主要包含4 种类型,即α-螺旋、β-折叠、β-转角和无规则卷曲。目前已有较多关于牛乳β-酪蛋白空间结构的研究成果。β-酪蛋白可能是一种“预熔融球状”蛋白,在乳汁中以胶束形式存在,具有一定的自我缔合能力,且在自缔合前可以进行折叠[12]。β-酪蛋白具有分子伴侣样特性,它不仅参与酪蛋白胶束的形成,而且自身也能形成寡聚胶束[13-14]。β-酪蛋白胶束及二级结构受温度和溶剂的影响[15-16],在低温(<10~15 ℃)条件下,β-酪蛋白单体占主导地位,但随着温度的升高,β-酪蛋白单体通过疏水键结合形成β-酪蛋白胶束[17]。β-酪蛋白不同亚型之间所形成的胶束形式也有差异,例如,A2型β-酪蛋白形成的胶束比A1型小,二者胶束结构的差异导致A2型β-酪蛋白的分子伴侣活性比A1型高[18]。β-酪蛋白单体和聚合物模型示意图如图5所示。从基于氨基酸组成序列的二级结构预测中可以得到β-酪蛋白的三维分子模型(图6)[19],在向外延伸的C末端区域β-酪蛋白可以自由地与其他β-酪蛋白相互作用。
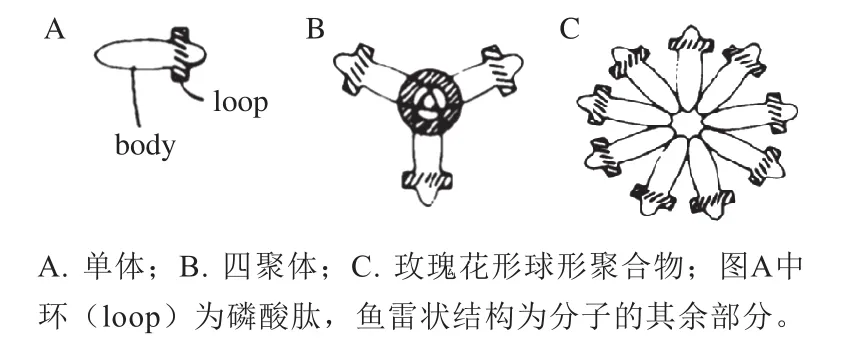
图5β-酪蛋白单体和聚合物模型示意图(平面图)[18]Fig. 5 Schematic of β-casein monomer and polymer model[18]
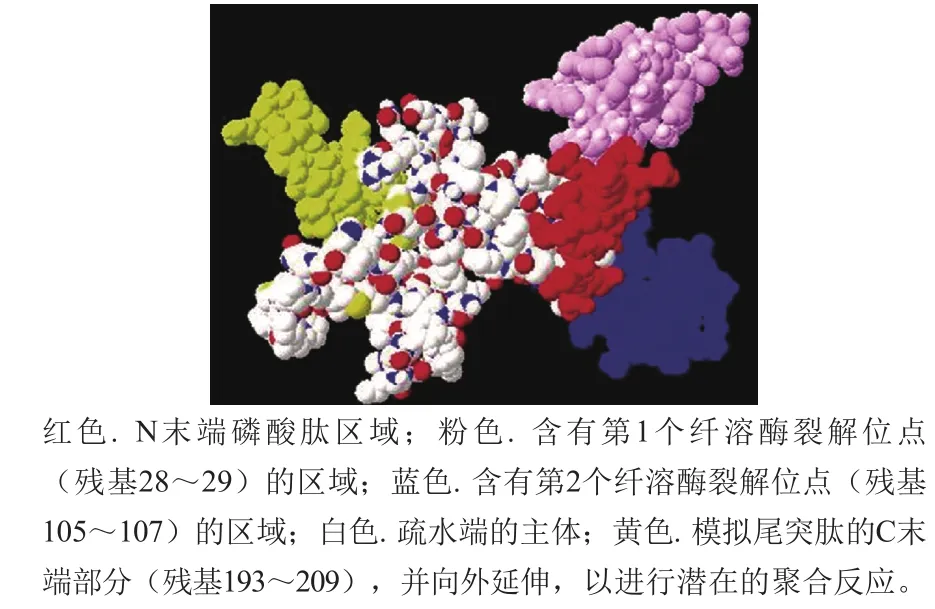
图6β-酪蛋白的分子模型三维示意图[19]Fig. 6 Three-dimensional schematic of molecular model of β-casein[19]
人乳β-酪蛋白的空间结构与牛乳β-酪蛋白存在明显差异[20]。在溶液中,人乳β-酪蛋白与牛乳β-酪蛋白的分子内外表面巯基分布、二级结构相对含量均存在较大差异。
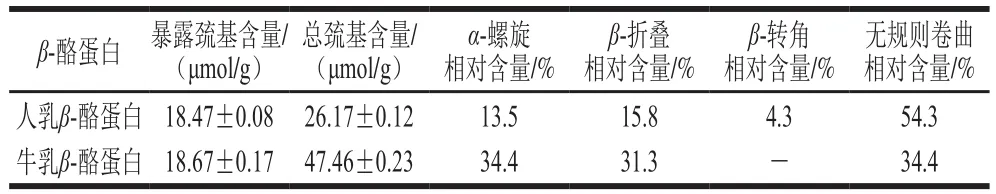
表1 人乳β-酪蛋白与牛乳β-酪蛋白的巯基含量及二级结构相对含量比较[21]Table 1 Comparison of sulfhydryl content and secondary structure composition between human and bovine milk β-casein[21]
由表1可知,人乳β-酪蛋白与牛乳β-酪蛋白分子结构的差异主要在于巯基的暴露程度以及α-螺旋、β-折叠和无规则卷曲等二级结构占比的差异,这些差异决定了二者结构及性质的不同,人乳β-酪蛋白表现为表面疏水性更强、空间构象更松散,而牛乳β-酪蛋白则表现为表面疏水性较弱、空间构象更紧密。
2β-酪蛋白的功能特性
2.1 溶解及乳化特性
β-酪蛋白的溶解性受温度及溶液pH值影响较大。随着pH值的变化,β-酪蛋白的溶解度呈现U形变化,当pH值为2或8~10时,β-酪蛋白溶解度最高(达到80%左右),而当pH值接近等电点(pI 4~5)时,β-酪蛋白溶解度最低(只有10%左右);牛乳β-酪蛋白与人乳β-酪蛋白的溶解度略有不同,但随温度及溶液pH值的总体变化趋势一致[22]。
β-酪蛋白的乳化特性与其溶解度有关,当β-酪蛋白溶解度较低时(如溶液pH 4~5),其乳化性较差,当β-酪蛋白溶解度较高时(如溶液pH值为2或8~10),其乳化性大幅增强[21]。β-酪蛋白的乳化特性还与其聚合度有关。利用转谷氨酰胺酶对β-酪蛋白进行催化聚合,可以得到β-酪蛋白的二聚体、三聚体、四聚体和多聚体,对这些交联β-酪蛋白聚合物的乳化性能测试表明,虽然聚合后的β-酪蛋白乳化活性降低,但乳液稳定性随着聚合度的增加而提高[23]。
有研究发现,通过化学修饰(如糖基化)可以改善β-酪蛋白的乳化特性。在对β-酪蛋白进行糖基化时发现,多达6 个葡萄糖分子与1 个β-酪蛋白分子结合;糖基化后的β-酪蛋白比完整的β-酪蛋白产生更小的乳状液滴,且形成乳液的稳定性提高;对β-酪蛋白糖基化前后的二级结构进行分析发现,糖基化后β-酪蛋白的螺旋度降低,葡萄糖的掺入很可能导致吸附在疏水性聚合物表面/水界面后由α-螺旋形成β-转角[24]。也有研究表明,适当的酶解处理可以改善β-酪蛋白的乳化特性。经胰蛋白酶处理后,β-酪蛋白水解物在pH 4.0~7.5范围内的溶解度大大提高。在pH 1.5~3.5和pH 6.5~10.0范围内,β-酪蛋白水解液的乳化活性均高于β-酪蛋白,但其乳化稳定性均低于原β-酪蛋白乳状液[25]。
2.2 营养功能
β-酪蛋白富含人体必需氨基酸,是重要的氨基酸来源之一。除其本身作为营养物质外,β-酪蛋白在乳汁中以胶束状态将营养物质,特别是不溶性矿物质,如磷酸钙,以一种容易摄入的悬浮液形式输送给婴儿,这种悬浮液满足了婴儿消化系统的特殊要求[26]。作为一种磷酸化蛋白质,β-酪蛋白能参与矿物质转运,其磷酸化区域可与钙离子结合,磷酸化程度越高,结合钙离子的能力越强[27]。β-酪蛋白可促进钙离子、磷离子以及其他二价阳离子,如铁离子、锌离子的吸收,对改善钙、铁、锌等元素缺乏症状有积极效果[28-29]。β-酪蛋白在体内水解产生低分子质量的酪蛋白磷酸肽(casein phosphopeptides,CPPs)后,金属离子结合能力会进一步增强,CPPs已经被证明可作为载体促进肠膜对钙、磷、硒、铁、锌等离子的吸收,同时对提高机体免疫功能等也具有重要作用[30]。
2.3 分子伴侣活性
有研究发现,β-酪蛋白具有类似分子伴侣的功能活性。β-酪蛋白能够通过与变性底物蛋白形成稳定的复合物抑制胰岛素、溶菌酶、醇脱氢酶和过氧化氢酶等底物蛋白的热聚集和化学聚集,同时还发现β-酪蛋白不仅能阻止底物蛋白的聚集,而且能溶解已经形成的蛋白聚集体,β-酪蛋白显示出比α-酪蛋白更高的分子伴侣样活性,这可能是由于二者脯氨酸残基的数量和疏水基的暴露程度不同[31]。
β-酪蛋白的天然结构对准确发挥其生物学功能很重要。还原态非酶糖基化能改变β-酪蛋白的结构和功能,当对β-酪蛋白进行葡萄糖修饰时,β-酪蛋白的伴侣活性会发生改变;由于乳汁本身具有较强的还原环境、含有大量还原糖,因此在体内β-酪蛋白糖基化还原过程中很可能发生类似的结构和功能改变[32]。
2.4 生物活性肽
β-酪蛋白具有优良的消化特性,在消化过程中,磷酸化β-酪蛋白被降解成多种具有生物活性的肽段,并能够引起行为、消化代谢、激素、免疫、神经和营养等多方面的应答[3]。近年来的许多研究发现,经过消化产生的β-酪蛋白肽段具有抗氧化性、抗菌抑菌性及免疫调节活性等多种功能。因此β-酪蛋白可被视为具有生物活性的不同肽的前体,这些肽在工艺过程中可以通过消化或酶解从蛋白质中释放出来[33]。王麟艳[34]以牛乳β-酪蛋白为原料,对其进行体外模拟消化,对获得的消化产物进行功能评价,结果表明,与未经过消化的β-酪蛋白相比,β-酪蛋白的胃蛋白酶、胰蛋白酶及复合酶消化产物均具有显著的羟自由基、超氧阴离子自由基清除能力和还原能力,且复合酶(胃蛋白酶和胰蛋白酶)消化产物的抗氧化能力比单酶消化产物的抗氧化能力强。β-casofein是一种乳源生物活性肽,又称为β-酪蛋白肽(94~123),Bessette等[35]通过大鼠喂养实验发现,β-casofein对消炎痛类药物所致肠炎具有保护作用,其机制可能与保护杯状细胞和促进创面愈合有关。A1型和B型β-酪蛋白能产生β-酪啡肽7,β-酪啡肽7是一种重要的乳源生物活性阿片肽,可以通过调节内源性阿片受体激动剂肽的生理反应,进而影响中枢神经系统细胞的生长[36]。
母乳中含有多种天然乳源生物活性肽,其中一类来源于β-酪蛋白的短链蛋白水解肽β-casomorphins,对新生婴儿具有阿片样作用、免疫调节、抗氧化和饱腹功能[37]。通过抑菌实验发现,母乳来源的活性肽β-casein 15和β-casein 38对包括大肠杆菌、金黄色葡萄球菌和李斯特菌在内的多种常见致病菌均有明显抑菌作用,由于新生婴儿容易受到这些常见致病菌感染,因此β-casein 15和β-casein 38具有抗致病菌感染治疗的临床应用价值,可应用于预防婴幼儿细菌感染[38-39]。母乳来源的活性肽β-casein 125能够促进淋巴细胞增殖,可能对婴幼儿免疫系统的发育具有重要作用[40]。另外,还有一些来源于β-酪蛋白的活性肽被证明具有抗高血压作用[41]。
3β-酪蛋白在婴儿配方乳粉中的应用
目前,在蛋白质方面,我国的婴幼儿配方乳粉食品安全国家标准(GB 10765—2010《食品安全国家标准 婴儿配方食品》、GB 10767—2010《食品安全国家标准 较大婴儿和幼儿配方食品》)仅规定了总蛋白质含量以及乳清蛋白与酪蛋白的比例,而对蛋白质中的其他成分没有进一步规定。β-酪蛋白作为母乳蛋白质中酪蛋白的最重要组分,在模拟婴儿配方乳粉的蛋白质组成方面发挥重要作用。由于牛乳β-酪蛋白与人乳β-酪蛋白的组成与结构具有较高相似性,因此向婴儿配方乳粉中强化牛乳β-酪蛋白可以优化婴儿配方乳粉的蛋白质组成和氨基酸比例,提升婴儿配方乳粉的营养品质。
β-酪蛋白或β-酪蛋白水解物可以应用于婴儿配方乳粉中,并具有良好的营养效果[42]。van Dael等[43]在婴儿配方乳粉中以β-酪蛋白替代酪蛋白,使婴儿配方乳粉的蛋白质及氨基酸组成模拟母乳的蛋白质及氨基酸组成,大鼠喂养婴儿配方乳粉实验结果表明,用β-酪蛋白替代酪蛋白不会影响生长期大鼠摄入蛋白质或矿物质生物利用度,其营养效果类似于以α-乳清蛋白替代乳清蛋白,并且优于蛋白质来源为普通酪蛋白的配方。
现阶段,β-酪蛋白在婴儿配方乳粉中的应用主要为通过添加β-酪蛋白调整配方中蛋白质组分的比例,以达到蛋白质组分母乳化的目的。由于母乳中不仅含有β-酪蛋白,还存在多种天然乳源生物活性肽,因此先对β-酪蛋白进行定向酶解,以产生所需的生物活性肽,再对婴儿配方乳粉进行生物活性肽的母乳化也许是未来婴儿配方乳粉产品的研发方向。
4 结 语
β-酪蛋白作为母乳中的主要酪蛋白成分,具有多种重要的生理功能。通过比较人乳β-酪蛋白与牛乳β-酪蛋白的结构及特性差异,在以牛乳β-酪蛋白替代母乳β-酪蛋白的基础上,进一步在活性肽水平上模拟母乳组成,使婴幼儿配方乳粉中的生物活性肽水平接近母乳,能够进一步满足婴儿对蛋白质类营养的需求。
