吐温对钝齿棒杆菌产L-精氨酸代谢的影响
2022-02-16陈民良陈雪岚熊勇华
赵 越,陈民良,陈雪岚,*,熊勇华
(1.江西师范大学生命科学学院,江西 南昌 330096;2.南昌大学中德联合研究院,江西 南昌 330047)
吐温(Tween)是指一类聚氧乙烯失水山梨醇脂肪酸酯,简称聚山梨酯,作为表面活性剂,其分子中既含有亲水基团又含有亲油基团,为两亲性物质[1-2]。根据脂肪酸链的不同,Tween分为Tween 20、Tween 40、Tween 60和Tween 80,其中Tween 40(聚氧乙烯山梨醇酐棕榈酸酯)和Tween 80(聚氧乙烯脱水山梨醇单油酸酯)由于能显著提高目的产物产量,常作为发酵促进剂用于发酵工程[3-5]。例如,Matsushima等[6]利用谷氨酸棒杆菌(Corynebacterium glutamicum)重组菌进行发酵,在培养基中添加Tween 40时,1,5-戊二胺产量提高到原来的2 倍;Zotta等[7]发现,Tween 80对干酪乳杆菌(Lactobacillus casei)N87发酵所得芳香化合物产量有贡献。由此可见,Tween的添加有利于微生物发酵生产。据此,本实验分别探究Tween 40、Tween 80及Tween 80结合油酸对本课题组构建的钝齿棒杆菌(Corynebacterium crenatum)CCM01产精氨酸的影响。
FarR是转录调控因子GntR家族中的一员[8-9],该家族共同特征是N端氨基酸序列以螺旋-转角-螺旋的空间构象形成DNA结合域,C端为配体结合功能域[10-11]。FarR作为大肠杆菌中脂肪酸响应蛋白,当其C末端配体结合功能域与环境中的长链脂肪酸结合时,会导致FarR的空间构象发生变化,而使其从DNA操纵子区域上解离,从而释放下游基因[12-13]。在棒杆菌属中,关于farR的研究文献很少。其中,Hänßler等[14]采用DNA微阵列技术比较了C. glutamicum的farR敲除株与野生株在转录水平上的差异,结果发现,farR敲除株中L-精氨酸合成途径中的相关基因argJ、argB、argD和argF出现明显上调;Lee等[15]通过染色质免疫共沉淀方法发现,FarR捕捉argB基因上游的调控区域量最高,并结合凝胶迁移实验发现,其与L-精氨酸合成途径的阻遏蛋白ArgR(CCM01的ArgR发生了致死突变)在argB基因上游的调控区域存在竞争关系,表明FarR在精氨酸合成途径中扮演了负调控的角色。因此,本实验进一步探究Tween的添加对farR转录的影响及其对精氨酸合成途径的影响。
1 材料与方法
1.1 材料与试剂
实验所用出发菌株为本课题组构建的C. crenatumMT NAGK M4 ΔproBΔNcgl1221ΔdtsR1(以下简称CCM01)。
实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)试剂盒SYBR®Premix EXTaqTMII (Tli RNaseH Plus)、DNA Maker、限制性内切酶日本TaKaRa公司;DNA纯化回收试剂盒 北京赛百盛基因技术有限公司;TRIzol®Reagent提取试剂盒 美国Invitrogen公司;2×Taq(Pfu) Mix、T4 DNA连接酶、质粒提取试剂盒 天根生化科技(北京)有限公司;Tween 40、Tween 80、油酸 天津永大化学试剂有限公司;EnzyChromTM烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)/NADPH试剂盒美国BioAssay Systems公司;其他试剂为分析纯。
1.2 仪器与设备
Prism 7900HT real-time PCR仪 美国应用生物系统有限公司;JS-2000凝胶成像系统 上海培清科技有限公司;TC-96梯度PCR仪 杭州博日科技有限公司;TGL-20高速冷冻离心机 上海卢湘离心机仪器有限公司;ZWY-2102C恒温摇床 上海智诚科技有限公司;MicroPluserTM电转仪 美国伯乐仪器有限公司;BG-XM 496酶标仪 青岛弘海环保设备有限公司。
1.3 方法
1.3.1 精氨酸发酵及Tween质量浓度的优化
挑取CCM01单菌落接种至5 mL LBG培养液(10 g/L蛋白胨、5 g/L酵母膏、10 g/L氯化钠、10 g/L葡萄糖),30 ℃、220 r/min培养12 h;取3~30 mL种子培养基(30 g/L葡萄糖、20 g/L硫酸铵、0.5 g/L磷酸二氢钾、0.5 g/L硫酸镁、20 g/L玉米浆、1.5 g/L尿素,用10 mol/L NaOH溶液调节pH值至7.0),30 ℃、220 r/min培养12 h后,接种量按初始菌株密度达到OD562nm为0.2接种到25 mL发酵培养基(120 g/L葡萄糖、45 g/L硫酸铵、0.05 g/L磷酸二氢钾、0.5 g/L硫酸镁、25 g/L玉米浆,用10 mol/L NaOH溶液调节pH值至7.0)中,继续于30 ℃、200 r/min发酵36 h后,向其中分别添加梯度质量浓度(0、5、10、15、20 mg/mL)的Tween 40和Tween 80,然后优化Tween 80(15 mg/mL)和油酸混合添加的物质的量比(1∶0、1∶0.05、1∶0.075、1∶0.1和1∶0.2),共发酵120 h,取样检测生理指标,每组做3个平行实验。
以上培养基灭菌条件均为121 ℃灭菌20 min,其中葡萄糖采用过滤除菌。
1.3.2 菌体生长量测定
取200 μL菌液至酶标板微孔中,于562 nm波长处用酶标仪测定菌液OD562nm,按OD562nm=1即为0.375 g/L换算后计算发酵液中菌体细胞质量浓度[16]。
1.3.3L-精氨酸含量测定
采用改良的坂口试剂法[17],取发酵120 h发酵液,5 000 r/min离心后用纯水稀释适当倍数至250 μL,加入1 mL 0.375 mol/L NaOH溶液及250 μL坂口试剂混匀,30 ℃水浴20 min,于520 nm波长处用酶标仪测定溶液OD520nm。菌体细胞产精氨酸率以L-精氨酸含量与菌体细胞质量比值表示。
1.3.4 发酵液葡萄糖消耗量的测定
采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定发酵液中剩余的葡萄糖含量[18]。取对数生长后期发酵液,用超纯水稀释适当倍数至体积为1 mL,加入750 μL DNS试剂,沸水浴5 min,迅速冷却至室温,再稀释适当倍数后,于540 nm波长处用酶标仪测定溶液OD540nm。
根据发酵液中残糖量计算葡萄糖消耗量,糖转化率以葡萄糖消耗量与L-精氨酸含量比值表示。
1.3.5 胞内NADPH水平测定
按照试剂盒说明书测定胞内NADP+/NADPH水平。取2 份1 mL发酵对数期菌液,5 000 r/min离心收集菌体,洗涤2 次后,1 份加入100 μL NADP+提取液,另1 份加入100 μL NADPH提取液,60 ℃水浴5 min后冰水中冷却;再分别加入20 μL Assay Buffer和100 μL的Extraction Buffer,混匀后,12 000 r/min离心5 min,取上清液测定NADP+/NADPH水平。NADP+/NADPH反应体系为:20 μL Assay Buffer、1 μL Enzyme Mix、10 μL葡萄糖及14 μL噻唑蓝,总体积85 μL,混匀后,于562 nm波长处用酶标仪测定0~30 min内样品溶液的OD值变化速率(ΔOD562nm/min)[19]。NADP+、NADPH水平以每克菌体细胞中所含NADP+、NADPH物质的量表示,单位为μmol/g。
1.3.6 real-time PCR检测L-精氨酸合成相关基因转录
1.3.6.1 引物的设计与合成
根据C. crenatum的基因(https://www.ncbi.nlm.nih.gov/genome/17277)设计用于real-time PCR的引物(表1),引物均由生工生物工程(上海)股份有限公司合成。

表1 引物及其序列Table 1 Primer sequences used in this study
1.3.6.2 细菌总RNA的提取及反转录
取发酵对数中后期菌液2 mL,5 000 r/min离心,收集菌体;按TRIzol®Reagent提取试剂盒说明书提取细菌总RNA。以经过DNAase I处理的总RNA为模板,按SYBR®Premix EXTaqTMII(Tli RNaseH Plus)试剂盒说明书进行反转录,获得cDNA。
以16S rRNA及ropB为内参,按SYBR®Premix EXTaqTMII (Tli RNaseH Plus)试剂盒说明书进行real-time PCR。反应体系(20 μL):2×SYBR®Premix EXTaqTMII 10 μL,50×ROX Reference Dye 0.4 μL,上、下游引物各0.8 μL,无菌水6 μL。real-time PCR反应程序:95 ℃、30 s,95 ℃、5 s,60 ℃、34 s,循环40 次。采用2-ΔΔCt方法[20]定量分析各基因表达水平。
1.4 数据处理与分析
2 结果与分析
2.1 添加不同脂肪酸链Tween对CCM01产L-精氨酸代谢的影响
2.1.1 添加Tween 40对CCM01产L-精氨酸代谢的影响
本实验以CCM01为出发菌株,在发酵对数生长初期(36 h)添加不同质量浓度Tween 40,探究其对CCM01菌株产L-精氨酸的生理代谢影响。如图1所示,添加10 mg/mL Tween 40时,菌体细胞质量浓度、L-精氨酸产量、葡萄糖消耗量均达到最高,表明此质量浓度下Tween 40对菌株生长及其产L-精氨酸代谢有一定的促进作用。添加10 mg/mL Tween 40时,细胞质量浓度较CCM01组提高了7.33%,L-精氨酸产量提高了11.98%(表2)。Tween 40质量浓度进一步提高则会对菌株生长产生一定的抑制作用,同时显著降低L-精氨酸产量及葡萄糖消耗量,这可能是由于Tween 40质量浓度过高对细胞有一定的毒性,不利于CCM01菌株对营养物质的吸收和运输。本课题组前期实验表明,DtsR1未缺失时,CCM01菌株发酵产L-精氨酸的最佳Tween 40添加量为5 mg/mL[21]。本实验中Tween 40的最佳添加量与其相比提高了1 倍,表明DtsR1的缺失使菌株更能耐受Tween 40。同时L-精氨酸产量在此条件下也达到最大,推测此时菌株可能产生了更多的NADPH供给L-精氨酸合成,因此监测添加10 mg/mL Tween 40时胞内NADPH水平。如表3所示,添加10 mg/mL Tween 40时胞内NADPH水平达到(18.93±0.80)μmol/g,较CCM01组提高了42.01%;相应的NADP+水平随着NADPH水平的显著升高而发生显著下降,添加10 mg/mL Tween 40时胞内NADP+水平较CCM01组下降了18.30%。说明Tween 40的添加促进CCM01高产L-精氨酸可能与胞内NADPH水平提高有关。
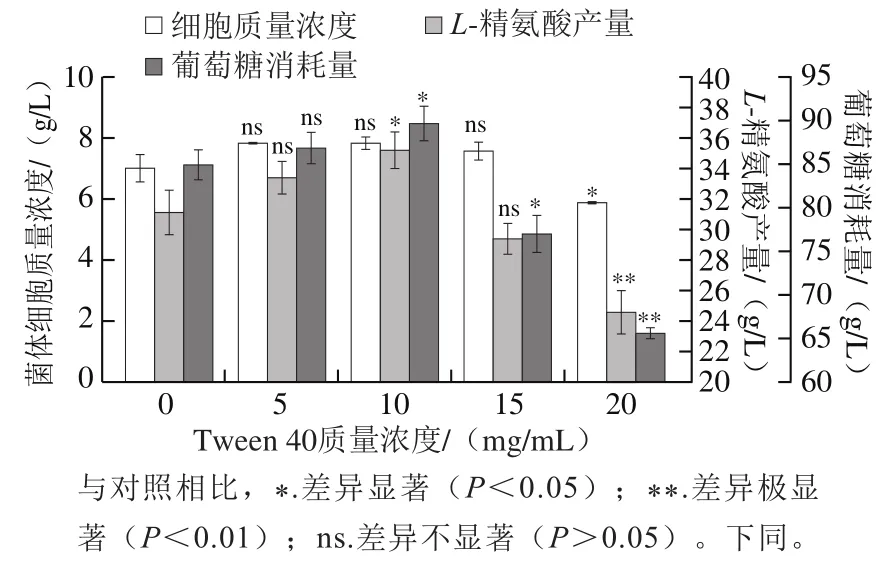
图1 添加不同质量浓度Tween 40对CCM01产L-精氨酸代谢的影响Fig. 1 Effects of Tween 40 on the metabolism of CCM01 for L-Arg production

表2 不同发酵条件下CCM01产L-精氨酸代谢参数Table 2 Metabolic parameters for L-Arg production in CCM01 under different fermentation conditions

表3 不同发酵条件下CCM01胞内NADPH/NADP+水平Table 3 Intracellular NADP+ and NADPH concentrations in CCM01 under different fermentation conditions
2.1.2 Tween 80和油酸添加对CCM01产L-精氨酸代谢的影响
高质量浓度Tween 40的添加会诱导CCM01菌株生成更多的NADPH,从而为L-精氨酸的合成提供更多的还原力[22]。前期工作发现,Tween 80的添加也可诱导NADPH的生成[19],文献[23-27]报道其也可作为碳源供给菌株生长。因此,本课题组探究Tween 80对CCM01产L-精氨酸代谢的影响。如图2所示,随着Tween 80质量浓度的增加,菌株细胞质量浓度也随之升高,Tween 80质量浓度为20 mg/mL时达到9.33 g/L,与0 mg/mL相比,显著增加了26.59%,但Tween 80质量浓度为15 mg/mL时L-精氨酸产量最高,达到(38.10±1.34)g/L,与0 mg/mL和添加10 mg/mL Tween 40相比,分别提高了21.11%和8.15%,此时糖转化率也达到最大(0.40±0.01)(表2),这表明Tween 80的添加对CCM01产L-精氨酸代谢的促进作用优于Tween 40。如表3所示,Tween 80质量浓度为15 mg/mL时胞内NADPH水平达到(26.94±1.78)μmol/g,较CCM01+10 mg/mL Tween 40组增加了42.31%,NADPH水平的进一步提升可为L-精氨酸的合成提供更多的还原力,这也证明添加Tween 80效果优于Tween 40。

图2 添加不同质量浓度Tween 80添加对CCM01产L-精氨酸代谢的影响Fig. 2 Effect of Tween 80 on the metabolism of CCM01 for L-Arg production
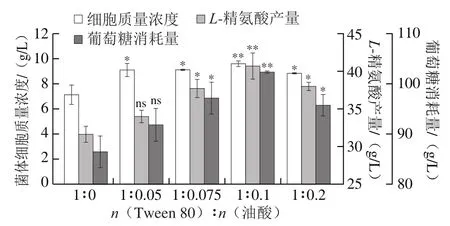
图3 Tween 80与油酸混合添加对CCM01产L-精氨酸代谢的影响Fig. 3 Effect of Tween 80 combined with oleic acid on the metabolism of CCM01 for L-Arg production
Tween 80合成的基本底物为油酸,但其难溶于水。Menberru等[28]报道,Tween 80及油酸按一定比例混合能促进棒杆菌生长,Tween 80包含的疏水性和亲水性基团使其能与油酸混合并分散在水介质中,一定比例的油酸可能因其疏水性与菌株细胞膜相互作用,与Tween 80共同增强细胞运输营养物质的能力并提高菌体生长。本实验探讨Tween 80和油酸按一定物质的量比乳化后对CCM01产L-精氨酸代谢的影响,结果如图3及表2所示。在Tween 80最佳添加量(15 mg/mL)下,当n(Tween 80)∶n(油酸)物质的量比为1∶0.1(即油酸添加量为0.99 mg/mL)时,细胞质量浓度达到最大,为(9.16±0.17)g/L,较CCM01+15 mg/mL Tween 80组增加了6.39%,此时L-精氨酸产量、葡萄糖消耗量也达到最大值,分别为(40.74±1.58)g/L和(102.38±0.21)g/L,表明Tween 80和油酸物质以物质的量比为1∶ 0.1混合可以最大程度地促使细胞生长,为L-精氨酸的生产提供更多的细胞工厂,同时葡萄糖的高转化也能为L-精氨酸的合成提供更多的碳源。但随着油酸添加量的增加,菌株生长和糖消耗明显被抑制,L-精氨酸产量也随之下降,表明适当比例的Tween 80与油酸才有助于菌株的生长。按照n(Tween 80)∶n(油酸)为1∶ 0.1添加也有利于胞内NADPH积累(表3),此时胞内NADPH水平达到(34.07±1.86)μmol/g,较CCM01+15 mg/mL Tween 80组提高了26.47%。以上结果表明,与Tween 40和Tween 80相比,按n(Tween 80)∶n(油酸)为1∶0.1添加更有利于CCM01合成L-精氨酸。
2.2 Tween对CCM01中L-精氨酸合成相关基因转录水平的影响
2.2.1 Tween对合成NADPH相关磷酸戊糖途径基因转录水平的影响
NADPH是精氨酸合成过程中不可或缺的还原力,在L-精氨酸合成途径中,每合成1 mol精氨酸需要消耗3 mol NADPH,因此,NADPH供应充足有利于L-精氨酸合成。以上实验结果显示,添加不同脂肪酸链Tween均有助于提升CCM01菌株的NADPH供应量,本实验通过realtime PCR观察不同条件下CCM01中合成NADPH有关的磷酸戊糖途径基因簇tkt-tal-zwf-opcA-pgl和gnd的转录水平。
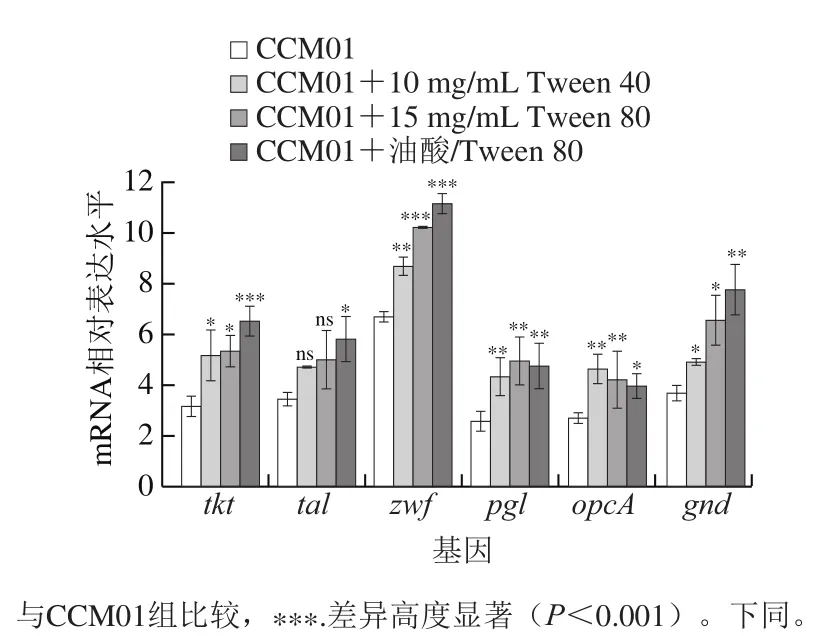
图4 Tween对NADPH合成相关基因表达水平的影响Fig. 4 Effect of Tween on transcription levels of genes involved in NADPH synthesis
如图4所示,10 mg/mL Tween 40、15 mg/mL Tween 80及按n(Tween 80)∶n(油酸)为1∶0.1添加均可使CCM01磷酸戊糖途径的基因簇tkt-tal-zwf-opcA-pgl和gnd转录水平得到提高,且n(Tween 80)∶n(油酸)为1∶0.1添加组各基因转录水平均较高,这与该添加组高产L-精氨酸的结果相符。
2.2.2 Tween对L-精氨酸生物合成途径相关基因及farR转录水平的影响
在谷氨酸棒杆菌中,脂肪酸响应蛋白FarR可响应培养环境中的脂肪酸酯,下调farR转录,从而上调L-精氨酸合成途径中相关基因(gdh、argB和argG)的转录水平,FarR在L-精氨酸合成中扮演了负调控的角色[29-30]。据此,为了解在CCM01中添加Tween对farR转录水平的影响及其变化对L-精氨酸生物合成途径相关基因转录水平的影响,本实验通过real-time PCR检测L-精氨酸合成途径的相关基因gdh、argB、argG及farR转录水平,结果如图5所示。添加不同脂肪酸链的Tween不同程度下调了farR基因转录水平,尤其是n(Tween 80)∶n(油酸)为1∶0.1组中,farR的转录水平较CCM01组高度显著下调(P<0.001),为最低水平;相应地,gdh、argB和argG基因的转录水平达到最高,这与此条件下精氨酸产量最高的发酵实验结果相符。

图5 Tween对L-精氨酸生物合成途径相关基因及farR转录水平的影响Fig. 5 Effect of Tween on transcription levels of genes involved in the L-Arg biosynthetic pathway and farR
3 结 论
CCM01中敲除的DtsR1是脂肪酸合成途径的起始关键酶——乙酰辅酶A羧化酶,其缺失阻断了脂肪酸的合成,从而减少了NADPH消耗,有利于L-精氨酸的合成[21]。本实验结果显示,该蛋白的缺失可提高菌株对高质量浓度Tween的耐受,相对较高质量浓度的Tween可以进一步提高CCM01精氨酸积累,究其原因是,一方面,提高了磷酸戊糖途径相关基因的表达水平,从而为L-精氨酸合成提供了充足的NADPH;另一方面,Tween下调了脂肪酸响应蛋白FarR的表达,FarR作为L-精氨酸合成途径的负调控因子,其下调导致L-精氨酸合成相关基因argB、argG和gdh的上调,这也有利于L-精氨酸的合成。综上所述,Tween 40、Tween 80及适当比例Tween 80和油酸的混合添加,不仅能提高CCM01的NADPH供应,且能通过下调FarR的表达进而上调L-精氨酸合成相关基因转录水平,从两方面提高精氨酸产量。
