奶牛源乳房链球菌毒力与耐药性分析
2022-02-12沈文祥李亚娟马晓宇王胜义李宏胜丁学智武小虎严作廷
杨 洁,蒋 威,沈文祥,李亚娟,马晓宇,王胜义,李宏胜,丁学智,武小虎,严作廷
(中国农业科学院兰州畜牧与兽药研究所/农业农村部兽用药物重点实验室,甘肃兰州 730050)
乳房链球菌(Streptococcusuberis)是一种革兰氏阳性球菌,兼性厌氧,营养要求较高,在含有绵羊血的琼脂培养基上生长良好。乳房链球菌通常是导致奶牛乳房炎的主要病原菌[1-2],但也有研究表明乳房链球菌同样可以导致奶牛子宫内膜炎的发生[3]。而国内关于子宫内膜炎的乳房链球菌报道还较少。子宫内膜炎是奶牛产后常见疾病之一,常造成奶牛受孕期延长,屡配不孕,甚至淘汰,带来了巨大的经济损失[4]。乳房链球菌分离株通常携带有一些已知的毒力基因,如编码透明质酸荚膜的基因hasA、hasB、hasC,纤溶酶原激活物编码基因pauA、GAPDH脱氢酶编码基因gapC、乳铁蛋白黏附基因sua,CAMP因子编码基因cfu,以及黏附相关基因acdA、fpb和slp等,在细菌对宿主的黏附定植,组织损伤,以及逃避宿主免疫应答过程中发挥重要作用[5]。生物被膜是包括乳房链球菌在内很多细菌都具有的一种特性,能够促进细菌对组织的黏附,并帮助细菌抵抗外界不良环境[5]。对于奶牛子宫内膜炎的治疗,临床上常以抗菌药物为主。但由于近年来抗菌药物的不合理使用,导致临床分离株的耐药性逐渐严重,使得抗菌药物的治疗效果明显降低。对病原菌进行药敏试验以此监测病原菌耐药情况,对于指导临床合理用药,提示新药研发方向等具有重要意义。本研究通过采集甘肃省内不同养殖场患有子宫内膜炎奶牛的子宫黏液样本,对病原微生物进行分离鉴定,并对乳房链球菌的毒力基因、耐药性以及生物被膜形成能力进行检测,以此来了解乳房链球菌导致子宫内膜炎的致病机制及耐药性情况,以期为奶牛子宫内膜炎的预防和控制提供理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 血平板,广东环凯微生物科技有限公司产品;细菌基因组DNA提取试剂盒,OMEGA BIOTEC公司产品;2×TaqSuper Master Mix,北京诺禾致源科技股份有限公司产品;DNA Marker、核酸染料,北京天根生化科技有限公司产品;引物,北京擎科生物技术有限公司合成;CAMHB 培养基,北京酷来搏科技有限公司产品;无菌裂解马血,北京索莱宝科技有限公司产品。
1.1.2 主要仪器 DNA凝胶成像系统,中国香港基因有限公司产品;酶标仪,美国博腾仪器有限公司产品。
1.1.3 菌株来源 本研究的18株乳房链球菌分离自甘肃省武威市、张掖市5个牧场中子宫内膜炎奶牛的子宫黏液样品,如表1所示。

表1 乳房链球菌来源及分离率
1.2 方法
1.2.1 子宫内膜炎临床诊断及采样方法 奶牛分娩后21 d及以上,虽没有明显的全身性症状,但仍然分泌含有50%以上黏脓性物质的子宫黏液时可被诊断为子宫内膜炎[4]。采样方法为将套有无菌输精枪管套的输精枪从阴道口插入子宫,用10 mL的注射器将子宫黏液吸出,然后注入细菌采样管中低温带回实验室。
1.2.2 乳房链球菌分离鉴定及CAMP试验 将子宫黏液接种于血平板上,37 ℃有氧培养24 h,选取具有乳房链球菌典型生长特征的菌落进行传代纯培养。使用基因组DNA提取试剂盒根据说明书的方法步骤提取细菌基因组DNA,并利用PCR扩增16S rRNA基因。引物序列及退火温度如表2所示。PCR体系为25 μL: 12.5 μL 2×TaqSuper Master Mix,0.5 μL上游引物和下游引物(浓度为10 μmol/L),300 ng DNA模板,剩余体积用去离子水补齐,并使用去离子水代替模板作为阴性对照。将PCR产物经10 g/L~20 g/L琼脂糖凝胶电泳鉴定后送生物公司进行核酸序列分析,并利用NCBI网站中的Blast程序比对结果 (https://www.ncbi.nlm.nih.gov/),确定分离株的属和种,并根据18株分离株及1株乳房链球菌标准株(JCM 5709)的16S rRNA序列,运用MEGA-X软件构建其系统发育树。CAMP试验是指部分链球菌菌株可以分泌一种CAMP因子使得葡萄球菌β溶血带增加,称为协同溶血作用。试验方法为将待测菌株划一细线接种到血平板上,再用1株β溶血的葡萄球菌接种1条与刚才互相垂直的线条,注意两条线距离0.5 mm左右,不要交叉,培养24 h后两条线交汇处出现明显的月牙形溶血现象可判定为CAMP试验阳性菌。
1.2.3 乳房链球菌毒力基因检测 检测乳房链球菌分离株10种已知的毒力基因(hasA、hasB、hasC、sua、slp、pauA、gapC、acdA、fpb、cfu)。如上所述,提取乳房链球菌基因组DNA,使用特异性引物对毒力基因进行扩增,表2列出了引物序列和退火温度,PCR体系如上述所示,并将PCR产物进行电泳及拍照。

表2 引物序列及退火温度
1.2.4 乳房链球菌生物被膜形成能力检测 参考文献[13],运用组织培养平板法研究乳房链球菌分离株形成生物被膜的能力。将生长至对数期的细菌悬液浓度调整至0.5麦氏浊度 (108CFU/mL),并用BHI肉汤(添加有20 mg/mL葡萄糖、20 mg/mL蔗糖和50 mL/L新生牛血清)100倍稀释,稀释后加入200 μL于96孔板中,每株菌重复3个孔。阳性对照为金黄色葡萄球菌标准株(ATCC 25923),阴性对照为不含细菌的BHI肉汤。37 ℃培养36 h后,轻轻倒去液体,并用300 μL PBS冲洗3次,室温晾干。甲醇固定20 min,20 mg/mL结晶紫染色15 min。将多余的结晶紫洗净风干后, 950 mL/L乙醇洗脱染料,用酶标仪测量570 nm处吸光度值(OD)。每次试验重复3次。判定标准ODc=平均值(阴性对照)+3SD(阴性对照),若测量菌株的OD≤ODc,表示菌株不能产生生物膜;ODc≤OD≤2ODc,表示产生生物被膜的能力较弱;2ODc≤OD≤4ODc,表示产生生物被膜的能力为中等;OD>4ODc产生生物被膜的能力较强。
1.2.5 乳房链球菌耐药性检测 根据美国临床和实验室标准协会(CLSI)指南,采用微肉汤稀释法测定8种抗菌药物对乳房链球菌分离株的最小抑菌浓度(MIC)。使用的抗菌药物为氨苄西林、红霉素、四环素、左氧氟沙星、利福平、克林霉素、头孢噻呋、庆大霉素。所用的培养基为含有50 mL/L无菌裂解马血的CAMHB肉汤。在96孔板中使用培养基对抗菌药物溶液进行梯度稀释,并加入细菌悬浮液(终浓度约为105CFU/mL),总体积为200 μL,置于37 ℃培养箱中培养24 h,以肉眼无可见菌落形成的最小浓度作为该抗菌药物对乳房链球菌的最小抑菌浓度。肺炎链球菌ATCC 49619为质控菌株。根据CLSI指导手册及之前的研究,8种抗菌药物的耐药临界值见表3,其中红霉素、四环素、左氧氟沙星、利福平、克林霉素、氨苄西林的临界值均来源于CLSI指导手册,头孢噻呋及庆大霉素的临界值参考文献[11-12]。

表3 各抗菌药物临界值
2 结果
2.1 乳房链球菌分离率
本实验从5个牧场的48份子宫黏液样品中共计分离出18株(38.5%)乳房链球菌,结果见表4。不同牧场分离率介于0~57.14%之间,其中张掖市牧场3的分离率最高。18株分离株以及1株乳房链球菌标准株的系统发育树见图1。此外,CAMP试验阳性菌为7株(38.89%)。

图1 18株乳房链球菌分离株与1株乳房链球菌标准株系统进化树

表4 乳房链球菌毒力基因谱
2.2 乳房链球菌毒力基因检测
所有分离株均携带pauA、fpb、sua、slp、gapC及cfu基因,而基因hasA、hasB、acdA的携带率分别为88.89%、94.44%和94.44%,未检测到hasC基因。根据菌株携带的毒力基因种类,乳房链球菌的毒力基因谱有4类,如表5所示,其中最常见的类型为hasA/hasB/pauA/fpb/sua/slp/gapC/acdA/cuf。
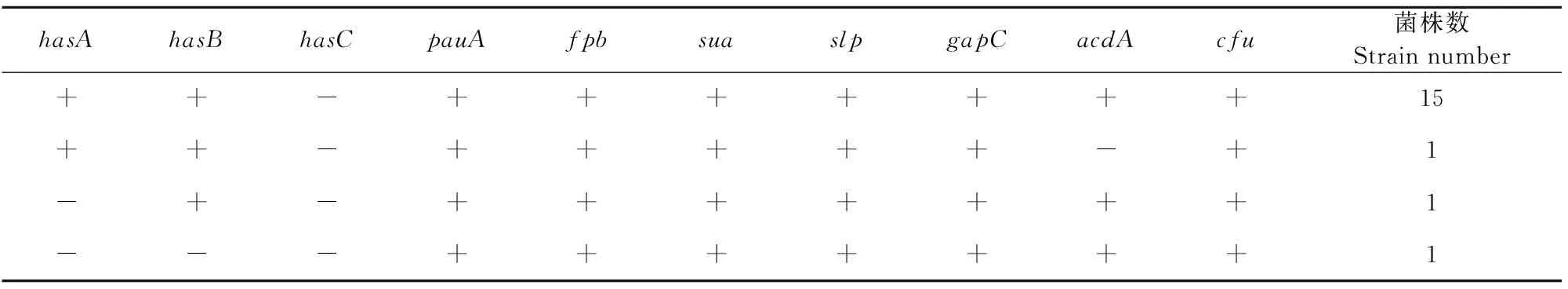
表5 乳房链球菌毒力基因谱
2.3 乳房链球菌生物被膜形成能力
所有的乳房链球菌分离株都具有形成生物被膜的能力,其中33.3%(n=6)的菌株具有较强的生物被膜形成能力,而27.8%(n=5)及38.9%(n=7)的菌株分别具有中等强度及较弱的生物被膜形成能力。
2.4 乳房链球菌耐药性
乳房链球菌对8种抗菌药物的耐药性比例见表6。18株乳房链球菌对利福平敏感且MIC值均小于等于0.125 μg/mL。14株(77.8%)分别对四环素和克林霉素耐药,MIC值为0.125 μg/mL~16 μg/mL和0.125 μg/mL~4 μg/mL。11株(61.1%)和14株(77.8%)分别对红霉素和左氧氟沙星敏感,MIC值为0.063 μg/mL~4 μg/mL和0.25 μg/mL~32μg/mL。77.8%的菌株对氨苄西林敏感,剩余22.2%的菌株对氨苄西林中度敏感,MIC范围为0.016 μg/mL~8 μg/mL。12株(66.7%),13株(72.2%)分别对头孢噻呋及庆大霉素耐药,MIC范围为0.031 μg/mL~ 4 μg/mL及0.25 μg/mL~32μg/mL。

表6 18株乳房链球菌对8种抗菌药物的耐药性
3 讨论
乳房链球菌作为一种环境性病原微生物,能够适应不同的环境条件及宿主。乳房链球菌最初是在患有奶牛乳房炎的乳汁中分离得到的,而此后的一些研究发现,乳房链球菌同样可以从产后奶牛的子宫黏液中分离得到,成为导致奶牛子宫内膜炎发生的潜在威胁[3]。由于奶牛生产过程中子宫颈口打开,使得原本定植于生殖道的正常菌群或存在于环境中的微生物逆行进入子宫,并在子宫内定植且大量繁殖,引起产后急性炎症,大部分奶牛通过自净作用可以在产后21 d之内将病原微生物排出体外,恢复子宫内无菌环境。但部分无法将病原菌自行排出体外的奶牛,将可能患上产后子宫内膜炎,导致受孕延迟,影响生产性能。
通过对德国某牧场产后奶牛子宫内微生物的动态学分析表明,乳房链球菌的分离率为18.5%[3]。但国内对来源于子宫内膜炎的乳房链球菌的研究还较少,本研究的结果表明,来自张掖及武威的子宫黏液样品乳房链球菌的分离率分别为43.59%及11.11%,说明不同地区不同牧场导致奶牛子宫内膜炎的优势病原菌的种类存在一定的差异。
乳房链球菌携带有一些已知的毒力基因,在细菌黏附、定植、组织损伤及逃避宿主免疫应答的过程中发挥着重要作用。hasA、hasB和hasC基因编码透明质酸荚膜,可以封闭中性粒细胞表面受体的Fc位点,防止菌体与中性粒细胞结合,从而抵抗中性粒细胞对细菌的吞噬作用,逃避宿主的免疫应答。不过,有研究表明,has基因缺陷株同样可以抵抗中性粒细胞的杀菌作用而引发奶牛乳房炎[6]。本试验中hasA和hasB基因的携带率分别为88.89%和94.44%,没有检测到hasC基因。而在国外的一些研究中,例如在阿根廷某些牧场中患有乳房炎奶牛分离得到的乳房链球菌,hasA,hasB及hasC的携带率分别为74.3%、66.4%和89.7%[7]。PauA基因编码纤溶酶原激活物,可以将纤溶酶原激活为纤溶酶,水解宿主细胞外基质蛋白及上皮细胞紧密连接蛋白,促进细菌的定植及扩散[5]。本研究中,pauA基因存在于100%的菌株中。因此,有研究用pauA基因作为普通RCR诊断方法以及环介导等温扩增(LAMP)诊断方法的分子靶标,为临床乳房链球菌的快速检测提供了便利[14-15]。GapC基因编码的是甘油醛-3-磷酸脱氢酶(GAPDH),可以将甘油醛-3-磷酸转化为1,3-双磷酸甘油酸,参与糖酵解过程。在本试验中,100%的乳房链球菌携带有gapC基因。而在阿根廷某些牧场来源于乳房炎的乳房链球菌中,gapC基因的检出率为79.4%[7]。有研究利用GapC重组蛋白对小鼠进行免疫,保护率可达到70%,表明GapC蛋白可作为预防乳房链球菌感染疫苗研发的候选蛋白[16]。SUAM是一种能够结合乳铁蛋白的黏附分子,由sua基因编码。在本研究中,sua基因的携带率为100%,而在上述阿根廷某些牧场分离得到的菌株中,sua基因的携带率为83.3%[7]。cfu基因编码CAMP因子,可以增强β溶血型金黄色葡萄的溶血活性,在混合感染中发挥作用。在本试验中,所有的乳房链球菌均携带有cfu基因,但仅38.89%的菌株表现为CAMP试验阳性。而在上述分离自奶牛乳房炎的菌株中,cfu基因的携带率为76.9%, CAMP试验阳性的菌株为23%[7],表明并不是所有携带有cfu基因的菌株都表现CAMP试验阳性。还有一些与黏附相关的编码基因,如acdA基因编码的是一种Zn结合蛋白,94.44%的分离株携带有该基因,slp基因编码的是一种表面脂蛋白,本试验分离得到的菌株都有携带,fpb编码的是一种经分选酶加工的表面蛋白,携带率同样为100%。
细菌可以分泌一些胞外多聚物如蛋白质、脂质、DNA等,形成一种致密的结构,使得细菌由悬浮态变为黏附态,称为生物被膜。本试验的结果表明,100%的乳房链球菌具有形成生物被膜的能力,其中33.3%的菌株具有较强的生物被膜形成能力。而在国外的一些研究中,来源于德国及波兰牧场乳房炎的乳房链球菌中,大约有46%~77%的菌株能够形成生物被膜[12,17]。
抗菌药物仍然是治疗奶牛子宫疾病的主要方法,但由于近年来抗菌药物的不合理使用,使得临床分离株的耐药性日益严重。且一旦针对某抗菌药物的耐药菌株形成,该菌株携带的基因可在不同种属的菌群中扩散,使得耐药情况更加严峻。因此,根据药敏试验结果合理使用抗菌药物,避免抗菌药物的滥用及泛用就显得尤为重要。本试验测定了8种抗菌药物对乳房链球菌的最小抑菌浓度(MIC),结果表明,乳房链球菌对四环素、克林霉素、头孢噻呋、庆大霉素的耐药性较严重,分别达到了77.8%、77.8%、66.7%及72.2%。大部分的菌株对红霉素、左氧氟沙星及氨苄西林敏感,分别为61.1%、77.8%和77.8%。但部分菌株对这3种抗菌药物耐药,因此需要进一步了解乳房链球菌对这些抗菌药物耐药机制,警惕耐药菌株在菌群中的扩散。在此前对巴西某牧场临床乳房炎的乳房链球菌研究中,该地区菌株对氨苄西林的耐药性较严重,达到了66.2%,头孢噻呋、四环素及红霉素的结果与本试验差异不大,对头孢噻呋、四环素耐药菌株达77.1%和69.9%,且有53.1%的菌株对红霉素敏感[18]。在2015年-2016年对欧洲乳房炎的调查表明大部分的乳房链球菌对氨苄西林敏感,有24%和37.5%的菌株分别对红霉素及四环素耐药[19]。
本试验表明,张掖地区子宫内膜炎病例中乳房链球菌的分离率较高,可能成为引起子宫内膜炎的优势菌群。此外,来源于子宫内膜炎的乳房链球菌同样携带有多种已知的毒力基因,且都具有形成生物被膜的能力。该地区乳房链球菌对四环素、克林霉素、头孢噻呋、庆大霉素的耐药性较严重,对红霉素、左氧氟沙星及氨苄西林的较为敏感。
