芬太尼通过PI3K/Akt信号通路调控宫颈癌细胞增殖迁移*
2022-01-28薄云,刘嘉,周敏
薄 云,刘 嘉,周 敏
(1.云南省第一人民医院 a.麻醉科;b.妇产科,昆明 650100;2.昆明理工大学附属医院 a.麻醉科;b.妇产科,昆明 650012;3.昆明医科大学附属第三医院麻醉科,昆明 650012)
宫颈癌是一种发生于宫颈上皮的妇科恶性肿瘤,发病率位居女性肿瘤第二位,仅次于乳腺癌[1]。据WHO统计,世界每年新增宫颈癌病例约50万,其中约有30万病例来源于经济落后国家或地区[2]。我国是宫颈癌高发国家,每年宫颈癌新发病例约13万,约占世界宫颈癌年发病总数的1/4~1/3[3]。近年伴随社会文化、饮食习惯及生活方式的改变,宫颈癌的发病率明显上升,且呈现年轻化趋势。有资料显示,年轻女性宫颈癌发生率以每年2%~3%的速度迅速增长[3]。目前宫颈癌的治疗方法主要包括手术治疗、化疗和放疗,其中手术是治疗宫颈癌最主要的方式。越来越多的证据表明,麻醉技术和其他围术期因素是影响恶性肿瘤手术后长期转归的潜在因素[4]。近年来,随着麻醉药抗肿瘤的作用及机制正在被现代医学工作者不断的揭示,发现阿片类药物能影响一些肿瘤细胞(如胃癌细胞、肺癌细胞)的增殖、转移、凋亡等[5-7]。芬太尼作为一款化学合成阿片类镇痛药被广泛用于宫颈癌手术中。研究发现,芬太尼具有抑制胃癌细胞增殖转移、肺癌细胞转移的功能[7-8],但是芬太尼对宫颈癌细胞的影响尚不得知。本研究以宫颈癌细胞系为研究对象,体外探究芬太尼对宫颈癌细胞增殖、转移、凋亡的影响,为临床宫颈癌手术治疗时麻醉药物的选择提供理论支持。
1 材料与方法
1.1 实验材料 C33A细胞购于中国科学院细胞库(中国上海);芬太尼购自宜昌人福药业;Annexin V-FITC/PI双染细胞凋亡检测试剂盒购自江苏凯基;CCK-8试剂盒购于MedChemExpress;Caspase 3、PARP1、MMP-2、MMP-9、N-cadherin、Akt、PI3K、p-Akt、p-PI3K及GAPDH抗体均购于Abcam公司。
1.2 实验方法
1.2.1 细胞培养及干预 C33A细胞在37℃、5% CO2、含10% FBS和1%青霉素/链霉素的DMEM培养液中培养,根据细胞生长状况1~2天换一次液。将细胞分为对照组和芬太尼组,将对数生长期细胞按2×103/孔接种于96孔板,待细胞贴壁,芬太尼组细胞分别加终浓度为10nmol/L、100nmol/L、100nmol/L的芬太尼刺激,培养一定时间后对C33A细胞进行增殖、转移、凋亡检测。
1.2.2 CCK-8检测细胞增殖 取不同培养时间(0h、24h、48h、72h)细胞,使用CCK-8试剂盒检测各组C33A细胞增殖情况。具体步骤:将稳定转染的细胞接种到96孔板,待细胞生长80%时,每孔加10μL CCK-8溶液,将培养板在培养箱内孵育2h,用酶标仪测定450nm处的吸光度值。
1.2.3 细胞周期检测 取对数生长期细胞,用胰蛋白酶消化并混匀,按2×105细胞/孔铺于6孔板,培养12h,待细胞贴壁,加相应浓度的LukS-PV,继续培养24h,用胰蛋白酶消化细胞,1000r/min离心5min,收集细胞,用PBS洗涤2次,4℃条件下用70%乙醇过夜固定,用PBS洗涤2次,加0.5mL的PI/RNase staining染液,避光室温孵育30min,上机检测。
1.2.4 Transwell法检测细胞迁移能力 取Transwell 48孔培养板(孔径8μm,购于康宁公司),下室加1mL含10% FBS和1%青霉素/链霉素的DMEM培养液,上室加0.5mL含10% FBS和1%青霉素/链霉素的DMEM培养液的C33A细胞悬液,37℃、5% CO2条件下培养12h,取上室滤膜和下室培养基,对滤膜进行结晶紫,显微镜下观察滤膜下侧细胞数;使用Muse Cell Analyer全能细胞状态分析仪(默克密理博公司)对下室培养基中细胞数进行计数。
1.2.5 细胞凋亡检测 收集干预48h后C33A细胞,立即使用Annexin Ⅴ-PI凋亡染色试剂盒对各组细胞进行染色;使用流式细胞仪(BD公司,Aria II)对细胞凋亡情况进行分析,采用固定流速(6mL/min),收集1min,Q1+Q2+Q3门的细胞即为发生凋亡的细胞。
1.2.6 Real-time PCR 收集干预48h后C33A细胞,Trizol法提取细胞中RNA,反转录获得cDNA,Real-time PCR法检测细胞中MMP-2、MMP-9、N-cadherin mRNA表达水平,以GAPDH作为内参。MMP-2引物:上游5'-AGCCCGGAAGATATCGTTGA-3',下游5'-GTGAACGCCTGGTAGCAATA-3';MMP-9引物:上游5'-CACCTATGGCATATAGGAGG-3',下游5'-AGAGGTTCGGTCTAAGCAAC-3';N-cadherin引物:上游5'-CCGGCGTTATCTGCGATG-3',下游5'-CTCTAGCAGGGAGGAGACTATTG-3';GAPDH引物:上游5'-CCGGCTCGCTTAGCACA-3',下游5'-AACACGGCGTAATTCGCTTT-3'。
1.2.7 Western blot检测 收集干预48h后C33A细胞,加1mL RIPA裂解液,使用组织匀浆机对细胞进行匀浆,匀浆后的细胞放于冰上裂解5min,4℃、12000g离心5min,取上清。往上清液中加loading buffer(上清液体积:loading buffer体积=4∶1);SDS-PAGE跑胶、转膜,转印蛋白的膜用5%脱脂奶粉37℃封闭2h,抗人Caspase 3抗体(1∶1000)、PARP-1抗体(1∶1000)、GAPDH(1∶1000)抗体、MMP-2抗体(1∶1000)、N-cadherin抗体(1∶1000)、MMP-9抗体(1∶1000)、Akt抗体(1∶1000)、p-Akt抗体(1∶1000)、PI3K、p-PI3K(1∶1000),4℃孵育12h(GAPDH、Caspase 3、PARP-1、MMP-2、MMP-9、Akt、p-Akt、PI3K、p-PI3K抗体均购于Abcam公司)。使用HRP标记的二抗37℃孵育1h,加ECL发光液曝光检测。

2 结 果
2.1 芬太尼干预对宫颈癌细胞增殖的影响 相比于空白组,芬太尼刺激显著减缓了C33A细胞增殖速度,且呈剂量依赖性(P<0.05)(图1)。

图1 芬太尼干预对C33A细胞增殖的影响**P<0.01 vs 空白组;#P<0.05 vs 芬太尼(10nmol/L)组;△P<0.05 vs 芬太尼(100nmol/L)组
2.2 芬太尼干预对宫颈癌细胞细胞周期的影响 流式细胞术检测结果显示,相比于空白组,不同浓度芬太尼刺激后,C33A细胞周期被阻滞在G1/G0期,且芬太尼浓度越高,阻滞在G1/G0期的细胞越多(P<0.05)(图2)。Western blot法结果显示,与空白组相比,芬太尼刺激降低C33A细胞内Cyclin D1蛋白及CDK4蛋白表达量,且呈剂量依赖性(P<0.05)(图3)。
2.3 芬太尼干预对宫颈癌细胞细胞迁移的影响 Transwell试验结果显示,相比于空白组,芬太尼组穿膜细胞数显著减少,且呈剂量依赖性(P<0.05)(图4)。
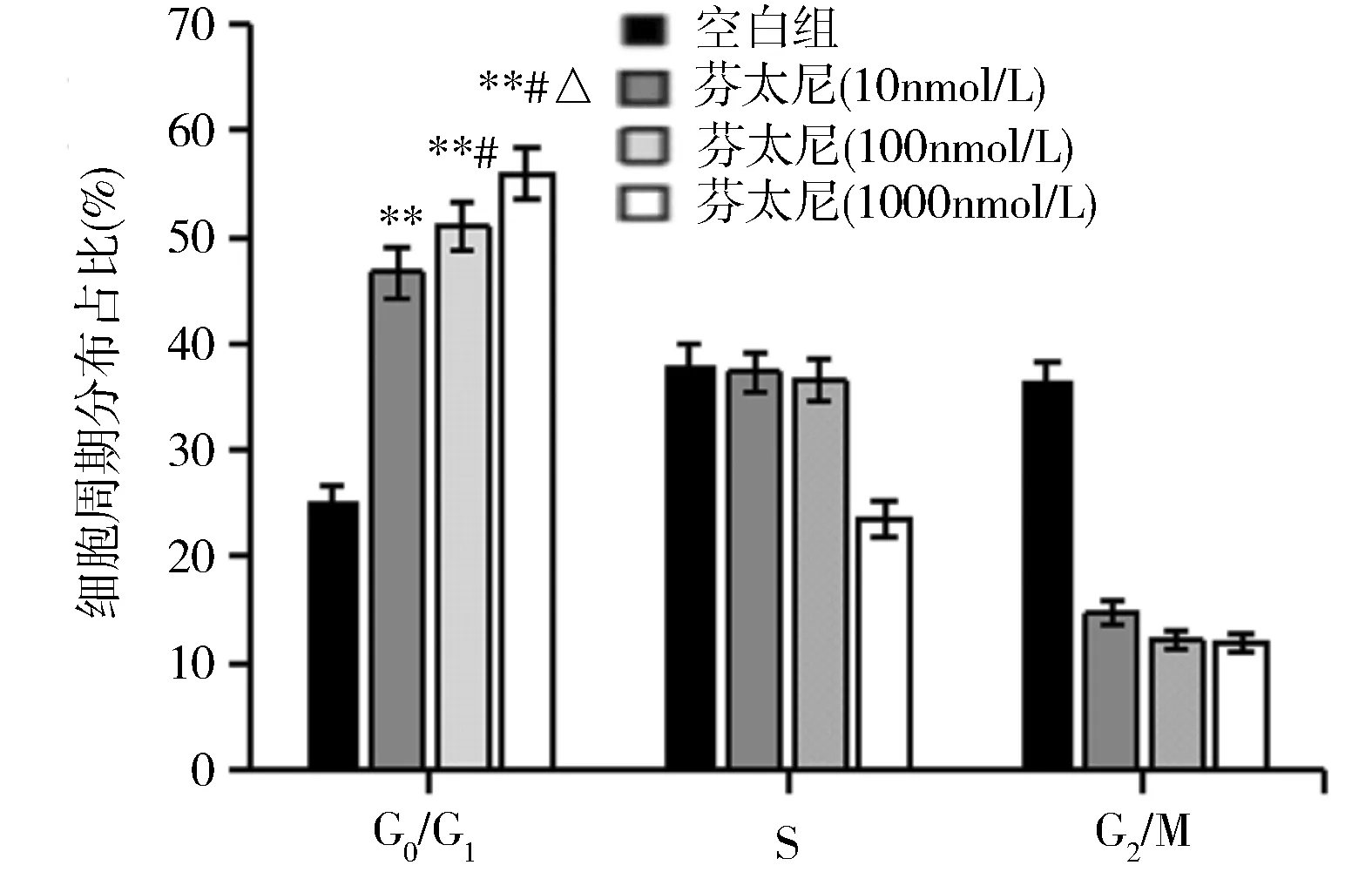
图2 不同浓度芬太尼干预后C33A细胞周期分布占比**P<0.01 vs 空白组;#P<0.05 vs 芬太尼(10nmol/L)组;△P<0.05 vs 芬太尼(100nmol/L)组

图3 芬太尼对C33A细胞周期调节蛋白Cyclin D1和CDK4表达的影响**P<0.01 vs 空白组;##P<0.01 vs 芬太尼(10nmol/L)组;△△P<0.01 vs 芬太尼(100nmol/L)组

图4 不同浓度芬太尼干预对C33A细胞迁移的影响**P<0.01 vs 空白组;#P<0.05 vs 芬太尼(10nmol/L)组;△P<0.05 vs 芬太尼(100nmol/L)组
2.4 芬太尼干预对宫颈癌细胞MMP-2、MMP-9、N-cadherin表达的影响 Real-time PCR和Western blot法检测结果显示,芬太尼干预显著降低C33A细胞内MMP-2、MMP-9、N-cadherin的mRNA及蛋白表达水平(P<0.05)(图5、6),且呈剂量依赖性。

图5 不同浓度芬太尼干预对C33A细胞MMP-2、MMP-9及N-cadherin mRNA表达的影响**P<0.01 vs 空白组;#P<0.05 vs 芬太尼(10nmol/L)组;△P<0.05 vs 芬太尼(100nmol/L)组

图6 不同浓度芬太尼干预对C33A细胞MMP-2、MMP-9及N-cadherin蛋白表达的影响**P<0.01 vs 空白组;##P<0.01 vs 芬太尼(10nmol/L)组;△P<0.05,△△P<0.01 vs 芬太尼(100nmol/L)组
2.5 芬太尼干预对宫颈癌细胞凋亡的影响 流式细胞术及Western blot检测结果显示,相比于空白组,芬太尼显著增加了C33A细胞凋亡率及活化PARP1、Caspase 3含量,且呈剂量依赖性(P<0.05)(图7)。
2.6 芬太尼干预对宫颈癌细胞凋亡的影响 Western blot结果显示,相比于空白组,芬太尼干预显著降低C33A细胞内PI3K和Akt磷酸化水平(P<0.05)(图8),且呈剂量依赖性。
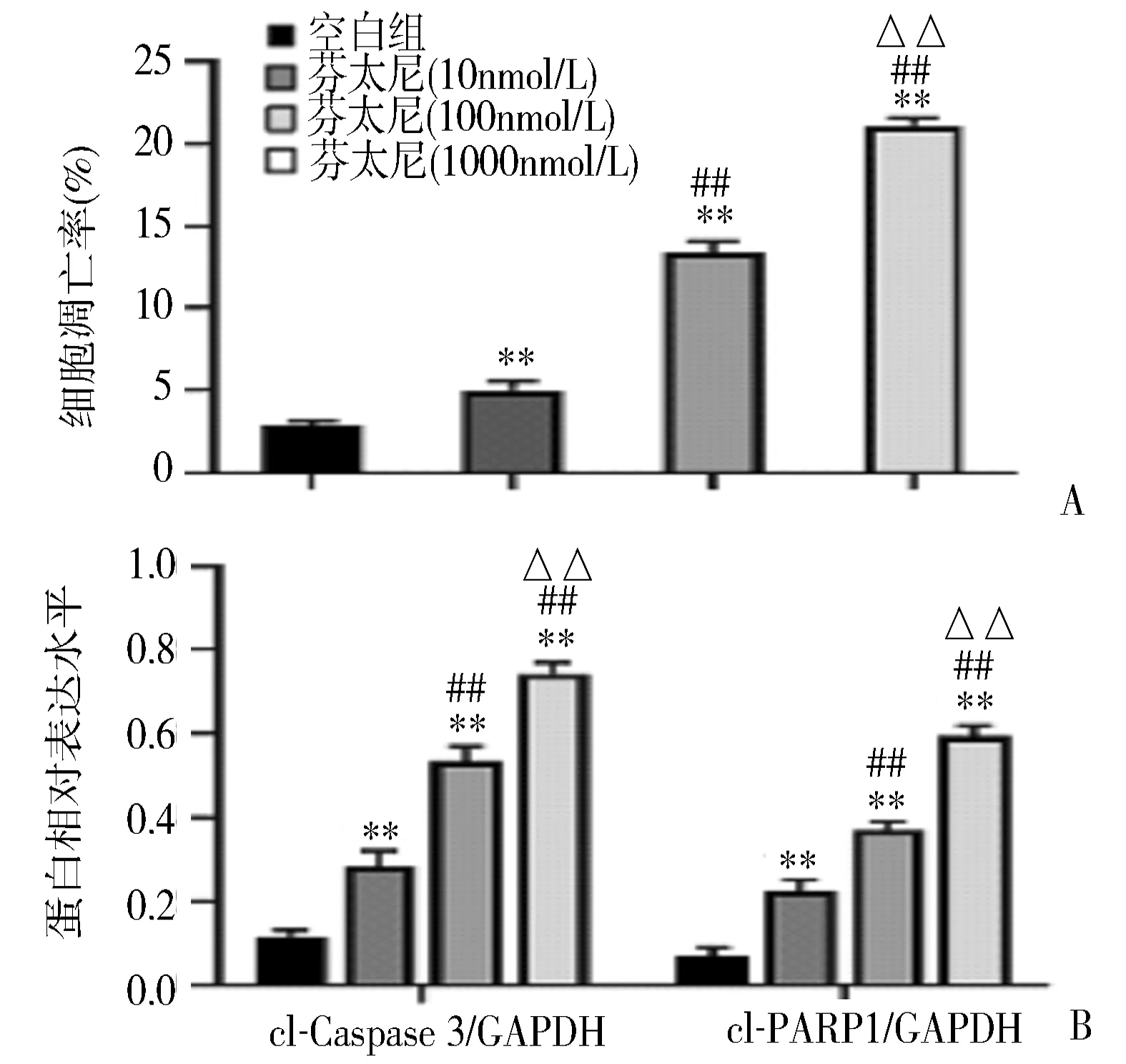
图7 不同浓度芬太尼干预对C33A细胞凋亡的影响A:Annexin V-PI染色定量结果;B:Western blot检测;cl-PARP1:PARP1剪切片段;cl-Caspase 3:Caspase 3剪切片段;**P<0.01 vs 空白组;##P<0.01 vs 芬太尼(10nmol/L)组;△△P<0.01 vs 芬太尼(100nmol/L)组
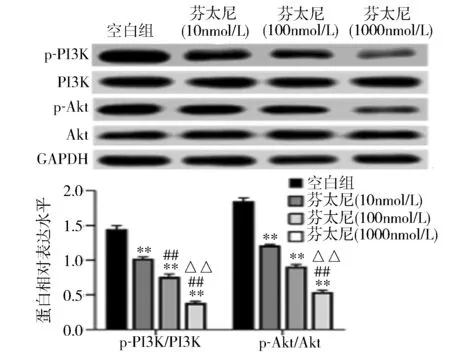
图8 不同浓度芬太尼干预对C33A细胞内PI3K/Akt通路影响**P<0.01 vs 空白组;##P<0.01 vs 芬太尼(10nmol/L)组;△P<0.05,△△P<0.01 vs 芬太尼(100nmol/L)组
3 讨 论
近年来麻醉药抗肿瘤作用的研究逐渐增多,多数麻醉药均能影响患者免疫系统功能和肿瘤细胞的活性,从而影响肿瘤细胞增殖、转移、凋亡等。研究发现,阿片类药物具有抑制肿瘤细胞增殖、转化及转移的功能[9-10]。芬太尼是一种广泛用于手术和癌症治疗的麻醉剂,在许多癌症中能抑制细胞的生存能力和入侵,如芬太尼抑制结肠直肠癌的转移[11],芬太尼通过调节NF-κB抑制胃癌细胞生长[12-13],芬太尼干预能降低胰腺癌细胞和细胞移植小鼠的细胞生存能力和肿瘤生长[14]。本研究利用宫颈癌细胞系C33A,探究芬太尼对宫颈癌细胞增殖、转移、凋亡的作用。
本研究发现,芬太尼显著抑制C33A细胞增殖生长,且呈剂量依赖性;芬太尼能将C33A细胞周期阻滞在G1/G0期,继而抑制C33A的增殖。Cyclin D1,即G1/S-特异性周期蛋白-D1,这种亚型的周期蛋白与周期蛋白依赖性激酶4(CDK4)形成复合物并作为它们的调节亚基,这两种周期蛋白依赖性激酶对于G1到S期的转变不可或缺,这种蛋白质已被证明与肿瘤抑制蛋白Rb相互作用,并且这个基因被Rb积极调控表达。研究发现,该基因出现突变、扩增或过度表达会改变细胞周期进程,这些现象常发生在多种肿瘤中并可能导致肿瘤发生[15]。本研究进一步发现,芬太尼干预能剂量依赖性地抑制Cyclin D1、CDK4表达,表明芬太尼是通过抑制Cyclin D1、CDK4,继而阻滞细胞周期,抑制细胞增殖生长。同时还发现,芬太尼干预能剂量依赖性地促进C33A细胞凋亡,分子层面促进凋亡蛋白PARP1和Caspase 3的活化,表明芬太尼干预能促进C33A细胞凋亡。
本研究发现,芬太尼具有剂量依赖性抑制C33A细胞转移的作用。肿瘤细胞迁移与ECM密切相关,ECM是一类由细胞合成,然后分泌到细胞外的大分子物质,主要由细胞之间的基质和基底膜构成,它能阻止肿瘤向远处转移[16]。MMPs的活动是在转录水平上精密调控的,主要以酶原的形式分泌到细胞外。当肿瘤细胞发生转移时,首先激活前体酶原,特定细胞外基质成分以及内源性抑制剂相互作用,其活动控制丧失以后,MMPs和其组织抑制剂之间可能失去平衡[17]。此外,肿瘤在迁移与侵袭的过程中,常常伴随上皮-间质化转变,它是上皮细胞转化为间质细胞的过程,其中N-cadherin是间充质细胞表型标志蛋白[18]。本研究发现,芬太尼剂量依赖性降低细胞内MMP-2、MMP-9及N-cadherin表达水平,表明过芬太尼能通过抑制C33A细胞转化抑制细胞转移。
信号转导通路的异常改变是肿瘤细胞的重要生物学特性,其中PI3K/Akt信号转导通路在维持细胞恶性生物学特性中起重要作用。细胞在一系列内外因素的作用下,通过启动PI3K/Akt信号转导通路,诱导细胞的增殖、分化、转移等[19]。本研究发现,芬太尼能剂量依赖性地抑制PI3K及Akt磷酸化,表明芬太尼抑制C33A细胞增殖、转移,促进C33A细胞凋亡与抑制PI3K/Akt信号转导通路的激活有关。但有关后续动物实验及芬太尼用于宫颈癌的相关临床实验仍处于筹备阶段,有待后续完善并报道。
综上所述,芬太尼具有抑制宫颈癌细胞增殖生长、分化转移以及促进其凋亡的作用,其作用分子机制与抑制PI3K/Akt信号转导通路激活有关。
