Wnt2在植入胎盘组织中的表达及其对滋养细胞迁移和侵袭功能的影响
2022-01-28陈振烈曹羽明张元珍
陈振烈,曹羽明,张 铭,张元珍,2
(1.武汉大学中南医院妇产科,武汉 430000;2.湖北省产前诊断与优生临床医学研究中心,武汉 430000)
胎盘植入是指胎盘绒毛不同程度侵入子宫肌层,是临床上导致严重产后出血、休克、围产期紧急子宫切除甚至孕产妇死亡的重要原因,孕产妇病死率为1%~7%[1-5]。胎盘植入最常见的高危因素为前次剖宫产史及前置胎盘,此外,高龄妊娠、胎盘植入史、既往子宫穿孔史、多次流产史等也是重要高危因素[6-7]。近年来,有关胎盘植入的病理生理机制备受关注,随着研究的不断深入,滋养细胞侵袭力增加被认为是胎盘植入发生和发展的重要机制之一[2]。目前滋养细胞异常侵袭的具体发生机制并不明确[8]。因此,研究胎盘植入滋养细胞的侵袭行为,探讨调控滋养细胞侵袭性机制,可为临床上预防、诊断和治疗胎盘植入提供重要的思路。
Wnt信号基因家族可通过多种信号通路调节机体正常发育所必需的多种过程,包括细胞增殖、分化、极性、迁移和侵袭[9-10]。研究表明,Wnt信号基因家族成员的异常表达与多种肿瘤的生物学过程密切相关,其中包括细胞增殖、迁移和侵袭等[11-13]。其中的重要成员之一Wnt2是目前多种恶性肿瘤发生发展的研究热点[14-15]。鉴于滋养细胞具有与肿瘤细胞高度相似的生物学行为,Wnt信号基因家族及其信号通路调节滋养细胞的生物学行为也备受关注[16-18]。目前,有关Wnt2在胎盘植入的作用尚未见相关报道。本文通过检测Wnt2在植入胎盘组织中的表达及其对HTR-8/Svneo细胞增殖、凋亡、迁移和侵袭中的作用,探究Wnt2在植入胎盘组织中的表达及对滋养细胞生物学功能的影响,旨在进一步阐明胎盘植入发生和发展的相关机制,为临床诊治提供更多的思路和策略。
1 材料与方法
1.1 研究对象 收集2020年7月至2021年1月于武汉大学中南医院妇产科行剖宫产的胎盘植入孕产妇胎盘组织15例(植入组)和正常胎盘组织15例(对照组)。胎盘植入患者均符合《胎盘植入诊治指南(2015)》诊断标准:分娩前经临床高危因素结合彩色多普勒超声或MRI征象评估,且最终确诊根据手术中或分娩时所见或分娩后的病理学诊断[1]。两组基本资料见表1。纳入研究的孕产妇均排除妊娠期高血压疾病、绒毛膜羊膜炎、糖尿病和胎盘早剥等病史。本研究经医院伦理委员会审核通过,孕产妇知情并签署知情同意书。
1.2 方法
1.2.1 标本处理 胎盘娩出后,迅速取胎盘母体面胎盘组织2块(约1.0cm×1.0cm×1.0cm),正常组选取母体面胎盘中间带部位组织,植入组选取粘连或植入部位组织,取材时注意避开胎盘组织出血、坏死和钙化处。一块组织经RNA稳定保存液处理,-80℃保存,用于RT-PCR和Western blot检测;另一块标本常规处理后固定于10%福尔马林溶液,以制备石蜡切片并进行免疫组化检测。
1.2.2 细胞复苏和培养 HTR-8/Svneo细胞购自ATCC。从液氮中取出细胞冻存管,迅速置于37℃温水,融化后转移至15mL离心管,1000r/min离心5min,弃上清,用完全培养基重悬,置于37℃、5%CO2培养箱,采用10%胎牛血清(四季青)的RPMI 1640培养基(Gibco)进行培养,并加1%青霉素和链霉素(Gibco)预防细菌污染。
1.2.3 细胞转染 将2×105细胞/mL的HTR-8/Svneo细胞悬液于6孔板铺板,待细胞密度达60%~80%时用GP-transfect-Meta转染试剂(吉玛基因)转染,用siRNA转染HTR-8/Svneo细胞,37℃静置培养细胞,6h换成完全培养基继续培养。siRNA序列:阴性对照组(si-NC)sense 5-UUCUCCGAACGUGUCACGUTT-3,antisense 5-ACGUGACACGUUCGGAGAATT-3;干扰组(si-Wnt2)sense 5-CCAGGGUGAUGUGCGAUAATT-3,antisense 5-UUAUCGCACAUCACCCUGGTT-3。
1.2.4 RNA提取和RT-PCR检测 严格按RNA提取试剂盒(艾德莱生物)使用说明书提取胎盘组织和HTR-8/Svneo细胞总RNA,并严格按逆转录试剂盒(Vazyme)使用说明书将1μg总RNA逆转录成cDNA。采用SYBR Premix Ex Taq 试剂盒(Vazyme)测定胎盘组织中Wnt2、MMP-2和MMP-9表达水平和Wnt2基因敲低前后细胞中Wnt2、β-catenin、Bcl-2、Caspase-3、MMP-2和MMP-9表达水平。引物序列:Wnt2 F:5-TGACTGGACAACCGCTAC-3,R:5-GTGGGAAGACATTGAGAAAG-3;β-catenin F:5-AAAGCGGCTGTTAGTCACTGG-3,R:5-CGAGTCATTGCATACTGTCCAT-3;Bcl-2 F:5-GGTGGGGTCATGTGTGTGG-3,R:5-CGGTTCAGGTACTCAGTCATCC-3;Caspase-3 F:5-CATGGAAGCGAATCAATGGACT-3,R:5-CTGTACCAGACCGAGATGTCA-3;MMP-2 F:5-GCCCCCAAAACGGACAAAGA-3,R:5-TCCCAAGGTCCATAGCTCATCG-3;MMP-9 F:5-TTGACAGCGACAAGAAGTGG-3,R:5-GCCATTCACGTCGTCCTTAT-3。用CFX-connect(赛默飞)进行RT-PCR检测,记录各待测目的基因相对于阈值循环(Ct)值数值,通过2-ΔΔCt法计算目的基因相对表达水平。
1.2.5 蛋白提取和Western blot检测 严格按细胞蛋白提取试剂盒(碧云天)使用说明书提取胎盘组织和HTR-8/Svneo细胞总蛋白,严格按BCA试剂盒(碧云天)使用说明书操作步骤检测各组总蛋白浓度。采用10% SDS-PAGE胶进行电泳分离,采用半干湿转法转膜到PVDF膜(Millipore),经5%脱脂牛奶室温封闭1h,采用相应一抗4℃孵育过夜。一抗有Wnt2兔单抗(1∶2000,Abcam),β-catenin兔单抗(1∶2000,Abcam),Bcl-2兔单抗(1∶2000,Abcam),Caspase-3兔单抗(1∶2000,Abcam),MMP-2兔单抗(1∶2000,Abcam),MMP-9兔单抗(1∶2000,Abcam)。用TBST洗膜3次,每次5min,将膜用相对应的二抗(1∶5000,Abcam)在室温下孵育1~1.5h,用TBST洗膜3次,用ECL发光法进行显影。
1.2.6 细胞凋亡检测 取生长状况良好的对数生长期HTR-8/Svneo细胞,按2×105细胞/孔接种于6孔板,检测敲低Wnt2表达对HTR-8/Svneo细胞凋亡的影响。细胞培养48h,严格按细胞凋亡检测试剂盒使用说明书操作步骤处理,流式细胞仪检测细胞凋亡率。
1.2.7 细胞迁移检测 Transwell迁移实验:取5×104经转染的HTR-8/Svneo细胞悬浮于500μL不含FBS的RPMI 1640培养基中,加Transwell小室上室(孔径8μm;Corning)。下室中加600μL含20%FBS的RPMI 1640培养基,37℃、5%CO2培养箱孵育24h,待细胞侵入Transwell小室下层,用多聚甲醛固定后进行结晶紫染色,并通过Olympus IX71荧光倒置显微镜明场成像,每个小室取5个视野进行细胞计数,取其平均值,本实验重复3次。
1.2.8 细胞侵袭检测 Transwell侵袭实验:取转染后HTR-8/Svneo细胞5×104悬浮于500μL不含FBS的RPMI 1640培养基,加已铺备好Matrigel基质胶的Transwell小室上室(下室加600μL含20%FBS的RPMI 1640培养基),37℃、5%CO2培养箱孵育24h,待细胞侵入Transwell小室下层,多聚甲醛固定,结晶紫染色,通过Olympus IX71荧光倒置显微镜明场成像,每个小室取5个视野进行细胞计数,取其平均值,本实验重复3次。
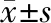
2 结 果
2.1 两组孕妇的基础资料比较 对照组和胎盘植入组孕产妇的年龄、孕周、妊娠次数、产次和剖宫产次数比较,差异均无统计学意义(均P>0.05),见表1。

表1 两组孕妇一般情况比较
2.2 两组产妇胎盘组织中Wnt2、MMP-2和MMP-9表达情况 与对照组胎盘组织相比,植入组胎盘组织中Wnt2、MMP-2和MMP-9 mRNA和蛋白表达量显著增加,差异均有统计学意义(均P<0.01),见图1。
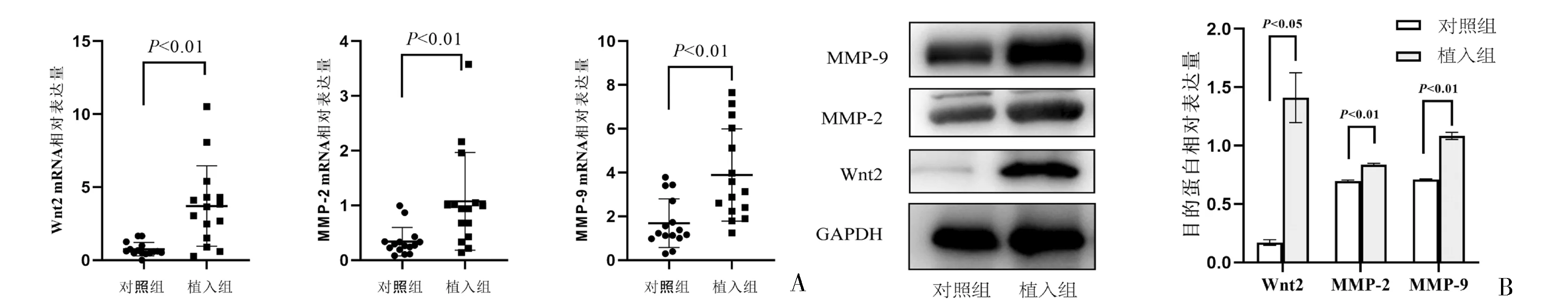
图1 两组产妇胎盘组织中Wnt2、MMP-2和MMP-9表达情况A:对照组和植入组胎盘组织中Wnt2、MMP-2和MMP-9 mRNA相对表达量比较;B:对照组和植入组胎盘组织中Wnt2、MMP-2和MMP-9蛋白相对表达量比较
2.3 敲低Wnt2对HTR-8/Svneo细胞凋亡的影响 si-Wnt2组细胞Wnt2 mRNA和蛋白相对表达量显著低于si-NC组细胞(均P<0.05),见图2A。si-Wnt2组细胞48h时凋亡率显著高于si-NC组细胞(P<0.01),见图2B。
2.4 敲低Wnt2对HTR-8/Svneo细胞迁移和侵袭的影响 Transwell迁移和侵袭实验结果显示,si-Wnt2组24h迁移和侵袭细胞数均显著低于si-NC组(均P<0.01),见图2C、D。

图2 敲低Wnt2对HTR-8/Svneo细胞迁移和侵袭的影响A:两组细胞中Wnt2 mRNA和Wnt2蛋白相对表达量;B:两组细胞分别培养48后细胞凋亡比较;C:两组细胞分别培养24h后细胞迁移比较;D:两组细胞分别培养48h后细胞侵袭比较
2.5 敲低Wnt2对HTR-8/Svneo细胞相关蛋白的影响 与si-NC组相比,si-Wnt2组细胞的β-catenin、Bcl-2、MMP-2和MMP-9 mRNA和蛋白相对表达量显著减少(均P<0.05),Caspase-3 mRNA和蛋白相对表达量显著升高(P<0.01),见图3。

图3 敲低Wnt2对HTR-8/Svneo细胞相关蛋白的影响A~E:分别为两组细胞中β-catenin、Bcl-2、Caspase-3、MMP-2和MMP-9 mRNA相对表达量比较;F:两组细胞中MMP-2和MMP-9蛋白相对表达量比较
3 讨 论
胎盘植入是临床上造成产后出血、围产期紧急子宫切除和孕产妇死亡的重要原因。近年来,胎盘植入的发生率迅速上升,较前升高近20倍,其发生率已高达1/533[19]。既往研究表明,在胎盘植入的发生过程中,绒毛膜外滋养细胞(extrachorionic trophoblast,EVT)的侵袭力和数量均显著增加,但其具体发生机制尚未明确[17]。多项体内研究表明,Wnt信号基因家族在胚外组织发育过程中起着至关重要的作用,特别是在胎盘血管形成、绒毛膜-尿囊融合和迷宫功能中,而Wnt2就是其中关键成员之一[20]。Monkley等[21]研究发现,约50%的Wnt2表达缺失的胎鼠在围产期死亡,进一步组织学分析显示,Wnt2表达缺失小鼠胎盘组织中毛细血管数量明显减少,且纤维蛋白样物质数量增加,表明Wnt2是小鼠胎盘血管正常形成所必需的。Boyer等[22]也发现,Wnt2缺陷型小鼠的胎盘组织中显示出不同的缺陷,如组织水肿、毛细血管数目减少和纤维蛋白样沉积。Li等[23]报道,复发性自发流产孕产妇胎盘绒毛组织中Wnt2蛋白表达量显著低于正常孕产妇胎盘绒毛组织,且体外实验显示,过表达Wnt2可促进滋养细胞的增殖和迁移能力。本研究结果显示,植入胎盘孕产妇胎盘组织中Wnt2、MMP-2和MMP-9表达量较对照组均显著增加,提示其与胎盘植入的发生发展关系密切。
EVT的迁移和侵袭能力受到其自身分泌的多种细胞因子、蛋白酶和炎症介质调控,其中基质金属蛋白酶(matrix metalloproteinases,MMPs)家族被认为是其重要调控成分。MMPs家族作为一类锌依赖的肽链内切酶,可通过降解细胞胶原产物,破坏细胞内基质成分,在滋养细胞侵袭、子宫螺旋动脉重铸和血管再生中发挥重要作用。Kocarslan等[24]研究发现,MMP-2在胎盘植入胎盘组织中的表达较正常胎盘组织显著增强,表明MMP-2可能在胎盘形成过程中发挥重要作用。Sonderegger等[25]提出,经典Wnt信号可刺激MMP-2的Wnt依赖性分泌,这可能是促进滋养层细胞侵袭能力的关键Wnt靶标之一。Zeng等[26]体外研究发现,上调MMP-9表达可促进HTR-8/Svneo胞的迁移和侵袭能力。在正常胎盘种植过程中,一部分EVT侵袭蜕膜,形成间质性滋养细胞,其可进一步侵袭至子宫肌层内侧1/3,弥漫形成多核滋养层巨细胞[27]。研究显示,胎盘植入患者胎盘中间质性滋养细胞侵袭子宫肌层深度较正常胎盘组织显著增加,且胎盘中多核滋养层巨细胞数显著增加[28]。细胞凋亡是一个极其重要的生物过程,在很多病理过程中起着至关重要的作用,而B细胞淋巴瘤-2(Bcl-2)和半胱天冬酶-3(Caspase-3)是细胞凋亡的关键调节因子。本研究通过使用siRNA敲低HTR-8/Svneo细胞Wnt2表达,发现细胞凋亡增加、迁移和侵袭能力下降,细胞中β-catenin、Bcl-2、MMP-2和MMP-9表达显著下降,Caspase-3表达显著上升。表明Wnt2可能通过wnt/β-catenin信号通路调控Bcl-2、Caspase-3、MMP-2和MMP-9表达,进而影响胎盘滋养细胞凋亡、迁移和侵袭等生物学行为。
综上所述,Wnt2与胎盘植入的发生发展的关系密切,可能通过wnt/β-catenin信号通路调控参与了胎盘滋养细胞的凋亡、迁移和侵袭等生物学行为,为进一步研究植入性胎盘发生发展机制提供了依据和新的方向。
