宫颈癌同步放化疗后疗效的预测模型构建与效能检验*
2022-01-28杜家虞马晓洁
邓 宇,李 镰,唐 洁,杜家虞,马晓洁
(1.川北医学院附属医院,南充 637000;2.川北医学院,南充 637000)
临床预测模型(connectome-based predictive modeling,CPM)是指利用数学方程式评估特定个体当前患有某种疾病或将要发生某种结局的概率,包括诊断模型和预后模型[1]。对于中晚期宫颈癌(Ⅱb~Ⅳ期)患者,NCCN指南推荐同步放化疗为首选治疗方案[2-3]。但目前的现状是Ⅱb~Ⅳa期局部晚期宫颈癌中29%~38%的患者治疗5年内出现复发[4],复发患者的5年生存率仅为3.8%~13.0%。目前的最佳治疗模式需进一步探索,构建无创且易于获得的预测模型,可估计宫颈癌的生存与预后。本研究回顾分析了同步放化疗中晚期宫颈癌患者的临床资料,建立宫颈癌同步放化疗有效率临床预测模型并进行效能检验。
1 资料与方法
1.1 一般资料 回顾分析川北医学院附属医院肿瘤科2017年6月至2020年12月收治的Ⅱa~Ⅳ期宫颈癌患者的一般临床资料。纳入标准:经病理学确诊的宫颈癌患者;治疗前采用盆腔增强MRI准确分期;2018 FIGO分期Ⅱa~Ⅳ期;既往没有接受过放化疗。排除标准:有放化疗禁忌证;伴有其他脏器原发恶性肿瘤;有全身感染、凝血异常、自身免疫性疾病;具有精神类或神经类疾病患者,导致后续的随访被干扰;因个人原因失访者;临床资料不完善。最终122例患者被纳入研究。
1.2 治疗方法 采用容积旋转调强放疗(VMAT),在CT(Siemens公司Emotion 16 Slice Configuration)引导下进行三维模拟定位临床靶区,放疗采用Elekta公司Synergy型医用高能直线加速器,具体剂量:PTV 50Gy/25Fx,5次/周;外放射治疗结束后进行后装治疗,6Gy/次,1次/周,连续治疗4周,外放射+后装治疗共9周。同时采用顺铂同步放化疗方案治疗,化疗采用顺铂注射液(江苏豪森药业股份有限公司,国药准字H20040812批号:601201105)静脉滴注,30mg/m2,1次/周,和放疗同步。
1.3 观察指标 分别于治疗前、治疗结束及治疗结束后4周行MRI、CT及阴道超声等检查,根据肿瘤病灶变化情况进行宫颈癌近期疗效评价,分为有效组和无效组。近期疗效:按实体肿瘤临床疗效评价指标[5](response evaluation criteria in solid tumors,RECIST1.1)评定:完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。有效率=(CR+PR)例数/总例数×100%。
1.4 统计学处理 采用SPSS 23.0和Graphpad prism9软件,计量资料采用t检验;计数资料的单因素分析采用χ2检验或Fisher精确检验。多因素分析采用logistic回归模型。模型预测效能采用受试者工作特征曲线(receiver operating characteristic curve,ROC曲线)进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 患者一般资料 按实体肿瘤临床疗效评价指标,122例患者中CR 7例,PR 81例,SD 34例;有效组88例,无效组34例,有效率为72.13%(88/122)。患者平均年龄(56.4±9.3)岁,有效组平均年龄(56.1±9.7)岁,其中Ⅱa期10例,Ⅱb期47例,Ⅲ期26例,Ⅳ期5例;无效组平均年龄(57.0±8.0)岁,Ⅱa期3例,Ⅱb期18例,Ⅲ期13例,Ⅳ期0例。
2.2 患者临床、影像学特征与疗效的单因素分析 单因素分析结果显示,肿瘤直径(MRI)、宫旁浸润(影像)、鳞状上皮细胞癌相关抗原(SCC)、肿瘤直径(CT)、肿瘤直径(阴道超声)与宫颈癌患者的近期疗效相关,是影响宫颈癌患者近期疗效的危险因素(P<0.05);而淋巴结转移(影像)、HPV感染、肿瘤分期、分型、子宫位置、年龄与宫颈癌患者的近期疗效无关(P>0.05)。见表1。进一步将CT、MRI、阴道超声三种影像学检查方式下测量的肿瘤直径比较,差异无统计学意义(P>0.05)(图1)。
2.3 构建宫颈癌同步放化疗疗效的临床预测模型及其预测效能评价 将单因素分析结果显示有意义的3种因素:肿瘤直径(MRI)、宫旁浸润(影像)、鳞状上皮细胞癌相关抗原(SCC),纳入回归分析中构建出临床预测模型方程:Y=-1.545-0.037 X1+2.144 X2+0.0325 X3[Y=有效率;X1=肿瘤直径;X2=宫旁浸润(影像);X3=SCC]。将患者影像及临床数据代入已构建的模型方程中,利用ROC曲线检验该模型的预测效能。结果显示,ROC曲线下面积(AUC)为0.727(P=0.0001),灵敏度为90.9,特异度为48.4,95%CI为0.6292~0.8239;Hosmer-Lemeshow拟合优度检验显示,χ2=10.51,P=0.2309。证明该临床预测模型拟合效度好(P>0.05),预测价值高(图2)。
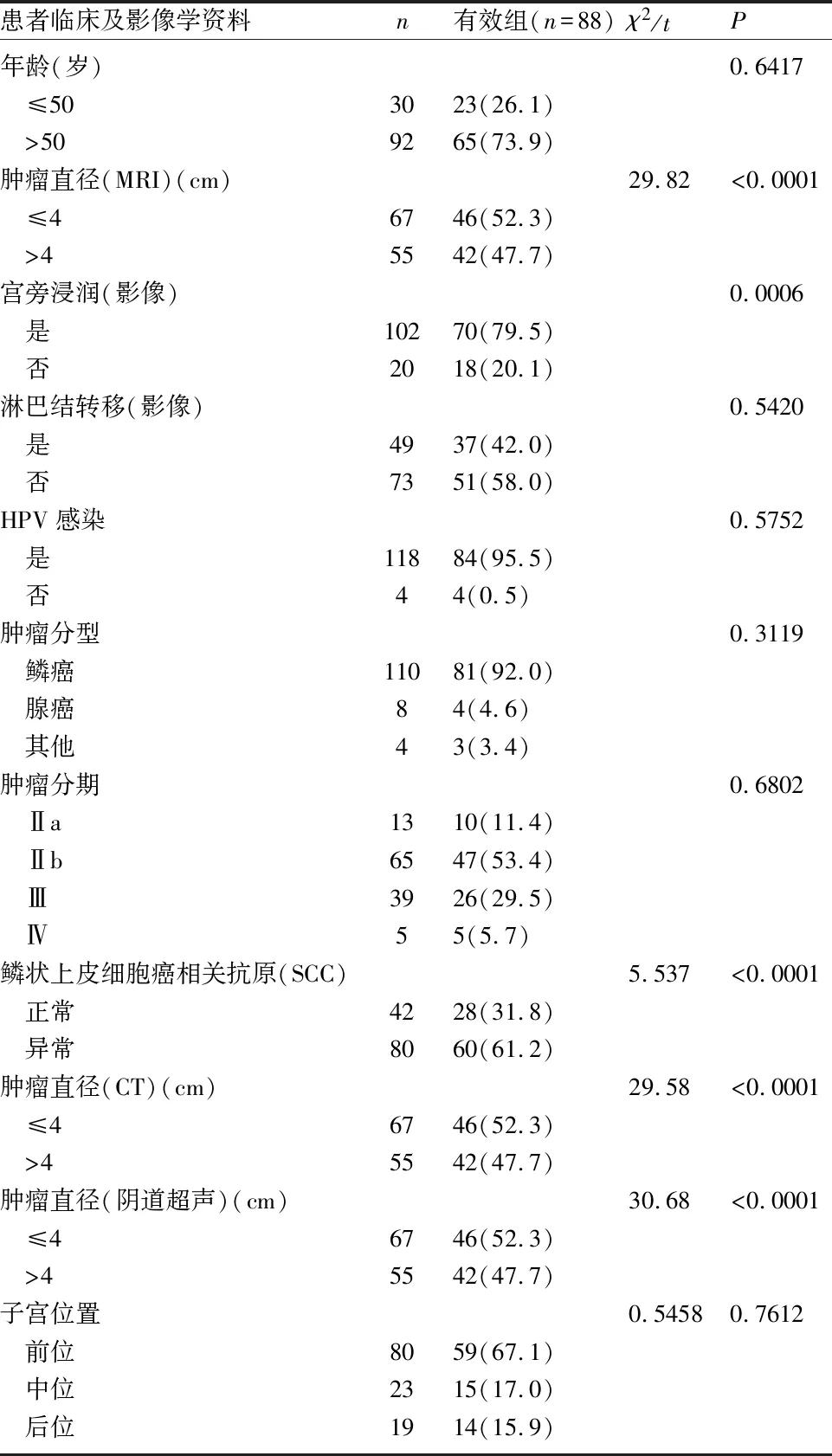
表1 同步放化疗后疗效的单因素分析[n(%)]

图1 肿瘤直径在3种检查方式下的差异

图2 宫颈癌同步放化疗有效率回归模型预测效能的ROC曲线(cut-off值取0.5时)
2.4 不同cut-off值对回归模型的影响 该临床预测模型的最佳筛查阳性界值(cut-off值)更靠近0.4,与常规回归分析cut-off值0.5有所差异(图3)。对比0.4和0.5两种不同cut-off值下作出的ROC曲线差异,发现在两种不同cut-off值下所作出的ROC曲线AUC及相应参数一致(图4),但在不同cut-off值下预测效能曲线总预测准确度有所不同(表2)。综合考虑AUC和总预测准确度这两方面因素,本研究最终选择使用cut-off为0.5的logistic回归分析,总预测准确度为74.58%(图5)。

图3 宫颈癌同步放化疗有效率回归模型预测效能的ROC曲线的最佳筛查阳性界值(cut-off)

表2 不同cut-off下预测效能曲线总预测准确度
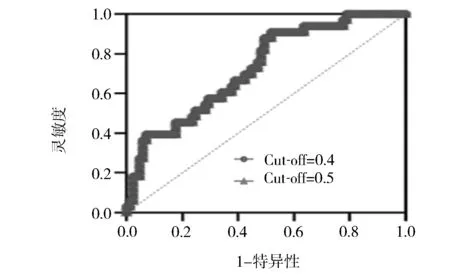
图4 不同cut-off下宫颈癌同步放化疗有效率回归模型的预测效能的ROC曲线

图5 宫颈癌同步放化疗有效率回归模型预测效能的预测效能曲线(Cut-off值取0.5时)
3 讨 论
宫颈癌是全世界常见的女性恶性肿瘤之一,据估计,全球每年约56.9万新增病例和27.5万死亡病例[6]。对于中晚期宫颈癌患者,NCCN指南推荐同步放化疗为首选治疗方案,然而这样的治疗方式造成常规病理以及临床分期等预测因素并不完全适用于中晚期宫颈癌患者,尤其是在病情较严重的情况下。因此,需要无创且易于获得的预测指标,以评估宫颈癌的生存率和预后[7]。影响中晚期宫颈癌预后的因素很多,Barkati等[8]发现治疗前Hb水平较低的患者复发率均较高,治疗前Hb水平较高的患者OS及无病生存期(DFS)较长。Wang等[9]研究发现,磁共振(MRI)肿瘤直径与肿瘤5年局部控制率相关。多项研究发现,NLR与宫颈癌患者的不良预后相关[10-12]。Cao等[13-14]研究发现,血小板计数升高与宫颈癌预后显著相关。Jonska-Gmyrek等[15]研究发现,腺癌(AC)预后较鳞腺癌(ASC)差。研究证实[16-18],血清VEGF-A水平和血清VEGFR-2水平增高是宫颈癌的独立预后因素。
临床预测模型(CPM)是指利用数学方程式评估特定个体当前患有某种疾病或将要发生某种结局的概率,包括诊断模型和预后模型[1]。虽然既往有研究验证各个因素对中晚期宫颈癌预后的影响,但较少将多种影响宫颈癌预后因素联合起来进行综合性的预测。本研究在考虑单个因素对宫颈癌生存率和预后影响的同时利用统计学进一步分析,结合这些因素建立宫颈癌同步放化疗有效率临床预测模型,并对该预测模型进行预测效能的评价[19-20]。为提高预测模型准确性,本研究纳入尽可能多的影响因素进行分析[21]。
本研究根据122例中晚期宫颈癌患者的临床及其他影像学资料,运用单因素及多因素分析,建立临床预测模型,得到方程:Y=-1.545-0.037 X1+2.144 X2+0.0325 X3[Y=有效率;X1=肿瘤直径;X2=宫旁浸润(影像);X3=SCC]。对比0.4和0.5两种cut-off值下作出的ROC曲线,综合考虑AUC和总预测准确度这两方面因素最终选择cut-off为0.5的logistic回归分析,结果发现,ROC曲线下面积为0.727(P=0.0001),灵敏度为90.9,特异度为48.4,95%CI为0.6292~0.8239;总预测准确度为74.58%,Hosmer-Lemeshow拟合优度检验显示,χ2=10.51,P=0.2309,模型拟合效度好(P>0.05),预测价值高。通过以上研究分析发现,在实际临床治疗中即使相同分期的中晚期宫颈癌患者在标准治疗方式下的预后也不尽相同,侧面反应了现有标准治疗方式可能对有宫旁浸润、肿瘤直径大、SCC值高患者治疗效果不够理想,无法达到根治的效果。本研究致力于寻找出现此差异的原因及影响因素;并建立临床预测模型用于在治疗前筛选出治疗效果不够理想的患者,指导临床对这部分患者在标准同步放化疗的基础上增加后续的治疗。为进一步研究肿瘤直径和SCC值影响患者预后的临床值,本研究在现有临床资料下对肿瘤直径和SCC值进一步分组进行方差分析,结果显示无显著差异(P>0.05),考虑可能因纳入患者数量及病例资料有限。
综上所述,肿瘤直径、宫旁浸润(影像)、SCC是影响宫颈癌同步放化疗有效率的预测因素,现有治疗方式可能对肿瘤直径较大、有宫旁浸润、SCC值较高患者治疗效果不够理想,临床对这部分患者在标准的同步放化疗的基础上可增加后续治疗。但本研究为单中心研究,纳入的患者数量级病例资料有限,有待在多中心联合且增加样本量的基础上,纳入更多的危险因素,以提供更具说服力的证据。
