黄芩抗前列腺癌作用的网络药理学分析
2022-01-26龙恭伟叶天润张宇聪李恒
龙恭伟 叶天润 张宇聪 李恒
前列腺癌(prostate cancer, PCa)是男性中最常见的肿瘤之一[1],2020年新发病例数已跃居美国男性肿瘤第一位[2]。对于局限性PCa,根治性前列腺切除或根治性放疗可有效消除肿瘤[3]。对于晚期PCa,根治性的局部治疗已不再可行,雄激素剥夺治疗(androgen deprivation therapy, ADT)是推荐的治疗方式[4]。虽然ADT可以有效延长PCa患者的无进展生存期,但部分患者还是会进展为去势抵抗型PCa(castration-resistance PCa, CRPC),对于这些患者,ADT无法提供满意的肿瘤控制效果,尚需要更多有效的抗肿瘤药物治疗。中医药作为辅助治疗手段,毒副作用较小且在提高PCa患者生活质量、减轻临床症状、延长生存期等方面显示出一定的优势[5-6]。
黄芩是一味传统的中药,是中药复方PC-SPES(prostate caner-SPES, SPES在拉丁语中为希望之意)的重要组分[7-8]。PC-SPES已被证实对CRPC有效[9-10]。作为PC-SPES的重要成分,黄芩对多种癌细胞表现出抗癌活性[11]。然而,其潜在的抗肿瘤作用机制还不明确。中医药具有多成分、多靶点、多途径的特点。而网络药理学是基于药材、成分、靶点、疾病相互作用网络的系统方法[12]。网络药理学整合多种信息来源,采用生物信息学、网络分析等计算方法,进而分析药物作用靶点及可能的机制。本研究利用网络药理学方法对黄芩治疗PCa的潜在机制及靶点进行了探索性分析,现报告如下。
对象与方法
一、网络药理学分析流程
本研究使用网络药理学的方法来探寻黄芩治疗PCa的潜在机制及靶点,具体分析流程如图1所示。该分析过程主要包括黄芩活性成分的筛选及作用靶点的识别、PCa靶点的筛选、蛋白质-蛋白质相互作用(protein-protein interaction, PPI)网络分析、多重网络的构建及富集分析。
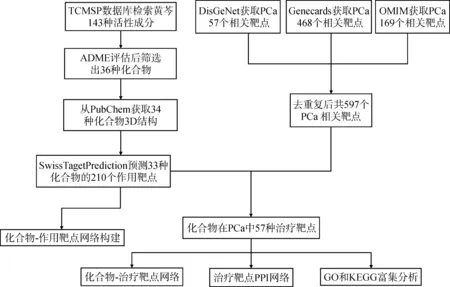
图1 分析流程图
二、黄芩活性成分的筛选和作用靶点的识别
黄芩的成分来自中药系统药理学数据库(Traditional Chinese Medicine System Pharmacology, TCMSP)。以口服生物利用度(oral bioavailability, OB)≥30%和药物相似度(drug-likeness, DL)≥0.18对黄芩的有效成分进行筛选。将筛选出的有效成分导入PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/),从而得到化合物的三维分子结构。使用SwissTagetPrediction(https://swisstargetprediction.ch)来识别潜在的靶点。没有三维分子结构信息的化合物被排除,每个化合物匹配度排名前30的靶点被列为作用靶点。
三、PCa靶点的筛选
PCa相关的靶点基因筛选自 DisGeNet(https://www.disgenet.org)、Genecards(https://www. genecards.org)和OMIM(https:// www.omim.org)数据库。以“stage, prostate cancer”为关键词从DisGeNet获得57个靶点。在Genecards中以“prostate cancer”为关键词搜索,以“relevance score>30”为条件筛选到468个靶点。在OMIM中以“prostate cancer”为关键词搜索到169个靶点。去除重复后, 597个PCa相关基因被纳入后续分析。
四、PPI网络分析
将黄芩和PCa的共同靶点导入STRING 11.0(https://string-db.org/),进行PPI分析。将物种限定为“Homo sapiens”,相互作用分数设定为≥0.7以构建相互作用网络。
五、网络构建
本研究构建了以下网络:①通过连接化合物和其相应的作用靶点,构建化合物-作用靶点网络;②黄芩与PCa共同靶点的PPI网络;③用PPI分析中筛选的靶点重新构建化合物-治疗靶点网络,以确定发挥抗PCa作用的主要活性成分。网络构建及可视化使用Cytoscape 3.8.0软件完成[13]。其中参与度(Degree)定义为该靶点与其他靶点的连接数,该指标反映了靶点在网络中的关键程度。
六、富集分析
用DAVID数据库(https://david.ncifcrf.gov)进行基因本体论(Gene Ontology, GO)和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路富集分析。GO分析对分子功能(molecular function, MF)、生物过程(biological process, BP)和细胞组分(cellular component, CC)进行了富集,使用R软件绘制条形图。KEGG富集结果使用R软件绘制气泡图进行可视化。
结 果
一、化合物及靶点筛选
通过TCMSP数据库检索获得143种黄芩活性成分,以OB≥30%和DL≥0.18为条件筛选出36种化合物。其中两种化合物在PubChem数据库无相关结构信息。使用SwissTargetPrediction进行靶点预测后,一种化合物没有预测到靶点。最终确定了33种化合物的210个潜在作用靶点,相关信息见表1。
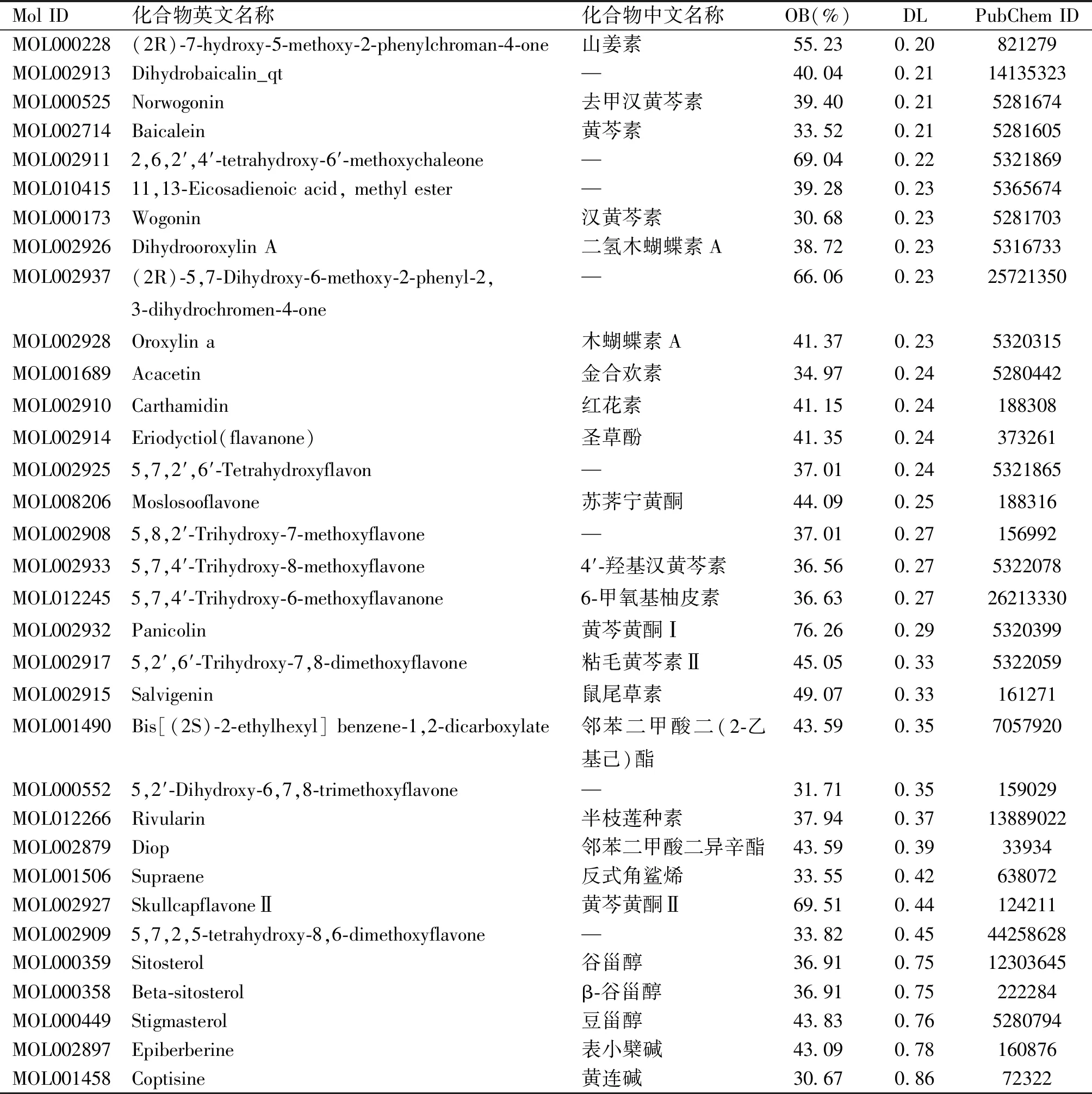
表1 黄芩有效成分的药代动力学特征
33种化合物的210个潜在作用靶点及其912条连接组成了化合物-作用靶点网络。210个作用靶点中,133个靶点被2个以上药物作用,27个靶点被10个以上药物作用。在这27个基因中,有10个基因也是PCa的靶点,包括KIT、ESR2、CYP19A1、MCL1、TERT、ABCG2、PTGS2、CYP1B1、ABCB1和ESR1。ABCG2(Degree=23)、CYP1B1(Degree=23)和ADORA1(Degree=22)3个化合物被20多个化合物作用,其中ABCG2和CYP1B1也是PCa的靶基因。
二、共同靶点的PPI网络
黄芩和PCa有57个共同靶点,将它们导入STRING进行PPI分析。如图2所示,该PPI网络由49个节点和157条边组成。Degree排名前4的靶点包括丝氨酸/苏氨酸激酶1(serine/threonine kinase 1, AKT1)(Degree=21)、雄激素受体(androgen receptor, AR)(Degree=16)、Src酪氨酸激酶(tyrosine kinase Src, SRC)(Degree=16)和表皮生长因子受体(epidermal growth factor receptor, EGFR)(Degree=16)。
三、化合物-治疗靶点网络
生成PPI网络后,分别选择前15个靶点和前24个靶点来构建化合物-治疗靶点网络。如图3、4所示,黄芩素、表小檗碱、木蝴蝶素A和汉黄芩素连接的靶点最多。

注:圆圈代表靶点;线段代表靶点间存在相互作用;圆圈大小及颜色代表靶点参与相互作用的数量图2 黄芩与PCa共同靶点的PPI网络

注:Wogonin-汉黄芩素;Oroxylin a-木蝴蝶素A;Epiberberine-表小檗碱;Baicalein-黄芩素图3 使用PPI网络中参与度排名前15个靶点构建的化合物-治疗靶点网络
四、富集分析
我们将共同的57个基因导入DAVID网站进行富集分析。GO分析中,得到P值<0.05的1 081条BP通路,31条CC通路,108条MF通路。KEGG分析中,60条P值<0.05的通路被富集。图5中展示了GO-BP和KEGG分析的前15条通路。
从GO-BP分析的结果来看,代谢过程、细胞死亡、细胞凋亡、细胞周期等生物学过程都与黄芩的抗肿瘤机制密切相关。KEGG富集的结果表明,大多数靶基因主要作用在物质代谢或信号通路,如图5所示的癌症中的通路、癌症中的蛋白多糖、病灶黏附等途径。包括PI3K-AKT、Ras相关蛋白1(Rap1)和血管内皮生长因子(vascular endothelial growth factor, VEGF)在内的信号通路也与黄芩抗肿瘤效应密切相关。

A:GO-BP富集分析的前15个结果;B:KEGG富集分析的前15个结果图5 黄芩与PCa共同靶点富集分析
讨 论
PCa是男性常见的恶性肿瘤,对ADT的抵抗可导致预后不良。黄芩,作为一种中草药,其成分在多项研究中发现具有抗PCa的作用[14-15]。然而,由于中药的多成分和多靶点特性,其抗PCa作用背后的综合机制仍难以明确。
本研究中,我们利用网络药理学方法来研究黄芩对PCa的作用机制。经过对化合物靶点和PCa相关靶点的筛选,发现了57个重叠的靶基因。在PPI网络中,有几个靶点表现出在抗PCa机制中的核心作用,包括AKT1、AR、SRC和EGFR。AKT1作为AKT蛋白激酶的一种同工酶,是包括PCa和乳腺癌在内的许多癌症的重要因子[16]。此外,AKT1激活突变在CRPC中比较常见,可能是一个有效的治疗靶点[17]。AR是PCa发展的关键因子,降低雄激素的ADT是晚期PCa的一线治疗方法[4]。即使发展至CRPC,AR及其剪接异构体如AR-V7仍在肿瘤进展中发挥重要作用[18]。SRC是非受体蛋白酪氨酸激酶家族的典型分子,该家族调节着细胞周期、肿瘤进展、迁移、增殖、分化和细胞生存等重要生物学过程[19],其激活突变在结肠癌和PCa在内的诸多癌症的进展中起着关键作用[20-21]。EGFR是一种跨膜受体,其功能失调与包括PCa在内的肿瘤生成过程相关[22]。EGFR的过表达也被认为促进了PCa的骨转移[23]。
本研究筛选了PPI网络中的重要基因来构建化合物-治疗靶点网络,以确定黄芩的潜在主要活性化合物。如图3和图4所示,黄芩素、表小檗碱、木蝴蝶素A和汉黄芩素连接了最多的靶点,表明这些化合物可能是黄芩治疗PCa的最关键成分。黄芩素已被证明在多种肿瘤中有抗癌效果,包括肺癌、乳腺癌、肝细胞癌和PCa等[24-25]。值得注意的是,AKT激酶和AR信号转导密切参与了黄芩素抗癌作用的机制,这与本研究的分析一致[24,26]。表小檗碱具有调节脂质代谢的作用[27],其抗肿瘤作用也有报道[28]。木蝴蝶素A在结直肠癌[29]和食道鳞状细胞癌中显示出抗癌作用[30],且能够抑制口腔鳞状细胞癌的转移[31]。多项研究表明汉黄芩素能明显抑制不同肿瘤的发展[32],在PCa细胞中也具有抗肿瘤作用[33]。

图4 使用PPI网络中参与度排名前24个靶点构建的化合物-治疗靶点网络
KEGG富集分析揭示了参与黄芩抗癌机制的几个潜在信号通路,包括PI3K-AKT通路、Rap1信号通路和VEGF信号通路。PI3K-AKT信号通路在PCa中有至关重要的作用。它不仅参与PCa细胞的凋亡和增殖,而且还促进PCa的进展和对ADT的耐药[34]。研究显示,抑制PI3K-AKT通路可以逆转其对ADT的耐药性,为CRPC患者提供更佳的肿瘤控制效果[35-36]。此外,PI3K-AKT和AR也被报道有交叉调节作用,对AR通路的抑制可以导致PI3K-AKT通路的激活[37],对AR和AKT的多重靶向可能是治疗CRPC的可行策略[38]。这些证据说明AKT1和AR是PCa的重要靶点,也是黄芩抗肿瘤作用的关键靶点。
Rap1是Ras家族小G蛋白的一员,调节着参与肿瘤形成的若干信号途径。研究表明,Rap1的激活增加了PCa细胞的迁移和侵袭,将激活的Rap1引入到PCa细胞中,显著提高了PCa在异种移植小鼠模型中的转移率[39]。抑制Rap1的活性则可以抑制PCa细胞的黏附和侵袭[40]。
VEGF的过度表达可以诱导血管生成,而血管生成是PCa肿瘤发生、增殖和进展的重要基础。一些针对VEGF途径的药物已经使PCa患者获益[41]。雄激素也可以提高VEGF的表达,AR和VEGF的相互作用是PCa血管生成的机制之一[42]。值得一提的是,SRC也可以调节VEGF的表达并影响血管生成[43]。
本研究中,我们从黄芩中获得了33种活性成分,并预测了210个潜在的靶点,这表明黄芩是一种由多种成分组成的复杂药剂,并且可以靶向众多靶点。网络分析显示,黄芩可能通过调节包括AKT1、AR、SRC和EGFR在内的多个靶点对PCa发挥药理作用。分析还表明,黄芩素、表小檗碱、木蝴蝶素A和汉黄芩素可能是黄芩治疗PCa的主要活性成分。GO分析表明,黄芩主要通过影响细胞代谢过程、细胞死亡、细胞凋亡和细胞周期等生物学过程来实现对PCa的治疗。KEGG富集表明,包括PI3K-AKT信号通路、Rap1信号通路和VEGF信号通路在内的信号通路可能与黄芩的抗PCa机制有关。在下一步研究中,还需要进行更多的实验来验证本研究的发现。
