良性前列腺梗阻评估方法的探讨
2022-01-26宋芳陈忠
宋芳 陈忠
由于前列腺组织学增生导致前列腺体积(prostate volume, PV)和形态发生改变,继而造成膀胱出口梗阻(bladder outlet obstruction, BOO),称之为良性前列腺梗阻(benign prostatic obstruction, BPO)。BPO导致夜尿增多、尿频及排尿困难等一系列下尿路症状(lower urinary tract symptoms, LUTS),形成临床上常见的良性前列腺增生症(benign prostatic hyperplasia, BPH)。BPH是一种进展性疾病,若不能及时有效解除BPO,可能会诱发感染、结石、血尿和尿潴留等并发症,甚至导致膀胱功能不可逆的损伤,进而影响肾功能。传统上,前列腺大小被认为是影响前列腺肥大(benign prostatic enlargement, BPE)患者排尿症状和手术风险的重要因素之一。然而,BPE并不总是与LUTS及BPO的严重程度相关。尿动力学检查可以有效评价BPO的程度以及膀胱功能状态,但作为一种侵入性的有创检查,限制了其广泛使用。临床上亟需一种简单可行的非侵入性检查方法,准确判断BPO及其严重程度,以指导治疗。
一、前列腺组织形态学特征对BPO的影响
PV与尿路梗阻有一定的正相关性,但大体积前列腺不一定会导致严重梗阻,有一些研究旨在确定LUTS的程度是否与其他前列腺解剖因素如移行区体积(transitional zone volume, TZV)、膀胱内前列腺突出度(intravesical prostate protrusion, IPP)的存在和程度以及前列腺尿道角(prostatic urethral angle, PUA)有关[1]。近来,也有研究认为前列腺尿道长度(prostatic urethral length, PUL)与LUTS的程度有关[2]。虽然研究表明这些解剖因素与LUTS的程度有显著的相关性,但其相关程度尚未达成共识。
1.假定圆面积之比(presumed circle area ratio, PCAR):Watanabe[3]于1998年首次提出了PCAR的概念,PCAR即为前列腺最大轴向切面面积与切面周长相等的假定圆面积的比值,其反映出BPH对尿道的压迫程度(图1)。PCAR的概念不包括前列腺的大小(体积)因素,这个理论认为BPH对下尿路功能的影响并不取决于大小,而是取决于形状。在前列腺实质表面包裹着薄而坚韧的固有膜,与前列腺鞘之间有静脉丛、动脉和神经的分支[4],前列腺鞘即为包裹前列腺的盆脏筋膜,它向下与盆膈上筋膜相移行,向上与包裹膀胱的膀胱筋膜相移行。

S:最大轴向MRI前列腺切面面积;L:最大轴向MRI前列腺切面周长;S′:周长等于S的周长的假定圆的面积图1 PCAR图
年轻男性前列腺呈栗形,随着年龄的增长,围绕尿道周围的移行区前列腺组织增生,局部体积增大,形成腺瘤。新生的腺瘤将前列腺外周区推向外侧的前列腺固有膜。而固有膜弹性有限,不能延展,会形成将外周区推向尿道方向的反向力,两个相向而行的合力压迫前列腺外周区正常的前列腺组织,形成“假囊”,即临床可见的前列腺外科包膜,与前列腺固有膜、前列腺表层筋膜一起组成前列腺包膜。因受到前列腺包膜的限制,增生的前列腺组织不能向前列腺周围间隙扩展,导致前列腺内组织密度增加,静态压升高,压力均匀地延伸到腺体的周长,整个前列腺的形状逐渐向圆形演变。增生组织造成的静态压力越大,前列腺形状就越圆,当前列腺包膜达到一个不能再拉伸的程度时,前列腺的形状更接近一个圆。根据帕斯卡原理,传递到前列腺包膜的压力同样会穿透前列腺组织延伸至尿道周围,导致尿路梗阻。正常前列腺的PCAR值在0.6左右,而BPH的PCAR值在0.75以上,随着BPH的进展,PCAR值接近1.0。
按照PCAR理论,前列腺组织及包膜的物理特性也参与前列腺对尿道的压迫。当尿液通过尿道时,有一定弹性可伸缩前列腺组织及包膜的患者不会出现尿路梗阻。从前列腺的大体形态上可以观察到随着移行区的增长,外周区变得更薄,前列腺形态接近于球形的患者梗阻症状更重。
2.前列腺移行区:BPH主要是尿道周围的移行区组织学增生,体积增大。移行区在前列腺中所占比例往往能体现出前列腺梗阻的存在或严重程度。Tian等[5]评估了397例BPH患者的临床特征,发现PV、TZV与国际前列腺症状评分(international prostate symptom score, IPSS)、生活质量评分(quality of life, QoL)无相关性,但移行区指数(transitional zone index, TZI)、移行区厚度(transitional zone thickness, TZT)与最大尿流率(maximum flow rate, Qmax)呈极显著相关。该作者基于PCAR理论,首次提出依据经直肠超声检测而来的外周区至移行区指数(peripheral to transitional zone index, PTI)的概念,即外周区厚度(peripheral zone thickness, PZT)与TZT比值(图2),PTI=PZT/TZT。PTI的计算同时考虑了移行区和外周区,其研究结果表明,PTI与总IPSS(r=-0.113,P=0.024)、储尿期IPSS(r=-0.103,P=0.041)和排尿期IPSS(r=-0.123,P=0.014)呈负相关,与患者Qmax呈显著正相关,表明PTI是一个潜在优于TZV、TZI(仅与Qmax呈负相关)和PZT(仅与总IPSS呈负相关)的参数,能反映出前列腺腺体对尿道压迫导致梗阻的趋势和程度。Tian等认为PTI在评估和管理男性LUTS/BPH上具有一定价值,但需要设计良好的临床研究进一步验证其临床效应。
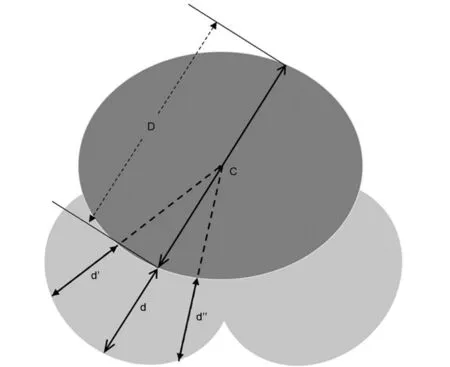
PZT(d)定义为PZT穿过外周区的最大距离(d>d′和d>d″);TZT(d)定义为PZT反向延伸线穿过移行区的距离;C:移行区中心;D同d图2 PZT和TZT测量示意图
3.前列腺尿道特征:Ko等[2]认为BPO是由于BPH造成的前列腺尿道结构变化所致,并非因为PV增大。其分析了293例患者的7项B超特征,如TV、TZV、TZI、IPP、PUA、PUL和PUL与PV比值(PUL-to-volume ratio, rPUL),发现仅有rPUL与IPSS评分相关。Kim等[6]分析了679例40岁以上有LUTS和BPH的男性,使用Logistic回归分析来确定与手术风险相关的因素,结果发现PUL、移行区尿道长度(transitional zone urethral length, TZUL)与手术风险独立相关,年龄、PSA、Qmax、残余尿(post-voiding residual, PVR)及测得的其他解剖学指标均与手术风险无关。在所有调查对象中,手术组和非手术组的PUL和TZUL差异有统计学意义,PUL和TZUL的最佳临界值分别为4.53 cm(灵敏度:83.3%,特异性:61.6%)和3.35 cm(灵敏度:83.3%,特异性:77.9%)。
PUA为前列腺尿道近端与前列腺尿道远端所形成的角度(图3)。Hou等[7]报道男性LUTS患者PUA与Qmax、IPSS的相关性,并发现PUA与坦索罗辛疗效呈负相关,提示PUA是α受体阻滞剂疗效的一个预测因子。

图3 测量前列腺PUA的超声图像
4.IPP:IPP为膀胱腔内前列腺突起尖端到膀胱颈部的距离(图4)。IPP反映的是前列腺侧叶和中叶增生导致的形态学改变,很容易通过经直肠前列腺超声(transrectal ultrasonography, TRUS)或MRI测定。自Chia等[8]和Tan等[9]于2003年提出IPP作为对BOO的预测参数以来,许多学者研究了IPP在BPH患者中的意义。IPP值高的患者,排尿时球状的前列腺中叶有可能像“球阀”一样,堵塞尿道内口。Yoshida等[10]报道经度他雄胺治疗的BPH患者,其较高的IPP值与治疗效果差、急性尿潴留或需要接受前列腺手术的高风险密切相关,提示度他雄胺治疗并不能减少IPP值。

图4 测量前列腺IPP的MRI图像
二、膀胱的形态
BPH会导致BOO,为克服梗阻,早期膀胱处于代偿状态,导致膀胱血供、厚度或形态发生一定改变;如梗阻长期不解决,会造成膀胱形态永久性改变,需要重视和及时处理。
1.膀胱壁厚度(bladder wall thickness, BWT):长期的膀胱代偿、强化收缩,会导致膀胱逼尿肌层及膀胱壁增厚。Reddy等[11]将超声导出来的参数如PV、BWT、PVR和IPP以及尿流率等,以尿动力学检查压力-流率测定结果为参照,结果发现PV、BWT和PVR联合IPP是BPH引起的临床显著性BOO的良好预测因子。Park等[12]也认为BWT和逼尿肌厚度与70岁或70岁以上男性的BOO相关,BWT和逼尿肌厚度是决定老年男性症状性BPH治疗策略的无创性参数。
2.膀胱小梁:膀胱小梁的形成是逼尿肌不均匀增厚的一种形态学表现,表现为膀胱出口长期梗阻引起逼尿肌退行性变,是胶原纤维增生的结果,也是膀胱代偿性增生的信号。el Din等[13]通过膀胱镜观察膀胱小梁,并与尿流动力学检查结果进行比较,按膀胱镜下膀胱小梁的特点将小梁严重程度分为5级,认为BPH患者膀胱小梁化程度预示着最终治疗结果的好坏,前列腺梗阻程度越严重,小梁改变越明显;随着小梁程度的加重,Qmax时逼尿肌压力、线性被动尿道阻力关系梗阻程度增加。陈山等[14]探讨B超检测BPH患者的膀胱小梁在判断BOO程度及膀胱功能状态中的作用,结果发现膀胱小梁形成提示存在BOO,且上尿路积水风险亦增大;对于没有尿潴留的患者,膀胱小梁形成提示膀胱功能尚处于代偿期,此时及时解除梗阻,有利于膀胱功能恢复,减少并发症的发生。继发于BPO的膀胱小梁是否为不可逆的改变,梗阻解除后小梁化的程度是否会减轻甚至消失,还需要更多更系统的临床研究方有结论。
3.膀胱壁血红蛋白的变化:近红外光谱(near infrared spectroscopy, NIRS)是介于可见光和中红外光之间的电磁辐射波,可以利用生物体中不同组织对近红外光具有不同的散射和吸收特性,以区分不同的软组织和变化的组织特性。NIRS可以通过检测膀胱壁血液中氧血红蛋白和脱氧血红蛋白浓度变化,监测膀胱组织血供氧情况及血液动力学改变。Farag等[15]采用NIRS方法,测定排尿时膀胱壁血液中氧血红蛋白、脱氧血红蛋白和总血红蛋白的振幅以判断是否存在BOO,发现BOO患者NIRS参数脱氧血红蛋白明显高于非BOO患者,并认为是由于有BOO的存在,排尿期需要更有力的逼尿肌收缩以克服BOO,引起膀胱对氧摄取增加所致。其采用递归分区分析法分析NIRS结合其他的非侵入性参数,如PV、IPSS、PVR、Qmax能明显增加预测BOO的概率。
三、尿液神经生长因子表达
患者的症状和膀胱、前列腺的形态学特征能提示梗阻的可能,但不能肯定梗阻的存在,临床上还需要寻找一些特异性指标加以判断。BOO早期会导致膀胱代偿性收缩,膀胱内压升高,膀胱壁血管受压闭塞造成膀胱壁组织缺血、缺氧,导致膀胱代谢异常,一些蛋白分子分泌入尿液中,对尿液进行液体活检有可能为我们早期诊断BOO提供一定线索。神经生长因子(nerve growth factor, NGF)在保持许多器官的自主神经支配中起到重要作用,是人类发现的第一个多肽生长因子。膀胱内压升高加重了膀胱壁间神经节的缺血性损害,导致膀胱壁的去神经病变,NGF分泌增多。Kudo等[16]报道了鼠部分尿道梗阻后膀胱NGF在梗阻后1 d上升水平是正常的5倍,梗阻后2周逐渐降低,但不能恢复到正常水平,解除梗阻后,NGF在1~6周逐渐恢复正常。Shi等[17]报道鼠BOO模型在BOO达到6周后,尿液中转化生长因子-β1明显升高,并伴有膀胱收缩力减弱。有关尿液蛋白组学与BPO的关系研究多为动物实验研究,临床应用还需要更多的临床试验方有结论。Hu等[18]报道了尿液中NGF与尿肌酐(Cr)的比值(NGF/Cr)在尿动力学检查提示Ⅲ/Ⅳ度Ⅴ/Ⅵ BOO的患者中表达无差异,但伴有膀胱过度活动症(over active bladder,OAB)的患者NGF/Cr明显增高,并与OAB的程度呈正相关,经尿道前列腺电切术术后1年,NGF/Cr明显下降。Wang等[19]报道具有中、重度LUTS症状的BPH患者,尿液中脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)与Cr比值明显升高,重度症状的患者该值又比中度症状患者高,经尿动力学检查伴有逼尿肌过度活动(detrusor overactivity, DO)的BPH患者尿液中BDNF值更高,因此认为尿液中BDNF水平能够评价BPH患者症状的严重程度,并可以作为BPH患者伴有DO的生物标志物。
四、综合性指标的评判
尿动力学检查是一项有创检查,并有一定的并发症发生,有学者尝试将一些关键临床指标按统计学分析绘制成预测男性LUTS/BPH患者BOO的列线图模型,用于判断BPO存在的几率。王斌等[20]通过回顾性分析LUTS/BPH患者的压力-流率测定相关参数及Qmax、PV、TZV、TZI、PSA、PVR等指标,选定Qmax、PV、PSA作为BOO的独立预测因子,制作预测男性LUTS/BPH患者BOO的列线图模型,其准确性达85.4%。
虽然相当多的中老年男性会表现为前列腺组织增生和体积增大,但PV增大不一定会造成BPO并导致LUTS,LUTS也并非都是由BPO所致。通过分析上述前列腺和膀胱形态学特征,检测患者尿液中蛋白组份,可以采用无创的技术手段,反复多次检测,结合病史判断患者是否存在BPO,以及保守治疗BPO的疗效,帮助患者选择合理的治疗方式及时机。对保守治疗效果不好,或存在能预测保守治疗疗效差的前列腺解剖特征的患者,及早采取外科干预措施,有效解除梗阻,更能改善患者LUTS症状,保护膀胱功能。
