基于网络药理学探究黄芪-白术药对治疗骨质疏松性骨折的作用机制
2022-01-25毛银枫崔松香华臻彭竑程王建伟
毛银枫,崔松香,华臻,彭竑程,王建伟
(1.南京中医药大学研究生院,江苏 南京210023;2.南京中医药大学无锡附属医院骨伤科,江苏 无锡 214072)
骨质疏松症是一种以骨量低和骨组织的微细结构退化为特征的全身骨骼疾病,研究显示,我国骨质疏松的患病率为6.6%~19.3%[1]。骨质疏松性骨折(osteoporotic fracture,OPF)是由骨质疏松症导致的骨折,常见于55岁以上的女性和 60岁以上男性,易导致大量与骨骼相关的疾病,并增加患者死亡率和医疗费用[2]。中医药防治OPF具有独特优势[3-4],从脾论治已广泛应用于临床,但缺少确切机制研究以阐明其科学性。本研究选取健脾的常用药对黄芪-白术作为研究对象,探讨其治疗OPF的可能作用机制。
1 材料与方法
1.1 筛选黄芪-白术药对活性成分
使用TCMSP数据库[5](https://tcmspw.com/tcmsp.php),分别以“黄芪”“白术”为检索词,检索药对的全部活性成分数据,以口服生物利用度(oral bioavailability,OB)≥30%,类药性(drug likeness,DL)≥0.18为筛选条件[6],筛选出药对活性成分及其对应靶点。
1.2 筛选OPF疾病靶点
分别检索GeneCards(https://www.genecards.org/),OMIM(http://www.omim.org/),TTD(http://bidd.nus.edu.sg/group/cjttd/)数据库,检索词为“osteoporotic fracture”,合并后删除重复条目,以获得目前已知的与OPF相关的人类靶点。
1.3 构建蛋白质相互作用(PPI)网络及筛选关键靶点
应用R语言筛选药对靶点和OPF靶点的交集,使用String数据库(https://string-db.org/)上传交集靶点,并进一步筛选关键靶点。
1.4 构建药对-有效成分-靶点-疾病网络
使用Cytoscape 3.7.1,将筛选的靶点导入软件,绘制药对有效成分作用于OPF相关靶点的网络关系图。
1.5 富集分析
利用DAVID数据库(https://david.ncifcrf.gov/)进一步分析关键靶点蛋白在基因功能中的作用,对关键靶点进行GO生物学过程与KEGG代谢通路富集分析,并将富集分析结果以气泡图的形式展示。其中,不同类型富集结果以不同颜色节点表示,气泡大小表示富集程度是否显著。以P<0.05为差异有统计学意义[7]。
1.6 分子对接验证
取“药对-活性成分-靶点-OPF”网络度值排名前6的活性成分及PPI网络度值排名前5的靶点蛋白进行分子对接验证。大蛋白受体3D结构从PDB数据库下载,小分子配体从TCMSP数据库获得,然后使用PyMOL软件对关键靶点蛋白进行去水、加氢等操作,分子对接通过AutoDockTools 1.5.6、AutoDock Vina软件实现,结合能记录在Excel表格中。
2 结果
2.1 筛选药物成分及其靶点
通过TCMSP数据库筛选黄芪-白术所有成分68个,以OB≥30%,DL≥0.18为筛选条件,共筛选出有效成分19个,主要为葡萄糖苷、常春藤素、异鼠李素、槲皮素、芒柄花素、山奈酚等,相对应的作用靶点176个,主要为前列腺素内过氧化物合酶2、前列腺素内过氧化物合酶1、诱导型氧化亚氮合酶、转录因子AP-1(JUN)、丝氨酸/苏氨酸蛋白激酶1(AKT1)等。
2.2 筛选OPF相关靶点
通过检索GeneCards、OMIM、TTD数据库,检出OPF已知的人类相关靶点分别为2 903个、64个、0个,合并、删除重复数据后,共纳入2 953个OPF相关靶点。
2.3 构建PPI网络及分析
运用R语言VennDiagram数据包筛选出黄芪-白术药对有效成分对应的靶点和OPF相关靶点的交集靶点,由此筛选出115个交集核心靶点。将靶点导入String数据库平台预测蛋白相互作用关系,结果以TSV格式导出,进一步使用Cytoscape 3.7.1软件进行分析,导入交集核心靶点,分析靶点之间相互的作用关系,大于等于度值中位数2倍(14)的节点即为核心靶基因,最后得到24个核心靶基因,分别为肿瘤坏死蛋白P53(TP53)、丝裂原活化蛋白激酶1(mitogen-activated protein kinase-1,MAPK1)、肿瘤坏死因子(tumor necrosis factor,TNF)、丝裂原活化蛋白激酶14(MAPK14)、白细胞介素-6(IL-6)等,提示其可能是黄芪-白术治疗OPF的关键靶点。
2.4 构建药对-有效成分-靶点-疾病网络
借助DAVID数据库对黄芪-白术药对中对OPF有治疗作用的潜在靶点进行GO富集分析,使用Cytoscape 3.7.1导入19个活性成分、115个交集靶点、药对和OPF,构建药对-有效成分-靶点-疾病网络(图1)。图中蓝色代表共同靶点,橙色代表药对活性成分,连线分别表示相互作用关系,与靶点连接较多的活性成分主要有槲皮素(quercetin)、山奈酚(kaempferol)、刺芒柄花素(formononetin)、7-O-甲基-异微凸剑叶莎醇(7-O-methylisomucronulatol)、异鼠李素(isorhamnetin)、毛蕊异黄酮(calycosin)等。
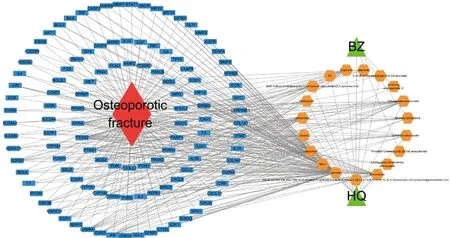
图1 药对-有效成分-靶点-疾病网络
2.5 富集分析
借助DAVID数据库对黄芪-白术药对中对OPF有治疗作用的潜在靶点进行GO富集分析,设定P值<0.05,共获得568条生物过程或通路,其中433个与生物过程相关、92个与分子功能相关、43个与细胞组分相关。选取P值较小的前20条GO条目,绘制气泡图(图2),靶点主要涉及DNA结合转录因子结合、RNA聚合酶Ⅱ特异性DNA结合转录因子、核受体激活、配体激活的转录因子活性细胞因子受体结合、细胞因子受体结合等生物过程。
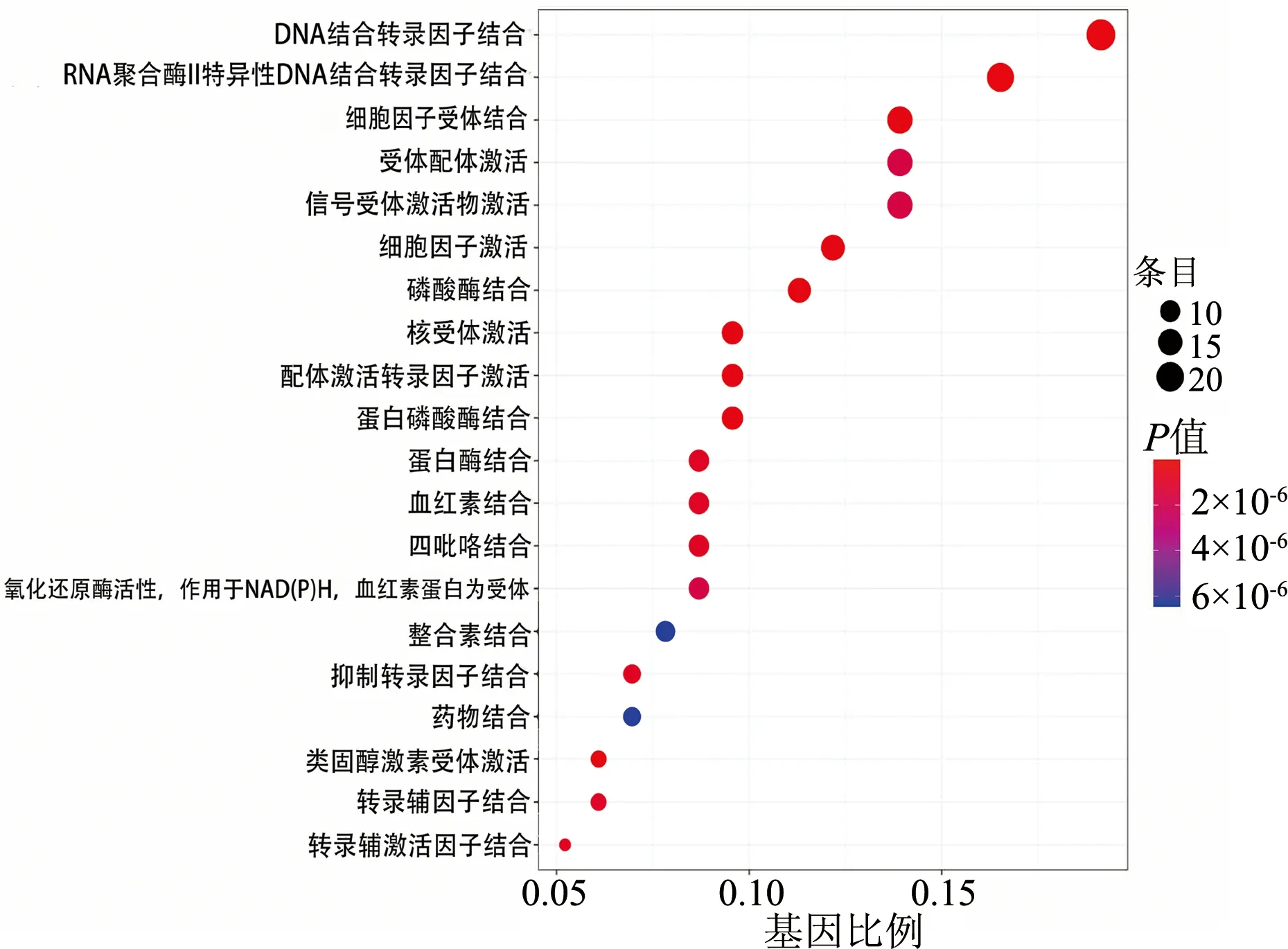
图2 GO功能富集分析气泡图
本研究KEGG分析共获得111条通路(P<0.05),选取P值较小的前20条通路,并进行可视化。黄芪-白术OPF核心基因的KEGG通路主要涉及的信号通路见图3。
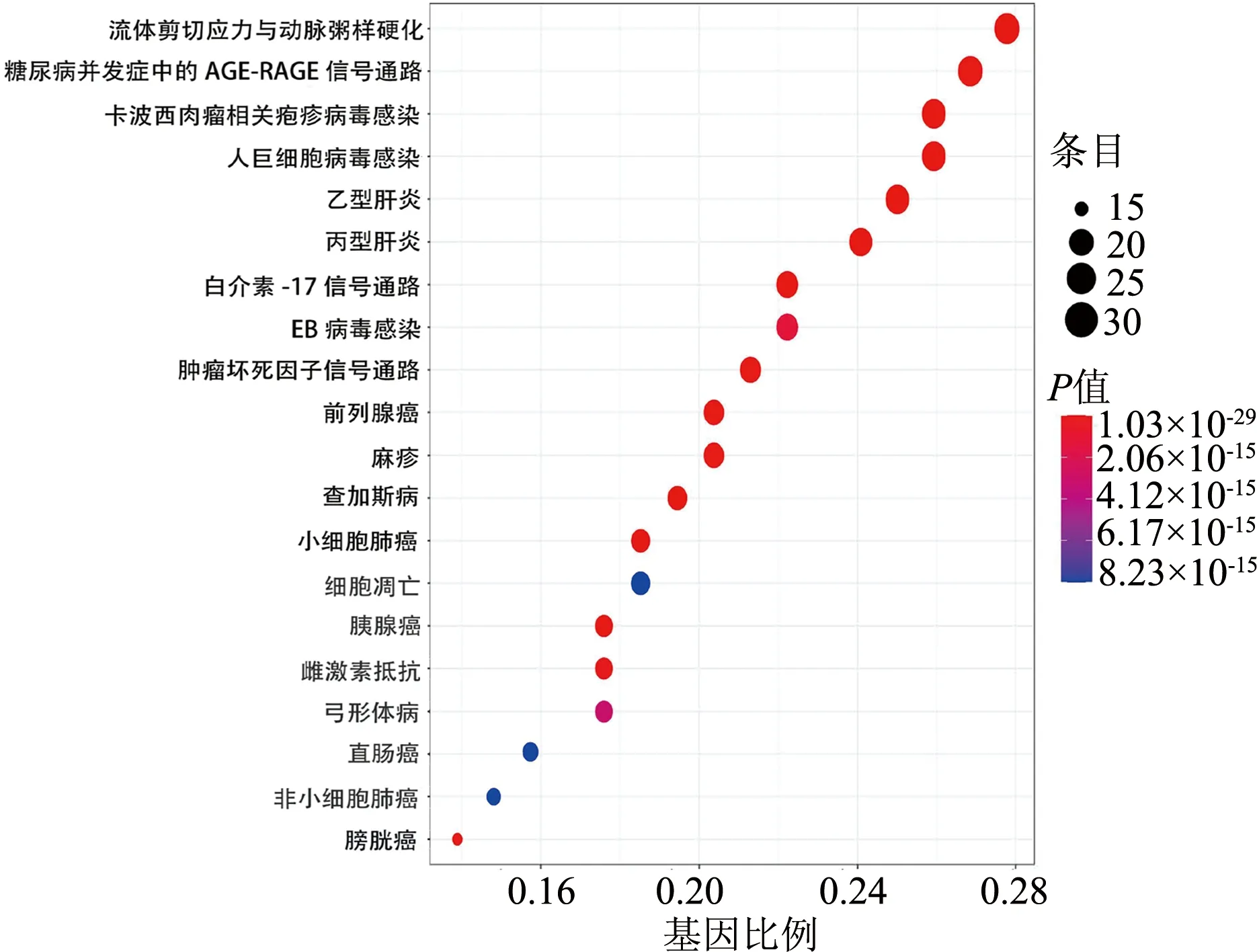
图3 KEGG通路富集分析气泡图
2.6 分子对接验证
将PPI网络中度值排名前5的靶点蛋白(JUN、AKT1、TP53、MAPK1、RELA)分别与“药对-活性成分-关键靶点-OPF”网络中排名前6的活性成分(quercetin、kaempferol、formononetin、7-O-methylisomucronulatol、isorhamnetin、calycosin)进行分子对接(图4)。对接评分越低,配体与受体结合性越好,其中对接评分<-4.25 kcal/mol可认为配体与靶点之间具有结合活性,评分<-5.0 kcal/mol表明结合活性较好,评分<-7.0 kcal/mol表明两者之间有强烈的对接活性。黄芪-白术药对中的关键活性成分与OPF核心靶点对接能量均<-6.0 kJ/mol,表明黄芪-白术药对活性成分能较好地与OPF相关靶点结合,潜在生物活性高。取其中对接结果较好的quercetin与MAPK1(结合能-9.1 kcal/mol)、calycosin与MAPK1(结合能-9.0 kcal/mol)、calycosin与RELA(结合能-8.9 kcal/mol)、isorhamnetin与MAPK1(结合能-8.9 kcal/mol)进行对接结果可视化,以探究受体蛋白与配体小分子之间的结合模式(图5)。
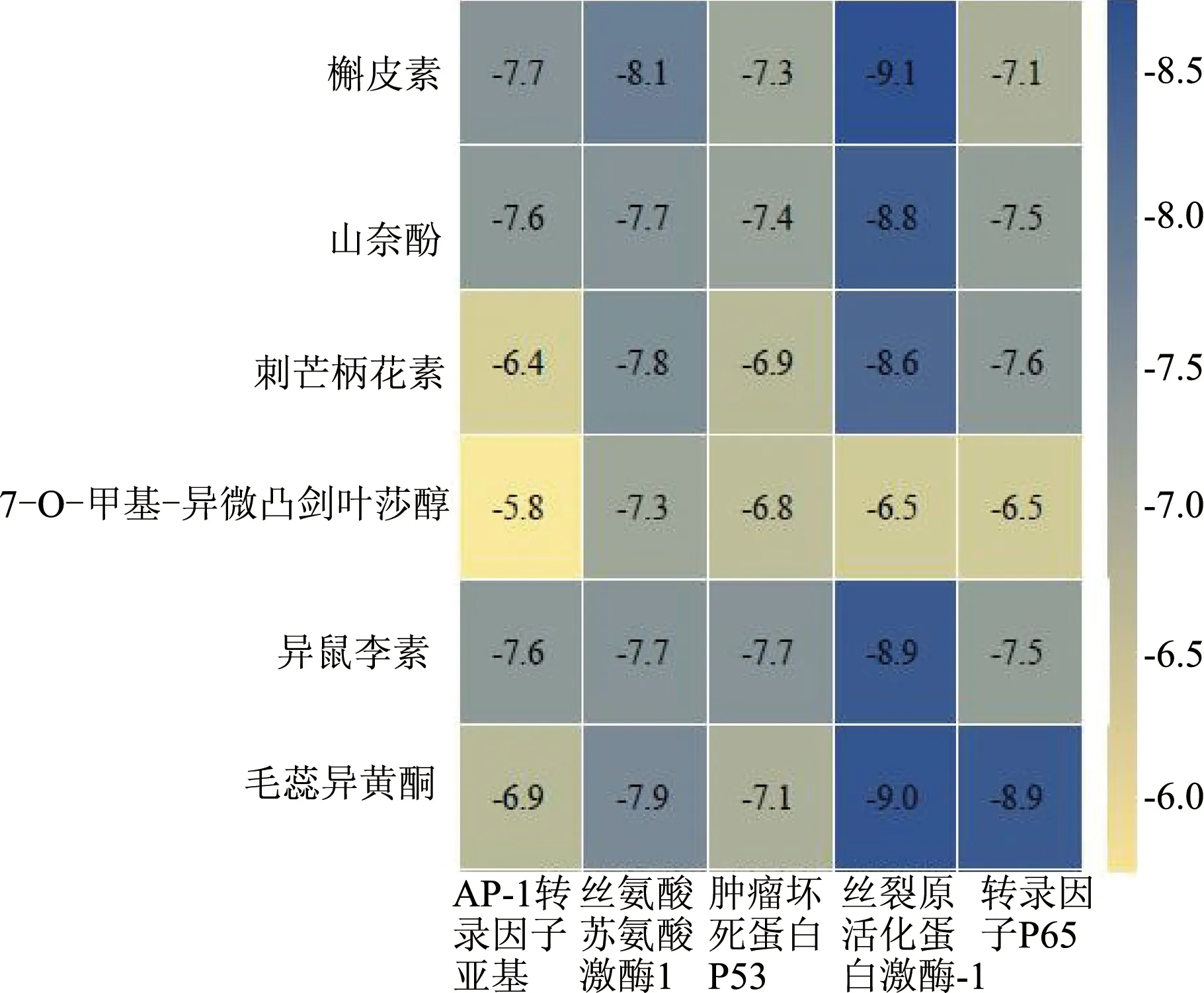
图4 分子对接结合能热图(kcal/mol)
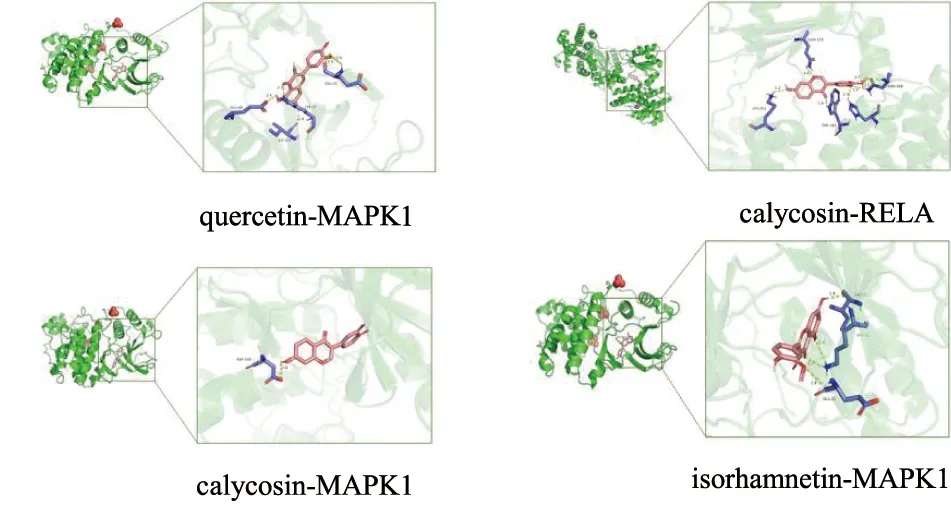
图5 关键成分与核心靶点之间的对接构象
3 讨论
从中药-成分-疾病-靶点网络图中可以看出,黄芪-白术治疗OPF的活性成分以槲皮素、刺芒柄花素、山奈酚为主,AKT1、MAPK1、TNF、IL-6、MAPK14等为筛选出的核心靶点。槲皮素能抑制NF-κB受体活化因子配体(RANKL)介导的破骨细胞形成、成骨细胞凋亡、氧化应激和炎症反应,同时能够促进成骨、血管生成、抗氧化表达、脂肪细胞凋亡和破骨细胞凋亡,可能的潜在机制包括调控NF-κB等依赖的凋亡途径以及内源性和外源性的凋亡通路。另一方面,槲皮素能够在MAPK通路上发挥复杂的作用,从而协调骨代谢。研究表明槲皮素能够降低TNF-α、IL-6等促炎因子的表达,升高IL-10抗炎因子的表达,由此调控炎症反应,进而调控骨重塑[8]。综上,槲皮素对OPF的治疗是一个综合作用。刺芒柄花素是一种植物雌激素,表现出不同程度的雌激素受体激动性,能够显著增加成骨细胞中骨形态发生蛋白-2(BMP-2)的水平,同时增加Runt相关转录因子-2(Runx-2)的表达[9]。此外,刺芒柄花素能够显著抑制破骨细胞骨吸收相关的功能基因酒石酸盐酸性磷酸酶(TRAP),基质金属蛋白酶9(MMP9)和碳酸酐酶2(Car2)等表达[10]。山奈酚能够通过上调BMP-2的表达,使p38MAPK等磷酸化,同时使碱性磷酸酶(ALP)等高表达,从而促进成骨作用。山奈酚可能促进下游信号分子包括磷酸肌醇3-激酶(PI3K)/蛋白激酶B(PI3K/Akt)和MAPK的激活,促进雌激素受体信号的激活,由此抑制炎性细胞因子,诱导破骨细胞凋亡产生对OPF的治疗作用。此外,山奈酚还具有一定的抗炎作用,通过抑制NF-κB的核易位降低促炎因子的水平并提高抗炎因子的水平,从而对成骨细胞发挥抗炎作用,促进骨形成[11]。研究表明,健脾中药能够抑制RANKL生成,进而抑制骨吸收,同时促进骨保护素产生,干扰RANKL信号传导的同时促进骨形成[12]。
本研究结果表明,黄芪-白术的主要有效成分可通过多个靶点、多个信号通路影响OPF的发生。黄芪-白术治疗OPF的关键靶点主要是MAPK1、TNF、MAPK14、IL-6等,这些基因可通过影响DNA结合转录因子、RNA聚合酶Ⅱ特异性DNA结合转录因子、核受体活性、配体激活的转录因子活性等来调控OPF的发生,即主要影响细胞因子及细胞因子受体、转录因子等从分子水平上促进骨折愈合[13]。
黄芪-白术治疗OPF的核心基因的KEGG通路众多,TNF通过抑制成骨细胞分化来抑制骨形成。在TNF介导的炎症环境中,TNF刺激间充质干细胞诱导经典Notch信号的激活并抑制其向成骨细胞的分化。TNF能够增加破骨细胞骨吸收并且一定程度上减少成骨细胞骨形成[14]。NF-κB信号通路也能调节免疫应答,在炎症反应中发挥重要作用,是产生或抑制炎性因子的启动子,并能调控骨重塑过程中的成骨细胞和破骨细胞[15-16]。研究表明,Toll样受体(Toll like receptor,TLR)信号通路也与炎症反应密切相关。其中TLR4在肌肉骨骼系统中表达,对调节其炎性环境发挥至关重要的作用,并且TLR4激活与破骨细胞生成因子聚集相关[17]。IL-17家族的细胞因子参与了很多疾病的发生发展,IL-17A在骨丢失中发挥重要作用,在绝经后骨质疏松动物模型中观察到抗IL-17A治疗能一定程度上减少骨丢失[18]。据此认为,黄芪-白术可能主要通过调控炎症反应等产生治疗OPF作用。此外,在骨修复和再生过程中,低氧诱导因子-1(hypoxia inducible factor,HIF-1)对血管生成和骨形成发挥关键作用,其中血管内皮生长因子是HIF-1下游最有力的血管生成因子,在促进血管生成中发挥重要作用,通过与血管内皮细胞特异性受体结合,促进内皮细胞增殖、迁移和管状形成,提高血管通透性,改变细胞外基质及增进单核细胞趋化性的方式促进血管生成[19]。
本研究利用网络药理学方法筛选出黄芪-白术19种活性成分及相关的176个潜在靶点,OPF疾病相关的2 953个靶点,其中交集靶点31个,对这31个靶点基因进行PPI分析,黄芪-白术可能通过调节MAPK1、TNF、MAPK14、IL-6等靶点治疗OPF,对这些靶点进行GO富集和KEGG富集分析,黄芪-白术可能调控TNF、NF-κB、HIF-1等信号通路,发挥调控炎症反应及成骨细胞和破骨细胞等作用来治疗OPF。因本研究所使用的数据完全基于现有的研究,旨在为实验研究探究可能的方向,所以其具体作用机制还需要进一步实验验证。
