钙敏感受体在3,3′-二吲哚甲烷抑制肝癌细胞增殖与迁移侵袭中的作用
2022-01-25徐伟杨奇陆定坤肖钊姜袁越何大伟孙俊顾杰叶洋陆荣柱
徐伟,杨奇,陆定坤,肖钊,姜袁越,4 何大伟,孙俊,顾杰,叶洋,陆荣柱,
(1.江苏大学医学院,江苏 镇江 212013;2.南京中医药大学附属盐城市中医院病理科,江苏 盐城 224001;3.镇江市中西医结合医院病理科,江苏 镇江 212000;4.昆山市中医医院病理科,江苏 苏州 215300;5.昆山市第一人民医院临床实验研究中心,江苏 苏州 215300;6.昆山市第一人民医院肝胆外科,江苏 苏州 215300;7.江苏大学生命科学学院,江苏 镇江 212013)
钙敏感受体(calcium-sensing receptor,CaSR)是G蛋白偶联受体C家族成员,在维持机体钙稳态中发挥重要作用[1]。研究表明,CaSR广泛表达于各种类型的组织细胞中,参与调控细胞增殖、分化、凋亡及衰老过程[2-3]。CaSR在前列腺癌[4]、乳腺癌[5]、甲状旁腺癌[6]和结直肠癌[7]中的作用已被证实,此外,有研究发现肝癌易感性与CaSR变异高水平表达密切相关[8],但其在肝癌发生发展中的病理生理意义仍不明了。
近年研究发现,来源于十字花科蔬菜的天然成分3,3′-二吲哚甲烷(3,3′-diindolylmethane,DIM)可以抑制肝癌细胞增殖、迁移和侵袭[9]。本课题组前期研究显示,在肝癌HepG2、SMMC-7721细胞中,DIM可以通过升高细胞内Ca2+浓度,抑制细胞增殖、促进细胞凋亡从而达到抗肝癌效果[10]。因CaSR作为维持细胞内外钙稳态的重要参与者,其在DIM抗肝癌效应中的作用值得探索。本研究在探讨DIM对肝癌细胞增殖、迁移及侵袭影响的基础上,评价DIM对肝癌细胞CaSR表达的影响,并选用CaSR激动剂氯化钆探讨CaSR对DIM抗癌效应的影响,为确定DIM的抗癌靶标提供线索。
1 材料与方法
1.1 细胞与试剂
人肝癌HepG2和SMMC-7721细胞株购自中科院上海细胞生物学研究所;DMEM高糖培养基(美国Hyclone公司);胎牛血清(美国Gibco公司);链霉素、青霉素混合液(上海碧云天生物技术公司);DIM、MTT、二甲基亚砜(DMSO)、氯化钆(美国Sigma公司);Transwell小室、Matrigel胶(美国BD公司);兔抗人CaSR抗体(美国Cell Signaling Technology公司);β-肌动蛋白、羊抗兔IgG(美国Santa Cruz公司);多聚甲醛、结晶紫染液、RIPA裂解液、BCA蛋白浓度测试试剂盒、一抗稀释液、SDS-PAGE分离胶试剂盒(上海碧云天生物技术公司)。
1.2 细胞培养
将人肝癌HepG2和SMMC-7721细胞从-80 ℃冰箱中取出,迅速在37 ℃水浴锅中完全溶解后移至培养皿,置于37 ℃、5% CO2培养箱中,用含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的高糖培养基培养,每天换液。待细胞密度达70%~80%时胰酶消化,以1∶2比例传代。
1.3 细胞分组及处理
取HepG2和SMMC-7721细胞以4 000个/孔接种于96孔培养板,以60 000个/孔接种于6孔培养板,待细胞融合度达70%~80%时,按以下分组进行实验。
细胞分为对照组和实验组,对照组用上述高糖培养基培养;实验组加入含有不同浓度(0、20、40、60、80 μmol/L)DIM的培养基,处理24 h后,分别检测细胞增殖活性、迁移侵袭能力及CaSR蛋白表达,从而筛选出合适的DIM浓度用于后续实验。
1.4 MTT法检测肝癌细胞增殖活性
取对数生长期细胞,按“1.3”方法处理后,接种于96孔培养板中,每组设6个复孔;弃去培养基,每孔加入100 μL MTT试剂和高糖培养基的混合液(0.05 g/mL),37 ℃避光孵育3~4 h;弃去培养基,每孔加入150 μL DMSO溶液,避光充分振荡混匀,490 nm波长检测光密度(D)值。
1.5 Transwell法检测肝癌细胞迁移能力
用不用浓度(0、20、40、60、80 μmol/L)DIM分别处理HepG2和SMMC-7721细胞24 h;将细胞以7 000个/孔加至Transwell小室中,下室加入600 μL含10%胎牛血清的培养基(不含抗生素),在37 ℃、5% CO2培养箱中培养24 h;取出小室,弃去其中液体,预冷PBS清洗2遍,用棉签轻轻擦拭以去除未迁移细胞;将小室置于4%多聚甲醛中固定30 min,预冷PBS清洗2遍;结晶紫避光染色15 min;显微镜下每孔随机选取至少6个视野,拍照计数。
1.6 Transwell法检测肝癌细胞侵袭能力
将20 μL Matrigel胶与100 μL 4 ℃预冷的无血清培养基混合,加至Transwell小室中,37 ℃孵育4 h使其干成胶状;0、20、40、60、80 μmol/L DIM处理HepG2和SMMC-7721细胞;将细胞以7 000个/孔加至Transwell小室中,下室加入600 μL含10%胎牛血清的培养基(不含抗生素),置于37 ℃、5% CO2培养箱中培养24 h,后续操作同“1.5”。
1.7 蛋白免疫印迹法检测CaSR蛋白表达
分别用0、20、40、60、80 μmol/L DIM处理HepG2和SMMC-7721细胞24 h;弃去培养基,预冷PBS清洗3遍,加入RIPA裂解液,冰上裂解细胞30 min以提取总蛋白,BCA法测定蛋白浓度,调整至相同蛋白浓度。制备8% SDS-PAGE分离胶,80 V电泳分离蛋白1.5 h;300 mA转90 min至PVDF膜;5%脱脂牛奶封闭2 h;分别加入CaSR一抗(1∶1 000)和β-肌动蛋白一抗(1∶10 000),4 ℃过夜;TBST清洗膜3次,每次5 min;二抗稀释液(1∶10 000)摇床室温孵育1 h;TBST清洗膜3次,每次5 min;显影,使用Image J软件计算条带灰度值。
1.8 氯化钆预处理对细胞CaSR表达、细胞增殖活性及迁移侵袭能力的影响
取对数生长期HepG2和SMMC-7721细胞进行实验,细胞分4组:对照组、60 μmol/L DIM组、300 μmol/L氯化钆组、氯化钆+DIM组。氯化钆+DIM组使用300 μmol/L氯化钆预处理30 min,弃去培养基,加入含60 μmol/L DIM和300 μmol/L氯化钆的培养液继续培养24 h。蛋白免疫印迹法检测CaSR蛋白表达、MTT法检测细胞增殖活性、Transwell法检测细胞迁移侵袭能力。
1.9 统计学分析
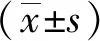
2 结果
2.1 DIM抑制肝癌细胞增殖
MTT结果显示,在HepG2细胞中,与对照组相比,60和80 μmol/L DIM处理组细胞活力明显降低(P<0.05)。在SMMC-7721细胞中,与对照组相比,40、60和80 μmol/L DIM组细胞活力明显降低(P<0.05);与40 μmol/L DIM组相比,60 μmol/L DIM组细胞活力下降更显著(P<0.05)。DIM抑制两株细胞活力呈现出浓度-效应依赖性,见图1。据以上结果,选择60 μmol/L DIM进行后续实验。

a:P<0.05,与对照组比较;b:P<0.05,与40 μmol/L DIM组比较;c:P<0.05,与60 μmol/L DIM组比较图1 DIM对肝癌细胞增殖能力的影响
2.2 DIM抑制肝癌细胞迁移和侵袭能力
Transwell迁移实验结果显示,在HepG2细胞中,与对照组相比,40、60和80 μmol/L DIM组迁移细胞数均明显减少(P<0.05);Transwell侵袭实验结果显示,与对照组相比,60和80 μmol/L DIM组侵袭细胞数均明显减少(P<0.05);与60 μmol/L DIM组比较,80 μmol/L DIM组侵袭细胞数明显减少(P<0.05),见图2。在SMMC-7721细胞中,与对照组相比,60和80 μmol/L DIM组迁移细胞数明显减少(P<0.05),且60与80 μmol/L DIM组间迁移细胞数比较,差异有统计学意义(P<0.05);与对照组相比,40、60和80 μmol/L DIM组侵袭细胞数均明显减少(P<0.05),见图3。据以上结果,对两株细胞均选择60 μmol/L DIM进行后续实验。

a:P<0.05,与对照组比较;b:P<0.05,与40 μmol/L DIM组比较;c:P<0.05,与60 μmol/L DIM组比较图2 DIM处理对HepG2细胞迁移和侵袭能力的影响(×100)

a:P<0.05,与对照组比较;b:P<0.05,与60 μmol/L DIM组比较图3 DIM处理对SMMC-7721细胞迁移和侵袭能力的影响(×100)
2.3 DIM降低HepG2细胞和SMMC-7721细胞中CaSR蛋白表达
蛋白免疫印迹结果显示,与对照组相比,在HepG2细胞中,60和80 μmol/L DIM处理组CaSR蛋白表达量明显降低(P均<0.05);在SMMC-7721细胞中,40、60和80 μmol/L DIM组CaSR蛋白表达量明显降低(P均<0.05)。见图4。说明DIM处理可以抑制肝癌细胞中CaSR的表达。
2.4 氯化钆预处理逆转DIM致HepG2和SMMC-7721细胞中CaSR蛋白表达降低
与对照组相比,DIM组两株细胞中CaSR蛋白表达均明显降低(P<0.05);与DIM组相比,氯化钆+DIM组两株细胞中CaSR蛋白表达均明显增加(P<0.05)。见图5。由此说明,DIM引起肝癌细胞CaSR蛋白表达下降,同时,这种下降可被CaSR激动剂缓解。

a:P<0.05,与对照组比较图4 DIM处理对两株肝癌细胞中CaSR蛋白表达的影响

a:P<0.05,与对照组比较;b:P<0.05,与DIM组比较图5 氯化钆预处理对DIM所致肝癌细胞CaSR蛋白表达抑制的影响
2.5 氯化钆预处理逆转DIM致HepG2和SMMC-7721细胞的增殖抑制
与对照组相比,DIM组两株细胞活力均明显降低(P<0.05);与DIM组相比,氯化钆+DIM组两株细胞活力均明显增加(P<0.05)。见图6。由此表明,激活CaSR可以缓解DIM所致肝癌细胞的增殖抑制。

a:P<0.05,与对照组比较;b:P<0.05,与DIM组比较图6 氯化钆预处理对DIM所致的肝癌细胞活力变化的影响
2.6 氯化钆预处理逆转DIM致HepG2和SMMC-7721细胞迁移和侵袭抑制
在HepG2细胞中,与对照组相比,DIM组细胞迁移和侵袭能力均明显降低(P<0.05);与DIM组相比,氯化钆+DIM组细胞迁移和侵袭能力均明显增加(P<0.05),见图7。在SMMC-7721细胞中,与对照组相比,DIM组细胞迁移和侵袭能力均明显降低(P<0.05);与DIM组相比,氯化钆+DIM组细胞迁移侵袭能力均明显增加(P<0.05),见图8。

a:P<0.05,与对照组比较;b:P<0.05,与DIM组比较图7 氯化钆预处理对DIM所致HepG2细胞迁移和侵袭能力变化的影响(×100)

a:P<0.05,与对照组比较;b:P<0.05,与DIM组比较图8 氯化钆预处理对DIM所致SMMC-7721细胞迁移和侵袭能力变化的影响(×100)
3 讨论
肿瘤细胞具有迁移和侵袭能力,使其能够脱离原发肿瘤,进入淋巴管和血管,到达其他组织或器官中,从而造成肿瘤在体内的转移扩散[11]。目前,抑制肿瘤细胞迁移侵袭能力相关的抗肿瘤药物的开发,受到人们广泛的关注。但是,影响肿瘤细胞的迁移和侵袭能力的内在机制尚不明确。Tharmalingam等[12]研究表明,CaSR在侵袭转移性肿瘤中存在异常的高表达,被认为是预测转移及判断预后的一个新的标志物。在人胃癌和肝内胆管细胞癌中,激活CaSR后也可显著增强肿瘤细胞的迁移和侵袭能力[1,13]。但在人肝癌细胞中,CaSR作用如何,激活后能否产生类似的效应仍无证据。
DIM是由十字花科植物提取物吲哚-3-甲醇(indole-3-carbinol,I3C)在胃酸条件下转变而来[14]。针对不同人群进行的研究证实,食用含有DIM的蔬菜如卷心菜、花椰菜和球芽甘蓝,可以降低患肝癌的风险[15-17]。Zhu等[18]研究表明,DIM在抗肿瘤尤其是抑制肝癌进程方面发挥重要作用,其机制可能与干扰肿瘤细胞DNA合成、诱导肿瘤细胞凋亡有关。有研究显示,低剂量(1 μmol/L)DIM可以促进胃癌细胞增殖[19]。但本研究MTT实验结果表明,高剂量DIM处理后肝癌细胞增殖能力明显降低,与前期结果一致[10,20],推测可能与低水平DIM增强了细胞中Oct4、c-Myc等转录因子表达,影响了细胞的重编程有关[21]。除此之外,已有研究发现,DIM可以抑制MHCC-97H和SMMC-7721肝癌细胞迁移和侵袭[9]。本研究证实DIM可以呈浓度依赖性抑制肝癌HepG2和SMMC-7721细胞迁移及侵袭能力。
为进一步明确CaSR在DIM抗肝癌效应中的作用,本研究采用CaSR激动剂氯化钆处理两种肝癌细胞株,观察激活CaSR后对DIM抗肝癌效应的影响。氯化钆是一种高效且特异性的CaSR激动剂,有文献报道[22],氯化钆可以通过增加人非小细胞肺癌A549细胞中CaSR表达从而促进细胞增殖。Zhao等[23]研究表明,在人骨肉瘤MG-63细胞中,采用氯化钆激活CaSR后可明显提高细胞增殖能力。本研究表明,在激活CaSR后,DIM引起的CaSR蛋白低表达和细胞的增殖、迁移及侵袭能力的抑制均得以缓解,提示CaSR可以促进肝癌细胞生长,可能在肝癌细胞进程中发挥促癌基因的作用。
综上所述,DIM通过抑制肝癌细胞中CaSR的表达,对肝癌细胞增殖、迁移和侵袭产生抑制作用,为DIM抗肝癌效应及肝癌的分子诊疗提供了潜在靶点,同时也为CaSR在肝癌组织及癌旁组织中的表达综合评定其与肝癌分期、治疗和预后的关系提供了方向。
