肝硬化患者凝血状态变化的研究进展
2022-01-24龚航魏尉刘先丽黄忠
龚航,魏尉,刘先丽,黄忠
【提要】 在肝硬化背景下,机体会发生复杂的止血平衡改变。传统观点认为肝硬化患者由于凝血时间延长而处于“出血前状态”。实际上,作为凝血途径和抗凝血途径共同变化的结果,肝硬化患者体内止血系统处于一个再平衡状态,原发性止血、二级止血及纤维蛋白溶解均受到影响。原发性止血的多种因素导致患者血小板减少和血管性血友病因子增加;二级止血过程中,促凝微粒增多、凝血因子减少以及纤维蛋白原渗透性降低;纤溶阶段,组织型纤溶酶原激活物水平升高,纤溶酶原和纤溶抑制剂降低。总的来说,肝硬化止血再平衡往往倾向于高凝状态,这为进一步研究肝硬化血栓事件的发生和发展提供了重要的临床依据。
一直以来,肝硬化都被大家认为是一种出血性疾病,肝硬化患者常常伴有凝血功能障碍[1-2]。传统观点认为,促凝因子的合成障碍、血小板减少症以及纤维蛋白的溶解等因素导致肝硬化患者处于低凝易出血状态,但对血栓的形成有保护作用[3]。然而,研究发现肝硬化患者体内同时伴有抗凝因子减少,从而使肝硬化患者往往处于高凝状态。实际上,导致这些变化的最终结果是止血“再平衡”状态,但这种“再平衡”状态是不稳定的,在一定条件下可能同时发生出血和血栓形成[4]。有报道指出,止血平衡是促凝因子和抗凝因子之间紧密平衡的结果,其包括原发性止血(血小板止血栓形成)、二级止血(纤维蛋白凝块形成)和纤维蛋白溶解[1]。越来越多的证据表明[5-7],肝硬化患者的止血改变远比我们所共识的观点要复杂得多,因此,我们需要对止凝血的复杂性以及促凝因子和抗凝因子之间动态的相互作用有一个更加整体的认识,更加充分地了解肝硬化的凝血-抗凝血过程,从而对肝硬化患者的诊治过程提供更多的临床指导。
1 原发性止血改变
肝硬化会发生复杂的止血改变,其复杂程度与肝硬化的严重程度密切相关,涉及原发性止血、二次止血和纤维蛋白溶解中的每一个步骤[8]。研究表明,原发性止血改变主要包括出血前改变和血栓生成前改变[9]。
1.1 出血前改变
血小板在原发性止血中起着重要的作用。血小板在受损血管表面发生黏附和聚集,同时激活凝血系统,促进凝血酶生成增加及血栓的形成。肝硬化患者出血前改变主要表现为血小板减少(<150×109/L)。血小板减少是慢性肝病患者中常见的一种血液系统表现。据报道,慢性肝炎患者血小板减少的患病率仅为6%,但在肝硬化患者中发生率高达78%[10]。轻度血小板减少[(75~150)×109/L]的临床意义有限,通常不会影响临床治疗;中度血小板减少[(50~75)×109/L]可在大约13%的肝硬化患者中观察到;而严重的血小板减少(<50×109/L)与肝硬化的严重程度密切相关,这种情况通常使患者的临床治疗复杂化[11]。Kajihara等[12]通过随机对照实验,将绝对网织血小板(reticulated platelet, RP)计数和血小板糖盏蛋白(glycocalicin, GC)水平作为血小板生成的可靠指标,其中GC是从巨核细胞和血小板表面剥离出来的糖蛋白水解α链,并将RP比例(绝对RP占总血小板的比例)和GCI水平(标准化后的血浆GC水平)作为血小板周转率的指标;结果表明:肝硬化患者的RP比例和GCI明显高于健康对照组,RP计数和GC水平明显低于健康对照组,提示肝硬化血小板减少症是一种涉及血小板生成受损及血小板周转加速的多因素疾病。总之,肝硬化患者血小板减少是多因素导致的,主要包括血小板生成减少和血小板清除增加。
1.1.1 血小板生成减少 血小板的生成受血液中血小板生成素(thrombopoietin, TPO)的调节[13]。TPO在血小板的生成及促进血小板聚集的生理功能中起着重要作用。TPO主要通过与不同细胞表面的血小板生成素受体(thrombopoietin receptor, TPOR)结合,激活Janus激酶信号传导及转录激活因子(Janus-activated kinase Singal transducers and activators of transcriprion, JAK-STAT)信号通路调控巨核细胞的分化和血小板的形成[14]。TPO在肝脏中表达最高,少量表达于肾脏、平滑肌等其他器官。在肝硬化背景下,由于肝细胞数量明显减少、合成功能降低,TPO产量下降,血TPO处于较低的水平[15]。研究表明[16],肝硬化TPO相关性血小板减少可通过肝移植迅速逆转。肝脏的Ashwell-Morell受体(Ashwell-Morell receptor,AMR)也被称为肝细胞半乳糖/N-乙酰基葡糖胺受体,主要表达在肝窦状间隙的肝实质细胞朝向肝窦一侧的细胞膜上,介导去唾液酸化的血小板被肝脏Kupffer细胞吞噬降解,在一定程度上刺激骨髓TPO的产生。肝硬化患者AMR数量及活性降低、位置异常以及抗AMR抗体的产生,导致TPO的生成减少,进而正向调节血小板生成减少[17]。此外,骨髓抑制可能是导致血小板生成不足的另一个关键作用,引起骨髓抑制可能的病因包括病毒抑制、酒精、铁超载和药物治疗[18]。已有报道指出,在接受利奈唑胺治疗的30%患者中可导致血小板减少,其主要原因是骨髓抑制[19]。综上,肝硬化患者TPO减少和骨髓抑制可能是血小板减少的主要原因。
1.1.2 血小板清除增加 慢性病毒性肝硬化(特别是丙型肝炎病毒)患者中,因病毒某些组分与血小板组分相似,机体免疫系统错误识别,产生自身免疫性T细胞和抗血小板抗体[20-21]。研究指出,丙型肝炎病毒感染者外周血抗血小板抗体阳性率显著高于原发性免疫性血小板减少症患者[20-21]。此外,肝硬化患者用药不慎,还可导致药物相关的自身免疫性血小板减少。肝硬化脾脏增大,脾内Toll样受体-4过度表达及巨噬细胞数量增多,使其处于活化状态,增加了对血小板的破坏,并且脾脏大小与血小板计数成反比[10]。综上,脾功能亢进和抗血小板抗体可能是肝硬化患者血小板清除增加的主要原因。
1.2 血栓生成前改变
血栓生成前改变主要平衡血小板减少造成的出血倾向,机制包括血管性血友病因子裂解蛋白酶(a disintegrin and metalloproteinase with thrombospondin type 1 motifs 13, ADAMTS13)减少、血管性血友病因子活性 (von Willebrand factor activity, vWF: Ac)增加及血管性血友病因子抗原(von Willebrand factor antigen, vWF: Ag)增加[22]。ADAMTS13是一种血浆蛋白酶,主要在肝星状细胞的间质区合成,也少量表达于内皮细胞等[23]。血管性血友病因子(von Willebrand factor, vWF)是一种具备黏附活性的多聚糖蛋白,也是血小板黏附到受损血管壁内膜的介导因子,其活性与vWF多聚体的大小相关。超大vWF多聚体具有很强的黏附活性,其一端锚定于血管壁内皮受损处,另一端游离于血流中快速捕捉血小板,介导血小板粘附过程,而ADAMTS13主要负责vWF的切割,防止形成超大vWF多聚体[24]。肝硬化背景下,外周血ADAMTS13减少,使得体积较大的vWF多聚体难以降解,易形成超大vWF多聚体。研究表明[25],当ADAMTS13活性中度降低时就具备促血栓形成和促炎症的特性。Lisman等[26]认为肝硬化患者血浆中vWF:Ac及vWF: Ag水平增加,其原因可能与细菌感染所致的内皮细胞紊乱、肝脏合成vWF增多或肝脏vWF清除率降低相关,提示vWF水平升高有助于诱导止血,是一种代偿血小板减少的可能机制。
总之,血小板减少与肝硬化患者体内增加的vWF产生的影响相互平衡,发生复杂的止血改变,但总的来说,这些变化可能导致止血的再平衡,但这种平衡无论是在出血方向还是在血栓方向都很容易被肝硬化失代偿或机体感染所改变[27]。
2 二级止血改变
门静脉血栓(portal vein thrombosis, PVT)等血栓栓塞事件的发生率随肝硬化严重程度的增加而升高,这些血栓形成与体内高凝状态有关,但高凝状态的机制尚不清楚[28]。越来越多的研究表明血栓形成与肝硬化进展之间存在相关性。最近一项随机对照研究证实[29],低分子肝素预防PVT的治疗可降低中重度肝硬化患者的肝功能失代偿发生率和死亡率。肝硬化二级止血改变主要涉及促凝微粒、凝血因子及纤维蛋白原。
2.1 促凝微粒
微粒(microparticles, MPs)是一种直径为0.1~1.0 μm的小囊泡,由细胞活化或凋亡后从细胞膜表面脱落并释放于细胞外空间[28]。MPs的表面含有其来源细胞的大多数膜相关蛋白,其中一个重要的特征是表面存在带有负电荷的磷脂酰丝氨酸(phospholipidylserine, PS)。MPs形成时,带负电的PS与凝血蛋白上带正电的γ-羧基谷氨酸产生静电作用,导致高凝物质聚集,因此PS的存在明显地增加了MPs的促凝活性。表面携带PS和组织因子(tissue factor, TF)的MPs具有高水平的促凝活性[30]。研究表明[31],肝硬化背景下外周血MPs水平增加,通过聚集高凝物质及激活凝血因子Ⅶ和Ⅸ形成高凝状态。Serag等[28]发现肝硬化患者与健康人群相比,其膜联蛋白A5(抗凝活性)和MPs(促凝活性)微粒水平均显著升高,但膜联蛋白A5/MPs比率显著降低,说明促凝微粒在肝硬化患者中起到主导作用。因此,抗凝微粒和促凝微粒水平的失衡可能导致了肝硬化高凝状态。
2.2 凝血因子
肝细胞参与大多数凝血因子的合成,如纤溶酶原、凝血酶原、凝血因子Ⅴ、Ⅶ、Ⅸ、Ⅹ、Ⅺ、Ⅻ以及蛋白C(protein C, PC)、蛋白S(protein S, PS)和抗凝血酶(antithrombin, AT)等,而肝窦内皮细胞产生凝血因子Ⅷ和vWF[32]。肝硬化患者凝血因子Ⅷ水平升高,其他凝血因子水平均下降,但这些凝血因子的降低可能与出血无关。Sinegre等[33]研究证实肝硬化诱导的高凝状态和血栓事件可能与PC减少、AT减少、凝血因子VIII水平增加及组织因子途径抑制剂(tissue factor pathway inhibitor, TFPI)/PS抗凝血系统失调相关。门静脉中的凝血因子Ⅷ高于外周循环,而PC、PS 均低于外周血循环,因此门静脉相较于外周循环处于更强的高凝状态[29]。
2.3 纤维蛋白原
纤维蛋白原是最丰富的血浆蛋白之一,晚期肝硬化患者纤维蛋白原水平下降[34]。肝硬化患者血浆中纤维蛋白原羰基含量增加及氧化修饰所致的纤维蛋白聚合延迟,导致凝血时间延长,然而纤维蛋白原氧化修饰可致纤维蛋白结构的渗透性降低,凝块溶解变慢[35]。肝硬化患者血栓形成阶段,尽管纤维蛋白原水平下降、凝血时间延长,但纤维蛋白凝块通透性较差,导致血栓对纤溶的抵抗,因此凝血过程可能处于一种过度补偿(高凝状态)[34]。
3 纤维蛋白溶解
纤维蛋白溶解(简称纤溶)的主要步骤是将无活性的纤溶酶原通过组织型纤溶酶原激活物(tissue-type plasminogen activator, t-PA)激活转化为有活性的纤溶酶,使不可溶的纤维蛋白降解为可溶性纤维蛋白降解产物(fibrin degradation products, FDP)[36]。肝脏是许多纤溶因子合成的主要部位,包括纤溶酶原、α2-抗纤溶酶(α2-antiplasmin, α2-AP)和纤溶抑制剂(thrombin-activatable fibrinolysis inhibitor, TAFI)[37]。
肝硬化背景下,纤溶系统发生复杂的变化,导致纤溶系统平衡发生改变。长期以来,人们认为肝硬化患者由于体内高纤溶状态而存在高出血风险[38]。然而,并不是所有的肝硬化患者都出现了高纤溶状态,这种状态通常出现在肝硬化较严重的患者中[39]。近期有证据表明,血浆中的纤溶作用可由于促纤溶和抗纤溶驱动因子的同时下降而保持再平衡,大约40%的肝硬化患者可能出现纤溶系统的重新平衡[40]。
3.1 纤溶酶原
纤溶酶原是由肝脏内皮细胞合成并释放的单链糖蛋白。纤溶酶原是纤溶酶的无活性前体,在t-PA激活下,由单链的纤溶酶原转变成双链有活性的纤溶酶,促使纤维蛋白溶解,以维持体内凝血的平衡。肝硬化时由于肝脏合成障碍和凝血激活导致消耗增多,纤溶酶原的活性及水平均显著降低,从而影响机体降解纤维蛋白的能力,并形成易栓症[41]。不同病因的肝硬化中,其纤溶酶原水平不同,在原发性胆汁性肝硬化中纤溶酶原水平较低[1]。
3.2 t-PA
t-PA由血管内皮细胞合成、储存和分泌,主要在肝脏中清除。t-PA的清除主要通过与肝内皮细胞上的甘露糖受体和肝实质细胞上的低密度脂蛋白受体相关蛋白结合,其寿命较短、血浆半衰期约5 min。t-PA在与纤维蛋白结合时激活纤溶酶原,肝硬化时由于肝脏清除率降低,t-PA活性和水平均显著升高[37]。t-PA被体内纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1, PAI-1)结合而灭活。PAI-1由血管内皮细胞和血小板释放,由于肝硬化时PAI-1、t-PA活性及水平均升高,致使纤溶系统再平衡[42]。
3.3 纤溶抑制剂
纤溶抑制剂主要包括α2-AP、TAFI等,其中α2-AP主要抑制纤溶酶活性,并通过激活凝血因子ⅩⅢ与纤维蛋白的交联以抑制纤溶[43]。α2-AP在不同病因肝硬化中水平不同,在酒精性肝硬化中α2-AP水平较低,而原发性胆汁性肝硬化中无明显变化[44]。肝硬化时TAFI水平降低,TAFI主要通过其活化形式(TAFIa)参与纤溶抑制,TAFIa可消除部分FDP的C -末端赖氨酸和精氨酸残基,导致纤溶酶原与FDP的结合减少和抑制纤溶酶原的激活[45]。
在肝硬化患者中纤溶系统的状态至今仍存在争议。研究表明[46-47],肝硬化由于FDP的增加和TAFI的减少而处于高纤溶状态。另有研究表明[48]肝硬化患者处于低纤溶状态或纤溶系统的再平衡状态(促纤溶和抗纤溶因子同时减少)。Rossetto等[49]研究发现,尽管肝硬化TAFI合成减少,但肝硬化患者TAFI和TAFIa的血浆总水平高于健康对照组,提示低纤溶状态的存在;肝硬化PVT组与无PVT组相比,其TAFI和TAFIa水平明显升高,提示低纤溶状态可能增加患者发生血栓事件的风险。综上所述,肝硬化患者同时存在纤溶活性和抗纤溶活性改变,总体而言,纤溶改变的方向可能更趋向于抗纤溶状态。
肝硬化患者止血平衡改变的原因见图1。
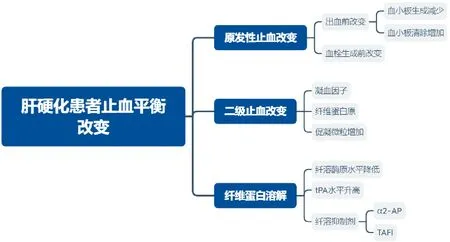
图1 肝硬化患者止血平衡改变的原因
4 结语
肝硬化凝血改变的复杂性与肝硬化的严重程度相关,且有一定的个体差异,肝硬化的病因、严重程度及治疗状况都有可能改变这种凝血平衡,从而增加患者血栓形成或出血的风险。因此,我们迫切需要评估个体出血及血栓事件发生风险的方法。总的来说,凝血平衡的改变导致肝硬化患者处于高凝状态。因此,肝硬化并不是抗凝的绝对禁忌症,对于有PVT改变的肝硬化患者抗凝是安全有效的。在临床治疗中我们时刻关注这种高凝风险和出血并发症的风险是十分有意义的。
