热休克因子1在胰腺癌组织中的表达及预后意义
2022-01-24潘刘翃钱俊波
潘刘翃,钱俊波
胰腺癌是死亡率较高的恶性肿瘤之一,临床早期缺乏典型症状,而且肿瘤位置较深,常规影像学检查不易识别,确诊时多处于中晚期,丧失手术根治机会;并且,肿瘤具有早期浸润、转移以及较高的复发率,总体生存预后较差,5年生存率仅为7%[1-2]。深入分析肿瘤发生的分子机制是当前研究的热点。肿瘤血管生成是肿瘤发生、发展和转移的重要机制。热休克因子1(heat shock factor 1,HSF1)是一个关键的转录因子,通过与共有基序结合启动热休克蛋白的表达,进而通过复性或降解受损的蛋白质来适应和延长细胞的存活时间,应对各种细胞应激反应,如热、缺血、缺氧、炎症以及其他有害应激源,提高肿瘤的生存适应力[3]。HSF1能够调节多种肿瘤的发生和发展,促进肿瘤细胞的增殖和存活[4],但是HSF1与胰腺癌的关系仍不确定。因此,该研究主要分析HSF1在胰腺癌组织中的表达,与肿瘤病理特征以及患者生存预后的关系,为肿瘤早期诊断和发生机制提供参考依据。
1 材料与方法
1.1 材料来源
选择2018年1月至2020年12月入我院经手术切除和病理确诊为胰腺癌患者共92例为研究对象,同时获得肿瘤组织和癌旁正常组织。纳入标准:①年龄18~75岁;②符合胰腺癌的病理诊断;③手术切除肿瘤组织和癌旁5 mm正常胰腺组织;④术后根据指南推荐进行恰当的放化疗;⑤取得患者的知情同意,临床随访资料完整。排除标准:①合并胰腺炎、消化性溃疡,其他部位原发恶性肿瘤,如胃癌;②严重肝肾功能障碍;③术前接受新辅助放化疗,该研究经我院伦理委员会批准。
1.2 随访
手术由我院经验丰富的医生和护理团队进行,术后进行至少4~6个疗程的化疗。术后常规门诊或者电话随访,了解肿瘤复发和患者生存情况。总生存期(overall survival,OS)定义为从随访开始至结束的生存状态包括生存和死亡,死亡者的生存时间定义为随访开始至死亡时刻,生存者的生存时间定义为随访开始至结束。随访资料包括临床检查、胰腺超声、计算机断层扫描等。
临床资料包括患者性别、年龄、血清癌胚抗原(CEA)和CA19-9、肿瘤直径、淋巴结转移、TNM分期、肿瘤位置、分化级别、血管侵犯和远处转移。
1.3 实时定量PCR(RT-qPCR)法检测组织HSF1 mRNA
采用RT-qPCR法检测组织HSF1 mRNA相对表达量,切除的样本在液氮中快速冷冻、粉碎,在TRIzol(美国Invitrogen公司)中提取细胞内总RNA,检测浓度和纯度后,称取1μg RNA与oligo(dT)15混合,使用Moloney鼠白血病病毒进行逆转录,获得第一链互补DNA。根据Gene Bank提供HSF1分子序列设计HSF1基因特异性聚合酶链反应引物:正向5′-CCATCCTGCGGAGAGTGGAA-3′,反向5′-GGCTCCGAGCA-3′,以互补DNA为模板,采用一步法逆转录PCR试剂盒(北京天根生物技术有限公司)在biosystems7500扩增仪上进行实时PCR反应。采用美国Thermo Scientific公司的PCR扩增仪,设置反应参数为95 ℃ 3 min变性,然后95 ℃ 15 s、56 ℃ 10 s和72 ℃ 45 s,循环次数为35次。结果采用2-ΔΔCt法表示。
1.4 免疫组织化学染色HSF1表达
采用免疫组织化学染色法检测组织HSF1阳性表达,将新鲜组织制作石蜡包埋玻片(4 μm厚),常规经60 ℃加热脱蜡、二甲苯和分级乙醇复水、3%过氧化氢浸泡猝灭内源过氧化物酶,微波炉中用柠檬酸盐缓冲液(pH=6.0)进行高温抗原回收以增强免疫反应,载玻片在封闭血清中培养减少非特异性结合。然后去除血清,在4 ℃用1∶100稀释的抗人HSF1单克隆抗体(美国Sigma公司)孵育过夜,洗涤后用生物素化二级抗体和链霉亲和素过氧化物酶结合物孵育处理,用3,3′-二氨基联苯胺溶液观察抗体特异性结合情况。最后,用苏木精复染载玻片并用中性香脂固定。阴性对照玻片仅与磷酸盐缓冲液(PBS)孵育,在光学显微镜下检查免疫染色情况,采用尼康数码相机DXM 1200F(日本尼康公司)400倍视野下随机抽取10个区域进行计数。
结果判读:染色强度分为0=无核染色,1=淡黄色,2=浅棕色,3=中棕色,阳性细胞百分比为≤10%记0,11%~25%记1,26%~50%记2,51%~75%记3,≥76%记4;两项乘积<3为低表达,≥3为高表达。每例标本均由2名经验丰富的病理科医师独立判读,最终取平均值。
1.5 统计学方法
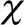
2 结果
2.1 组织HSF1 mRNA相对表达量的比较
肿瘤组织HSF1 mRNA相对表达量明显高于癌旁正常组织,差异有统计学意义[(0.5826±0.1102)比(0.2896±0.0957),t=35.263,P<0.001],见图1。
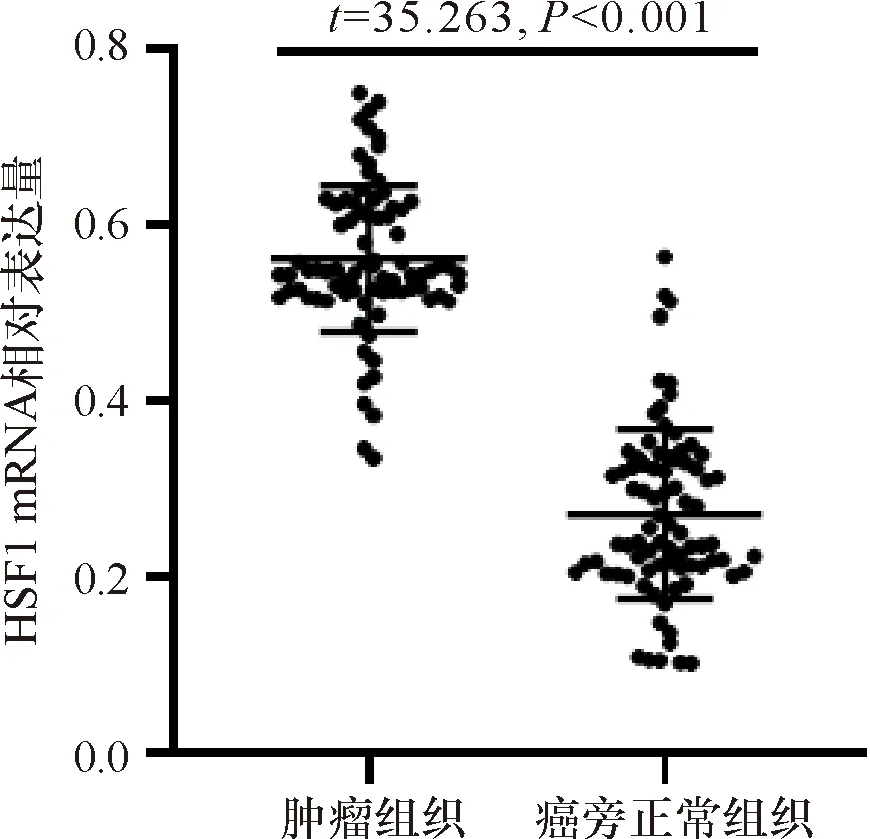
图1 RT-qPCR法检测组织HSF1 mRNA相对表达量
2.2 组织HSF1阳性表达的比较
肿瘤组织HSF1阳性表达率为54.3%(50/92),癌旁正常组织HSF1阳性表达率为14.1%(13/92),肿瘤组织HSF1阳性表达率明显高于癌旁正常组织(P<0.05),见图2。
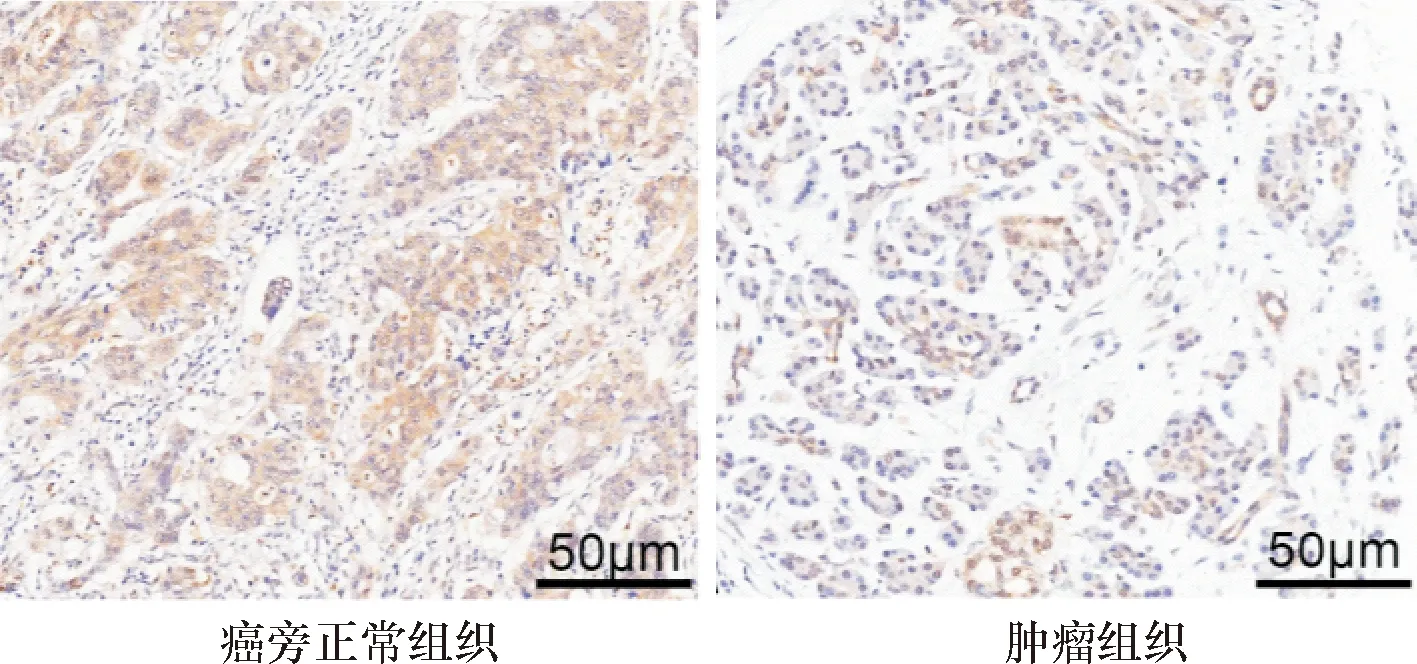
图2 免疫组化染色组织HSF1表达(400×)
2.3 HSF1表达与肿瘤临床和病理特征的关系
HSF1高表达患者血清CA19-9水平、淋巴结转移阳性、TNM分期、低分化、血管侵犯阳性以及远处转移阳性高于HSF1低表达患者,差异有统计学意义(P<0.05),见表1。
表1 HSF1表达与肿瘤临床和病理特征的关系 [n(%)]
2.4 HSF1表达与3年累积生存率的关系
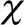
图3 Kaplan-Meier曲线显示HSF1表达与3年累积生存率的关系
2.5 OS的独立危险因素分析
92例患者随访共存活40例,死亡52例。单因素比较发现,年龄、CA19-9、肿瘤直径、淋巴结转移、HSF1表达、TNM分期、血管侵犯和远处转移与患者OS有关,见表2。将单因素分析有意义的变量纳入多因素Cox回归分析,结果(表3)显示,CA19-9(≥100 U/mL)、淋巴结转移、TNM分期(Ⅲ~Ⅳ)、血管侵犯、远处转移和HSF1高表达是胰腺癌患者OS的独立危险因素(P<0.05)。
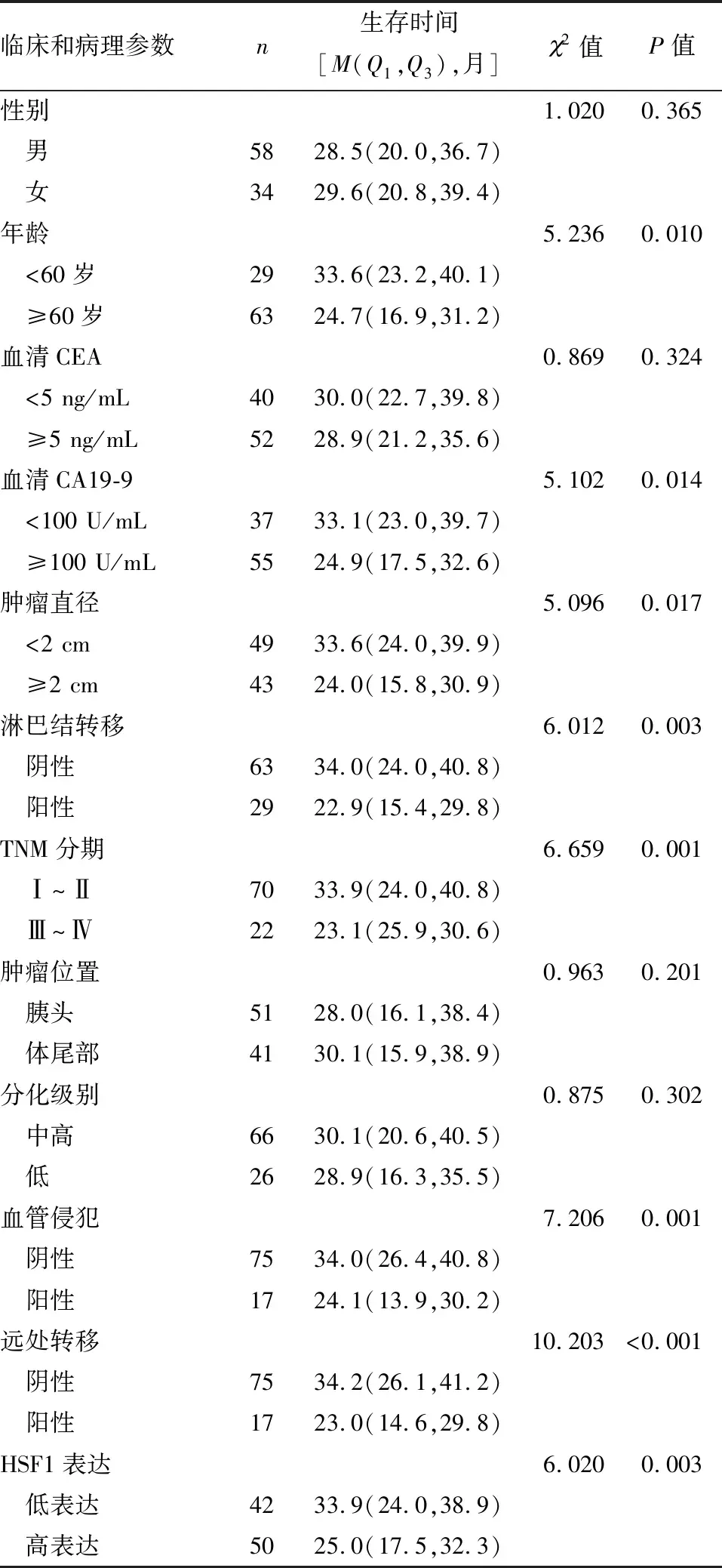
表2 胰腺癌患者OS的单因素分析
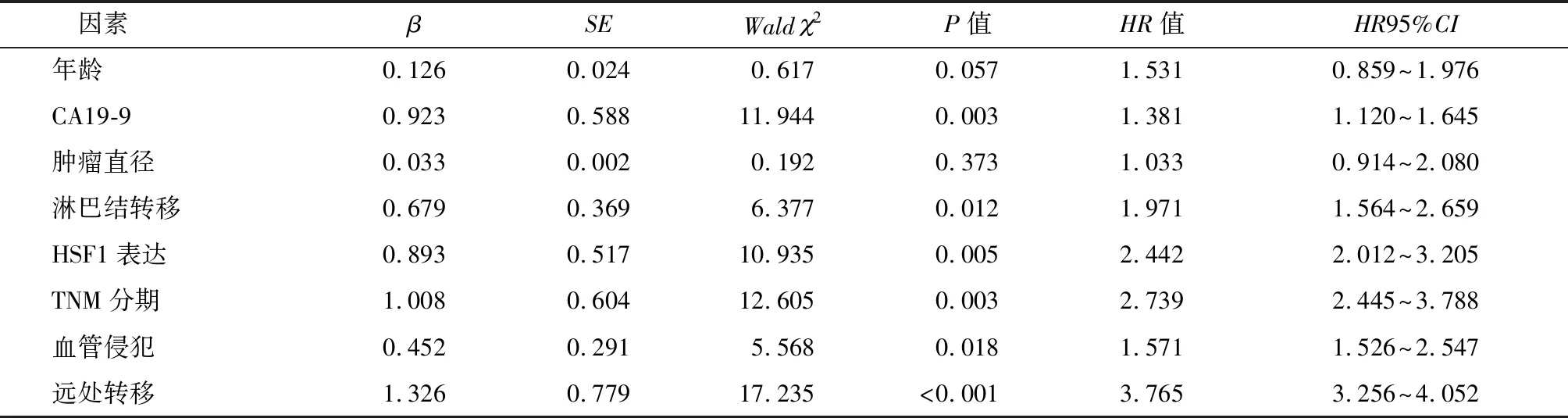
表3 影响胰腺癌患者OS的多因素Cox回归分析
3 讨论
研究证实,HSF1异常表达与多种恶性肿瘤的发生和发展密切相关,如胃癌、肝癌、肺癌、结直肠癌、宫颈癌等[5-6]。HSF1的主要生物学功能是调控肿瘤细胞内质网未折叠蛋白反应、氧化应激反应、自噬、多药耐药、泛素-蛋白酶体系统、染色质重塑、细胞增殖、细胞凋亡、细胞周期进程、DNA修复等,主要诱导肿瘤细胞适应多种胞内外有害刺激,促进肿瘤血管生成,引导胞外多种信号转导通路向细胞核转移,最终表现为靶基因和靶蛋白的表达[7-9]。
该研究显示,肿瘤组织HSF1 mRNA相对表达量和阳性表达率均明显高于癌旁正常组织(P<0.05)。提示,HSF1基因和蛋白高表达与胰腺癌的发生有关。胰腺癌早期诊断困难,恶性程度高,侵袭性强,肿瘤发生迅速,即使早期手术切除后1年复发率仍可高达30%~50%,因此,生存预后极不理想[10]。早期检测胰腺癌的肿瘤标志物对胰腺癌的诊断和预后具有十分重要的意义。HSF1是一种应激激活的转录因子,通过诱导HSPs表达,可以在极端环境和病理条件下产生防御机制,帮助宿主细胞维持细胞功能平衡[11-13]。HSF1能够调节细胞多个节点的病理生理过程,组成一个非常多样化的群体,远远超出蛋白质折叠,包括能量代谢、细胞周期信号、DNA修复、细胞凋亡、细胞粘附、细胞外基质形成和翻译等,帮助癌细胞适应、存活和增殖[14-16]。HSF1可以使用不同于热休克反应的转录程序来支持肿瘤的高度恶性,如肝细胞癌患者HSF1表达上调,通过HSP27增强细胞活力促进肝癌细胞的侵袭和转移,与预后不良显著相关[17]。Liang等[18]研究指出,HSF1可以通过调节第二线粒体源性caspase激活因子,进而抑制线粒体凋亡途径促进胰腺肿瘤的发生。
该研究显示,HSF1高表达患者血清CA19-9水平、淋巴结转移阳性、TNM分期、低分化、血管侵犯阳性以及远处转移阳性高于HSF1低表达患者(P<0.05)。提示HSF1高表达与多项肿瘤恶性特质有关。免疫组化染色显示,HSF1蛋白定位于胰腺癌细胞的胞浆和胞核,在胰腺癌组织的基质细胞中也有大量表达。HSF1活化参与基质从肿瘤抑制环境到支持环境的转录重编程[19-20]。癌细胞必须招募和重新编程非恶性基质细胞的增殖、侵袭和转移,并应付各种潜在的致命挑战,包括蛋白质错误折叠、氧化应激和营养缺乏等,提示HSF1能激活癌细胞与间质相互作用,促进胰腺癌的发生发展[21-23]。HSF1高表达患者的3年累积生存率低于HSF1低表达患者(P<0.05)。提示HSF1高表达与较差的临床预后有关。该研究最后采用Cox回归分析显示,CA19-9(≥100 U/mL)、淋巴结转移阳性、TNM分期(Ⅲ~Ⅳ)、血管侵犯阳性、远处转移阳性和HSF1高表达是OS的独立危险因素(P<0.05)。提示HSF1高表达是预测临床预后的重要参考指标。Tokunaga等[24]研究表明,HSF1通过下调HSP27表达诱导吉西他滨耐药的人胰腺癌细胞中活性己糖相关化合物的表达。Chen等[25]研究指出,AMPK活化缺失通过HSF1依赖途径促进胰腺癌的侵袭和转移。
综上所述,HSF1高表达可能参与了胰腺癌的发生、发展以及生存预后,有望成为胰腺癌诊断和评估临床预后的重要靶向生物标志物。该研究不足是仅探讨了胰腺癌组织中HSF1表达,外周血清HSF1表达是否同样发生变化还不能完全确定,本研究结论不适合胰腺癌患者外周血清HSF1表达的检测。
