多囊卵巢综合征患者月经周期异常与糖脂代谢及胰岛功能相关性
2022-01-20童一希
童一希
苏州大学附属第二医院(215000)
多囊卵巢综合征(PCOS)是生殖内分泌疾病[1]。易引起糖脂代谢紊乱、胰岛素抵抗,增加了糖尿病、高血压、心脑血管疾病等风险[2]。月经稀发及闭经是PCOS患者最常见的月经模式,但也有部分患者表现为月经规律、月经频发或不规则阴道流血[3]。不同月经周期的PCOS患者内分泌是否存在差异尚不十分明确。本研究根据PCOS患者的不同月经周期进行分层,分析糖脂代谢及胰岛功能差异,为PCOS临床管理提供参考。
1 资料与方法
1.1 研究对象
选择2018年3月—2020年9月于本院妇科诊治的PCOS患者328例作为研究对象,年龄(26.7±8.6)岁(21~38岁),PCOS诊断参照相关标准[4]。排除标准:①近6个月内接受过PCOS相关治疗或应用过影响内分泌指标的药物,如短效口服避孕药等;②合并甲状腺、肾上腺等内分泌疾病;③合并严重心、肺功能障碍及肝肾功能不全;④合并恶性肿瘤;⑤妊娠期或哺乳期。所有研究对象均签署知情同意书,本研究方法通过院伦理委员会审核。
1.2 研究方法
记录患者一般资料,包括年龄、体质量指数(BMI)、腰臀比(WHR)等。于月经周期或孕激素撤退出血的第3天采集空腹静脉血,检测基础性激素水平:卵泡刺激素(FSH)、黄体生成激素(LH)、雌二醇(E2)、泌乳素(PRL)、睾酮(T)、抗苗勒管激素(AMH);糖脂代谢指标水平:空腹血糖(FPG)、空腹胰岛素(FINS)、总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL);行OGTT试验检测空腹血糖(FPG)、空腹胰岛素(FINS),服糖后1h及2h血糖(G60、G120)及胰岛素水平(INS60、INS120),计算胰岛素抵抗指数(HOMA-IR)=FPG×FINS/22.5、胰岛素敏感指数(ISI)=1/(FINS×FPG)、胰岛β细胞功能指数(HOMA-β)(%)=FINS×20/(FPG-3.5)、葡萄糖曲线下面积(GLU-AUC)=(FPG+G120)/2+G60、胰岛素曲线下面积(INS-AUC)=(FINS+I120)/2+INS60。
1.3 分组
统计纳入对象月经周期<21d为月经频发,21~35d为月经规律,36~180d为月经稀发,>180d为闭经。不规则阴道流血:经期延长,经间期出血。根据研究对象月经周期分为:频发组,即月经频发及不规则阴道流血,由于月经频发及不规则阴道流血的病例数均较少,故合并分析;月经规律组;月经稀发组;闭经组。
1.4 分析指标及标准
比较各组间临床特征、性激素水平、糖脂代谢、胰岛功能相关指标差异,分析月经周期与高脂血症、胰岛素抵抗的相关性。参照胰岛素抵抗评估标准[5],将HOMA-IR≥2.69诊断为胰岛素抵抗。参照中国成人血脂异常防治指南[6],高脂血症包括:高胆固醇血症(TC≥5.2mmol/L),高三酰甘油血症(TG≥1.7 mmol/L),混合型高脂血症(TC≥5.2mmol/L且TG≥1.7 mmol/L),低高密度脂蛋白血症(HDL<1.0mmol/L)。
1.5 统计学方法
应用SPSS 20.0数据分析。计量资料多组间比较采用F分析,组间两两比较采用t检验;计数资料组间比较运用χ2检验;相关性研究采用logistic回归分析。P<0.05为具有统计学意义。
2 结果
2.1 各组临床特征比较
328例PCOS患者,月经频发15例(4.6%),不规则阴道流血9例(2.7%),月经周期规律30例(9.2%),月经稀发155例(47.3%),闭经119例(36.3%)。4组患者临床特征比较,稀发组及闭经组BMI、WHR及多毛发生率大于频发组及规律组(P<0.05),闭经组WHR大于稀发组(P<0.05),BMI、多毛发生率稀发组与闭经组无差异(P>0.05),频发组与规律组BMI、WHR及多毛发生率均无差异(P>0.05)。4组年龄无差异(P>0.05)。见表1。
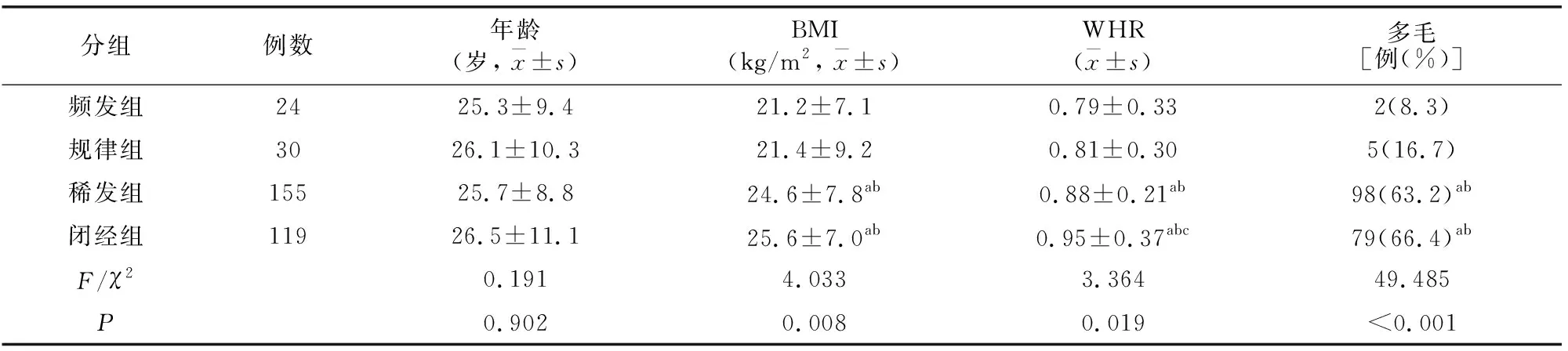
表1 各组临床特征比较
2.2 各组性激素水平比较
LH、LH/FSH、T水平闭经组大于稀发组且两组均大于频发组及规律组(P<0.05),频发组与规律组无差异(P>0.05);各组FSH、E2、PRL、AMH水平无差异(P>0.05)。见表2。
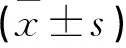
表2 各组性激素水平比较
2.3 各组糖脂代谢指标比较
稀发组及闭经组FPG、FINS、TC、TG水平大于频发组及规律组,HDL低于频发组及规律组(P<0.05),闭经组FINS大于稀发组、HDL低于稀发组(P<0.05),稀发组与闭经组FPG、TC、TG无差异(P>0.05),频发组与规律组FPG、FINS、TC、TG、HDL无差异(P>0.05)。各组LDL无差异(P>0.05)。见表3。
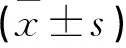
表3 各组糖脂代谢指标比较
2.4 各组胰岛功能指标比较
稀发组及闭经组HOMA-IR大于频发组及规律组,HOMA-β低于频发组及规律组(P<0.05),稀发组与闭经组、频发组与规律组HOMA-IR和HOMA-β无差异(P>0.05)。各组ISI、GLU-AUC、INS-AUC无差异(P>0.05),见表4。
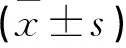
表4 各组胰岛功能指标比较
2.5 月经周期与高脂血症、胰岛素抵抗相关性
在PCOS患者中,分别以高脂血症、胰岛素抵抗为因变量,以年龄、BMI、WHR、不同月经周期为自变量行logistic回归分析。结果发现:BMI、WHR、月经稀发及闭经是高脂血症的独立影响因素(P<0.05,OR>1.0),年龄及月经频发或不规则阴道流血与高脂血症无明显相关性(P>0.05);年龄、BMI、WHR、月经稀发及闭经是胰岛素抵抗的独立影响因素(P<0.05,OR>1.0),月经频发或不规则阴道流血与胰岛素抵抗无明显相关性(P>0.05)。见表5。

表5 临床特征与高脂血症及胰岛素抵抗的logistic回归分析
3 讨论
月经稀发或闭经是PCOS最常见的月经模式,也是就诊的首发症状。然而,PCOS患者的临床表现有多样性的特点,月经周期也多种多样,单发和各种组合,异常子宫出血和月经频发也以相当比例出现[7],成为疾病异质性的一大佐证。本研究病例中月经异常以月经稀发及闭经为主占83.5%,月经规律仅占9.2%,其余表现为月经频发或不规则阴道流血。
PCOS患者月经异常的发生机制尚不十分明确,包括了下丘脑-垂体-卵巢-肾上腺轴异常以及代谢等一系列因素。胰岛功能下降、血清胰岛素水平升高是PCOS疾病的重要病理生理改变,而高胰岛素血症会刺激卵巢过渡分泌性激素,同时作用于垂体促进其分泌LH,间接增加卵巢生物合成,抑制肝脏性激素结合球蛋白合成,导致游离雄激素增多并活性增强,引起卵泡闭锁、排卵障碍,形成月经异常[8-9]。同时,高雄激素可促进腹壁及内脏脂肪蓄积,促进儿茶酚胺分解脂肪而增加血浆中游离脂肪酸,引起脂代谢紊乱,进一步加重胰岛素抵抗[10],形成恶性循环。故推测PCOS的月经异常模式可能存在不同的糖脂代谢及胰岛功能。
关于PCOS月经模式与血清学各指标结论各研究不一致,有研究发现闭经同时伴有高雄激素血症的患者高脂血症发生风险高于月经规律者[11]。不同月经模式下,PCOS 患者LH/FSH、FINS水平存在差异,表现为月经周期>60天的患者空腹血糖、HOMA-IR及TG水平明显升高[12]。国外研究发现生殖表型越严重(特征为与慢性无排卵相关的高雄激素血症)的患者肥胖情况越严重, 脂代谢紊乱及胰岛素抵抗更明显[13]。然而,也有研究得出不同结论,有学者[14]认为不同月经模式下FINS、HOMA-IR、TC并无统计学差异。
本研究发现PCOS患者中,与月经规律比较,月经稀发及闭经患者在性激素水平、糖脂代谢、胰岛功能指标方面均表现出明显差异性,月经稀发及闭经的患者更易合并高雄激素血症及高LH,同时糖脂代谢紊乱及胰岛素抵抗程度更甚。月经稀发或不规则阴道流血的PCOS患者在性激素水平、糖脂代谢、胰岛功能指标方面与月经规律患者并无显著差异,说明月经稀发或不规则阴道流血与糖脂代谢紊乱及胰岛功能下降并无关联。此外,本研究还发现,闭经的PCOS患者性激素及糖脂代谢紊乱的程度重于月经稀发患者,但胰岛素抵抗指标无显著差异。多因素分析矫正了年龄、BMI、WHR因素后发现,相对于月经规律的患者,月经稀发患者发生高脂血症的风险增加1.652,发生胰岛素抵抗的风险增加2.54,闭经的患者发生高脂血症的风险增加2.263,发生胰岛素抵抗的风险增加2.841。
总之,不同月经周期模式的PCOS患者其性激素、糖脂代谢、胰岛功能存在差异,对月经稀发和闭经患者,不仅应关注其排卵障碍的表现,还应监测其糖脂代谢及胰岛功能,针对不同特点进行个体化治疗以提高疗效。
