辣椒、花椒中罗丹明B免疫层析分析
2022-01-14郑佳妍周丽岩韩晓利李昳晴王庭欣
郑佳妍,周丽岩,韩晓利,李昳晴,王庭欣
(河北大学 质量技术监督学院,河北 保定 071002)
罗丹明B(RB)是一种人工合成的鲜桃红色碱性荧光化学物质,常温下为深红色晶体或红棕色粉末[1-3],同时RB是一种偶氮类染料,具有致癌致突变性,但因其较好的着色力和鲜亮的色泽,被作为非食品添加剂添加到花椒、辣椒中[4-5],对人体造成了不良损害,2004年被卫生部列为食品禁用成分[6].
目前,检测食品中的RB常用的分析方法有高效液相色谱法[7-8]、液相色谱-质谱联用法[9-10]、荧光探针法[11].这些方法具有分离效果好、灵敏度高的优点,但设备价格昂贵,前期处理复杂,不适用现场快速检测及筛选.酶联免疫方法虽灵敏度高、操作简单,但操作过程繁琐,并且需要较长时间的抗体样品制备过程,不能满足现场检测的要求.免疫层析试纸检测技术具有简便、快速、低成本的优点,适用于大批量产品的筛检及检测[12-13],RB的免疫层析分析方法至今鲜有报道,本文利用免疫层析技术对RB快速检测试纸技术进行了研究,为RB的快速检测及筛查提供了技术支持.
1 材料与方法
1.1 材料
RB、R123(中国食品药品检定所);鸡卵清白蛋白(OVA)、牛血清白蛋白(BSA)(SIGMA);氯金酸(体积分数为0.01% HAuCl4,Biotopped);羊抗兔二抗(CWBIO,中国高端生物试剂生产商);辣椒、花椒(保定市惠友超市);雌性新西兰大耳白兔,3月龄,由河北医科大学实验动物中心提供.
1.2 仪器与试剂
酶标仪(Model 680);硝酸纤维素膜(NC膜,Biotopped);双光束紫外可见分光光度计T6新世纪型,北京普析通用仪器有限责任公司.
金标记抗体浓缩储存液(pH7.2,1 L超纯水(18.2 MΩ·cm),0.762 8 g硼酸钠,1 g牛血清白蛋白、1 g叠氮钠),柠檬酸三钠水溶液(质量分数0.1%),包被液缓冲溶液(CB,pH9.6),磷酸盐缓冲溶液(PBS,pH7.4),洗涤缓冲溶液(PBST),封闭液(BB,质量分数5%脱脂奶粉溶解于1 mol/L PBS中).
1.3 方法
1.3.1 R123完全抗原与包被抗原制备
利用戊二醛法[14]将R123与BSA偶联合成R123-BSA(图1).10 mg R123溶于400 μL甲醇溶液,200 mg BSA溶于5 mL PSB溶液,R123-CH3OH溶液、BSA溶液与3 mL体积分数25%戊二醛水溶液混匀,25 ℃静置1 h,4 ℃过夜.4 ℃下,PBS中透析5 d.同法合成R123-OVA.
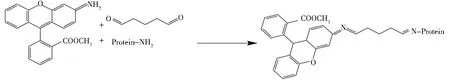
图1 R123-BSA完全抗原合成路线Fig.1 Complete antigen synthesis of R123-BSA
1.3.2 合成抗原鉴定
配制BSA、OVA、R123标准溶液,在波长200~400 nm内对BSA、OVA、R123、R123-BSA、R123-OVA溶液进行紫外扫描,记录波形图.
1.3.3 抗体制备
采用皮下注射方法免疫新西兰大耳白兔.准确量取0.1 mL R123-BSA,溶于PBS中,与等体积的弗氏完全佐剂混合进行初次免疫.再次免疫采用弗氏非完全佐剂与R123-BSA等体积混合的方法,于初次免疫后的第22、37、52、67天分别免疫,在第78天,从兔子的耳缘静脉取血,4 ℃下静置分层后,取上清液以3 000 r/min离心15 min,获得抗血清. 利用饱和硫酸铵盐析沉淀的方法将抗血清纯化[15].
1.3.4 胶体金的制备
利用柠檬酸三钠还原法[16]制备胶体金:在恒温磁力搅拌器上加热100 mL体积分数0.01%的HAuCl4水溶液,沸腾后,加入1.1 mL质量分数0.1%柠檬酸三钠水溶液,维持沸腾状态,直至溶液成透明红色,继续煮沸15 min后停止加热,继续搅拌,冷却后加入去离子水使其前后体积不变.胶体金颗粒如图2.

图2 具有双电离子层的胶体金颗粒Fig.2 Colloidal gold particles with a double ionic layer
1.3.5 金标记抗体最佳pH值的测定
设置6种pH分别为5.0、6.0、7.0、8.0、9.0、10.0的胶体金溶液,各取100 μL加入酶标板中,设置平行,每孔加入5 μL 0.362 mg/mL的抗血清,以PBS为对照组,25 ℃下静置20 min,每孔加入20 μL 质量分数10%NaCl溶液.524 nm波长下测定OD值.以OD值为纵坐标,pH值为横坐标,绘制标准曲线.
1.3.6 稳定1 mL胶体金所需抗体最小标记量的确定
在最适pH值条件下,向1 mL胶体金溶液中分别加入0、10、20、30、40、50、60、70、80、90 μL的抗体溶液,如表1所示.测定吸光值OD524值,绘制吸光值-抗体加入量曲线.抗体最小标记量即在吸光值稳定时所对应的抗体用量的110%~120%.
1.3.7 免疫金的制备与纯化
将10倍抗体最小加入量与胶体溶液混合搅拌10 min,质量分数10% BSA溶液稀释胶体金质量分数为1%,继续搅拌,充分混匀后置于4 ℃过夜.4 ℃下,溶液1 500 r/min离心10 min,取其上清液在同样温度下10 000 r/min离心30 min,沉淀用储存液重新悬浮至1 mL,4 ℃保存.
1.3.8 渗滤式金标试纸的制备
检测线(T线):体积为1 μL、长度5 mm的R123-OVA用划线笔涂在NC膜(0.2 cm×5 cm)上.质控线(C线):0.5 μL二抗.T线与C线间隔1 mm.37 ℃下培养20 min,封闭30 min.PBST洗涤5次,37 ℃下干燥20 min,4 ℃保存.
竞争反应:100 μL金标记抗体和RB标准溶液的混合液滴到T、C线之间.
结果判定:T、C线颜色变化结果如图3所示.
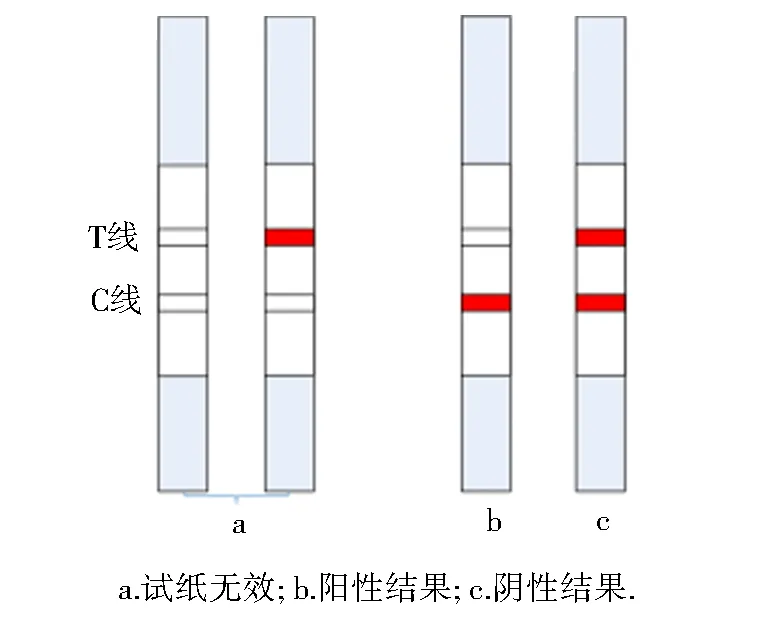
图3 试纸条检测结果示范Fig.3 Demonstration of test results of the strip
1.3.9 抗原包被量与免疫金稀释倍数最优组合的确定
用矩阵法将3种不同抗原包被量(0.75、1.5、3.75 μg)和3种不同免疫金稀释度(1∶1,1∶2,1∶5)(体积比)两两组合,分别划到试纸条的反应区域内,观察显色变化进行对比.
1.3.10 抗原与免疫金最适混合比例的确定
3种不同体积比(1∶1、1∶5、1∶10)混合的10 ng/mL RB标准溶液和免疫金混合液划线到相应的反应区域,根据显色对比情况选择.
1.3.11 最低检出限的确定
将7种不同质量浓度(20、10、5、1、0.5、0.1、0.01 ng/mL)的RB标准溶液与免疫金按最适混合比例混合后进行竞争反应,将不同质量浓度对应的反应颜色绘制成卡,即RB标准品浓度比色卡.最低检出限即为颜色差别明显时的最小浓度.
1.3.12 样品处理方法
15.0 g辣椒与10 mL正己烷在蒸发皿上混合水浴蒸干,重复1次.加入10 mL甲醇,浓缩至1 mL.用稀释2、4、6、10、20倍的辣椒提取液进行竞争反应.样品提取液最佳稀释度为背景颜色与空白最接近时的样品稀释倍数.花椒提取液操作同上.
1.3.13 样品的添加回收率测定
向空白样品中添加不同质量浓度的RB标准溶液,按1.3.12样品处理的方法,稀释后进行检测.
2 结果与分析
2.1 抗原紫外光谱鉴定结果
由图4和图5对比可知,R123-载体蛋白偶联成功后,波形图发生明显变化,最高峰由285 nm转移到525 nm,OD值发生明显变化,标志完全抗原合成成功[17].

图4 BSA紫外光谱Fig.4 BSA UV spectrum

图5 R123-BSA紫外光谱Fig.5 R123-BSA UV spectrum
2.2 胶体金质量鉴定
制备的胶体金溶液形态符合胶体金要求.胶体金溶液于400~600 nm波长扫描,在524 nm处吸收峰最大,如图6.依据表2可初步判断此胶体金颗粒直径在40 nm左右.

图6 胶体金紫外光谱Fig.6 Colloidal gold UV spectrum
2.3 金标抗体最适pH值的确定
胶体金标记抗体易受溶液酸碱度影响,研究认为,溶液偏碱性或接近抗体等电位时,抗体标记效果好.由图7可知,吸光度在pH8.0~10.0内较高,说明抗体标记效果好.选择中间值pH9.0.

图7 标记抗体蛋白时胶体金溶液pH值的优化Fig.7 Optimization of the pH of colloidal gold solution when antibody proteins were labeled
2.4 抗体蛋白与胶体金结合最佳用量的确定
通过紫外分光光度法判定,测得结果如图8.吸光度在抗体蛋白用量为50 μL时就无明显变化,因此,抗体最小标记量为60 μL.

图8 胶体金溶液标记抗体蛋白用量的优化Fig.8 Optimization of the amount of antibody protein labeled with colloidal gold solution
2.5 抗原包被量与免疫金稀释度的确定
不同抗原包被量和不同稀释倍数的免疫金两两组合,分别测试,结果如图9.

从左至右依次为体积比1∶1、1∶2、1∶5稀释的免疫金.图9 包被原与免疫金稀释度优化结果Fig.9 Optimized results of dilution of coating and immunogold
通过对比,抗原最优包被量为3.75 μg,免疫金稀释度为体积比1∶2.在此条件下,试纸条条带颜色合适并且灵敏度高.
2.6 免疫金与待测液最佳混合比例的确定
将免疫金与待测液按不同比例混合所得结果如图10,颜色越明显,混合比例越合适,最终确定混合比例为1∶5.

混合体积比从左至右依次为1∶10、1∶8、1∶5.图10 免疫金与待测液混合优化结果Fig.10 Optimization results of mixing of immunogold and the solution to be tested
2.7 最低检出限的确定
在最优条件的基础上,将待测液-金标抗体混合液与包被原进行竞争反应.RB标准品质量浓度比色卡如图11所示.可得该试纸条对RB的最低检出限为0.5 ng/mL.

RB质量浓度从上到下依次为:0、0.01、0.1、0.5、1、5、10、20 ng/mL.图11 RB标准品浓度标准比色卡Fig.11 Standard color scale for RB standard concentration
2.8 样品基质的消除
样品提取液用缓冲液成倍数稀释,以缓冲液作空白对照.结果显示,稀释10倍的样品提取液与空白基质加入相同浓度RB溶液后,试纸条显色情况接近,可有效消除色素影响.
2.9 样品添加回收率
分别向辣椒、花椒样品中添加一定质量分数的RB(1、5、10 μg/kg),按1.3.12样品处理方法,提取稀释后进行竞争反应.如图12所示,肉眼观察可知:质量分数不同显色情况不同,质量分数越大,试纸条颜色越深.说明该方法的灵敏度根据待检测物质的质量分数不同而不同,因此可以用于快速检测大量的样本.

图12 试纸对2种样品的添加回收检测结果Fig.12 Test chart of addition and recovery of two samples by strip
3 讨论
RB在相对分子质量的角度上属于小分子物质,然而小分子物质的免疫剂,不能刺激机体产生适应性免疫反应.因此,RB需要与载体(大分子蛋白质分子)连接,获得具有免疫特性的完全抗原.其免疫效果与抗原结构密切相关,半抗原合成方法的选择至关重要,理想的半抗原既能保留其特殊结构又能与载体蛋白结合[18].半抗原与载体蛋白的结合位点不同,合成抗原的免疫效果也不同,同时,有关研究表明半抗原与载体相连的连接臂可在一定程度上提高抗体质量,但连接臂的长度不宜过短或过长,最适长度为3~6个碳原子[19]. 小分子物质通过羧基、氨基或羟基等活性基团与蛋白质相连,然而,RB中不含此类基团,因此不易与天然蛋白质发生偶联现象.R123是RB的衍生物,结构中存在活性基团,与RB具有相同的抗原决定簇.因此,采用R123可制备针对RB的多克隆抗体.在本研究中,利用戊二醛法制备R123完全抗原,使R123与载体蛋白之间存在5个碳原子长的连接臂,此完全抗原在理论上具有较高的免疫特性.
利用竞争抑制法原理制备可检测辣椒、花椒中RB的胶体金试纸条,待测物与T线上的包被抗原共同竞争金标抗体,由于结合顺序不同,只有未与待测物结合的金标抗体才能与包被抗原结合.金标抗体包被抗原的浓度大小对检测信号的强弱和检测灵敏度的大小至关重要.本研究对相关条件进行实验分析,确定最佳抗原包被量为3.75 μg,免疫金最适稀释度为体积比1∶2,金标记抗体与RB标准品溶液或样品提取液最佳混合比例为体积比1∶5,在此条件下检出限为0.5 ng/mL.而Chen等[20]利用高效液相色谱与二极管阵列检测器连用的方法检测辣椒粉、花椒中的RB,检出限仅为0.08 μg/L. Unsal等[21]用HPLC-UV-VIS检测食品、饮料样品中的RB,检出限为3.14 μg/L.与常规标准检测方法相比,胶体金试纸不仅成本低,而且灵敏度较高.而RB在食品中的添加量通常在μg/g水平[22],测试方法要求具备较高的检测灵敏度,因此,胶体金免疫层析法更适合快速检测食品中的RB.
此外,检测调味品中的RB除了检测方法的选择,样品前处理方法的选择也十分重要.样品中复杂的基质类型对检测待测物干扰严重,利用样品前处理,可以减弱基质影响,提高样品中待测物含量.样品前处理方法包括溶剂直接萃取法、液液萃取法[23]、固相萃取法[24]、凝胶净化法[25]等.然而,固相萃取、凝胶净化法等操作复杂,成本相对较高,并不适用现场检测;因此在本研究中选用直接萃取法,使用甲醇作为常用的萃取溶剂萃取溶解样品.为消除背景影响,需要对甲醇溶液进一步稀释,并与空白试剂作对照.实验结果表明当样本稀释10倍时,背景干扰最小,样品前处理效果最佳.
4 结论
本文对辣椒、花椒中的RB进行免疫层析检测技术研究,利用R123成功制备完全抗原和多克隆抗体,在此基础上,对相关实验条件进行优化,最终确定甲醇作为提取液直接萃取辣椒粉、花椒中的RB,稀释10倍后背景干扰最小,抗原包被量为3.75 μg,免疫金稀释度为体积比1∶2. 金标记抗体与RB标准品溶液或样品提取液按体积比1∶5混合时,此胶体金试纸检测效果最好.10~15 min即可得出结果,无需特殊设备,适合大批量产品的现场快速检测.此方法属于定性半定量方法,检出限为0.5 ng/mL,灵敏度满足检测调味料中RB的检测要求,成功建立检测调味品中RB胶体金免疫层析方法.
