纤维素降解木霉菌株的筛选及其生物学特性探究
2022-01-14李婉云杨静雅赵爽李敏赵丽莉贺学礼
李婉云,杨静雅,赵爽,李敏,赵丽莉,贺学礼
(河北大学 生命科学学院,河北 保定 071002)
木质纤维素广泛存在于植物细胞中,是由纤维素、半纤维素和木质素相互交联形成的复杂基质,在自然条件下极难降解[1-2].中国作为世界上中药生产和传统农业产量最大国家,每年产生废弃植物类药渣几千万吨[3]、废弃玉米秸秆2.8×108t[4],此前由于环保意识欠缺,多采用焚烧或堆放方式处理此类木质纤维素废弃物,造成环境严重污染的同时形成了资源的巨大浪费[5-6].为合理利用资源,近年植物废弃有机质粉碎直接还田方式大兴,然而新鲜木质纤维素掺入物腐熟速度慢,过量使用可能导致不良影响[7],如阻碍后茬植物种子发芽、生根,增加病虫害发病风险[8],短期内导致土壤碳氮比失衡,造成植物缺氮[9],阻碍植物根系渗透等[10].因此对天然木质纤维素废弃物进行预处理,加速降解,产生植物可直接利用的小分子化合物,具有重要意义.
传统木质纤维素降解方法包括物理法和化学法,但由于操作困难、成本高、能耗大、易产生环境污染等缺点,不适用于农业生产体系,已逐渐被新型生物降解方法取代.生物降解方法包括酶降解法和生物发酵法.酶降解法依然依赖传统物理、化学方法对木质纤维素废弃物进行预处理,再通过生物发酵方式生产纤维素降解酶,施用于处理后的废弃物,操作相对繁琐且不能规避传统降解方式存在的缺点[11].生物发酵法是将自然环境分离的微生物降解菌株,直接接种到富含木质纤维素的废弃物中进行增殖和产酶,改变木质纤维素的化学成分或结构,拥有更高效、更经济、更环保、对健康危害更小的优点[2],得到广泛研究[12].自然界纤维素降解菌株包括细菌、真菌和放线菌等,其中木霉属真菌(Trichodermaspp.)因生长迅速、培养条件简单、胞外纤维素酶系组成齐全及高效降解木质纤维素的能力成为研究最为广泛的丝状真菌之一[13].
木霉菌在农业生产中的应用已有很长历史,是多种市面销售的土传疾病生防治剂和植物生长促进产品的活性成分[14-15]. 近年来,对于木霉菌纤维素降解领域的研究主要集中于筛选腐生生境降解菌株[7,16-18],利用木质纤维素废弃物生产多种胞外纤维素酶和可再生清洁能源[1,19-20].哈茨木霉(Trichodermaharzianum)及长枝木霉(Trichodermalongibrachiatum)是木霉属中除绿色木霉(Trichodermaviride)和里氏木霉(Trichodermareesei)外研究最为广泛的菌种.黄亚丽等[21]采用纤维素钠-刚果红培养基、秸秆液态培养基联合筛选得到1株耐低温纤维素降解菌T.longibrachiatumSDF-31,接种45 d后,秸秆降解率达到56.73 %.Legodi等[22]从南非多种天然腐殖质中分离得到多株高纤维素酶活性菌株,其中T.longibrachiatumLMLSAUL14-1和T.harzianumLMLBP0713-5总纤维素酶活性分别为8 U/mL和6 U/mL,内切葡聚糖酶活性分别为23 U/mL和16 U/mL.张家麟等[23]采用响应面分析法优化T.harzianumD-8培养基配方,在最佳条件下该菌滤纸纤维素酶(filter paper cellulase,FPase)活性达到5.53 U/mL. 研究表明,菌株来源会显著影响其生态作用,腐生生境来源菌株一般不能与植物形成良好的互作关系,根区微生物组对植物促生及拮抗病原菌作用已有广泛报道[24]. 木霉菌是药用植物根区土壤真菌类群中的优势属之一[25],但目前关于药用植物根区土壤纤维素降解木霉菌株的研究却鲜有报道.贺超等[26]从新疆乌拉尔甘草根际土壤分离到1株T.viride,以甘草药渣为基质固态发酵制备生物有机肥,与深色有隔内生真菌(dark septate endophytes,DSE)联合配施能显著促进甘草生长和有效成分累积.因此筛选药用植物根区土壤纤维素降解木霉菌株,降解天然木质纤维素废弃物制备生物有机肥,符合绿色农业生态理念,有重要意义.
本实验选取分离自河北安国中药材种植基地不同植物根区土壤的木霉菌株,通过羧甲基纤维素钠培养基初筛和玉米秸秆、甘草药渣固态发酵培养基复筛,联合筛选纤维素降解木霉菌株,采用形态学和分子生物学相结合方法进行菌株鉴定,并对其生物学特性进行探究,为后续优化固态发酵培养条件提供依据.
1 材料与方法
1.1 菌株来源
HQ1分离自黄芩(Scutellariabaicalensis)根区土壤;BB1分离自百部(Stemonajaponica)根区土壤;DS1和DS3分离自丹参(Salviamiltiorrhiza)根区土壤;BZL2分离自半枝莲(Scutellariabarbata)根区土壤;GC3分离自甘草(Glycyrrhizauralensis)根区土壤;JYH11分离自金银花(Lonicerajaponica)根区土壤.药用植物根区土样采集自河北安国中药材种植基地.
1.2 培养基配方
PDA培养基:选用北京奥博星生物技术有限公司生产的马铃薯葡萄糖琼脂培养基.
羧甲基纤维素钠培养基:NH4NO31.0 g、KH2PO41.0 g、MgSO4·7H2O 0.5 g、NaCl 0.5 g、羧甲基纤维素钠15.0 g、琼脂20 g,用去离子水定容至1 L.121 ℃灭菌30 min备用.
固态发酵培养基:称取粉碎后玉米秸秆和甘草药渣各5.0 g,分别放入250 mL锥形瓶中,6层纱布封口,121 ℃高压灭菌30 min备用.玉米秸秆购自河北保定周边农户,甘草药渣为经药用成分提取后废弃的甘草根部残渣.2种木质纤维素底物均需水洗风干,经小型药材粉碎机处理,过10目(孔径2.0 mm)筛,密封保存.
1.3 菌株生长曲线测定
用灭菌竹签分别挑取单菌落,点接至PDA培养基上,28 ℃倒置培养,每隔12 h用十字交叉法测量菌落直径,直至菌株长满9 cm培养皿,绘制菌株生长曲线.
1.4 菌株产孢量测定
用灭菌竹签分别挑取单菌落,点接至PDA培养基上,28 ℃倒置培养7 d,待菌株生长产孢情况稳定后,向培养基中加入10 mL无菌水,用灭菌的涂布棒刮下菌落全部孢子,转移至装有玻璃珠的100 mL灭菌锥形瓶中,用封口膜封紧瓶口,置于振荡器上充分震荡均匀,加入适量无菌水稀释孢子液浓度,记录总稀释倍数,用血球计数板测定稀释后孢子悬浮液的孢子浓度,并最终计算菌株产孢量[27].
1.5 产纤维素酶菌株初筛
用灭菌竹签分别挑取单菌落,点接至羧甲基纤维素钠培养基上,28 ℃培养2 d,测量菌落直径;向平板中加入5 mL的10 g/L刚果红溶液染色20 min,弃去染液,再向平板中加入适量1 mol/L的NaCl溶液脱色15 min,测量透明圈直径,并计算其与菌落直径的比值.
1.6 产纤维素酶菌株复筛
分别在玉米秸秆及甘草药渣固态发酵培养基中接种1 mL菌株孢子悬浮液,悬浮液孢子密度为9×106~11×106cfu/mL[28],按料液质量比1∶3.5添加无菌蒸馏水,搅拌均匀,于28 ℃、湿度70%的恒温恒湿培养箱中避光培养5 d[29-30].取1 g发酵基质,按1∶10的质量比添加无菌水稀释,28 ℃、140 r/min振荡浸提1 h,将浸提液于4 ℃、8 000 r/min 离心15 min制得粗酶液,参照标准GB/T 23881—2009测定FPase活性.
1.7 菌株分子鉴定及形态学观察
本实验采用形态学和分子生物学相结合的方法进行菌株鉴定.用灭菌竹签挑取单菌落,点接至PDA培养基中央,将无菌盖玻片45 °插入菌落边缘,于28 ℃恒温培养箱中倒置培养.待菌丝生长至盖玻片上,取下插片于显微镜下观察菌丝特征、产孢结构、孢子形态等微观形态特征.培养7 d后,待菌株生长情况稳定,观察并拍照记录菌落颜色、质地等宏观形态特征[31].然后对菌株进行DNA分子测序.
刮取菌丝或分生孢子10 mg,置于Eppendorf管中,经组织破碎仪研磨后,利用真菌基因组DNA提取试剂盒(北京索莱宝科技有限公司)提取菌丝或孢子DNA,将所得 PCR扩增产物进行测序.将测序所得菌株ITS序列提交至GenBank数据库中,进行BLAST比对,确定菌株种类,后利用 MEGA(6.06)软件(参数设置bootstrap=1 000)的 Neighbor-Joining 算法构建系统发育树.
1.8 菌株生物学特性探究
1.8.1 不同pH对菌株生长和产孢量的影响
用已灭菌1 mol/L HCl和1 mol/L NaOH 溶液调节PDA 培养基 pH至3、4、5、6、7、8、9、10,用灭菌竹签挑取单菌落,点接至不同pH培养基中央,28 ℃培养7 d.在培养第2天测量菌落直径,培养第7天测定菌株产孢量,以下培养条件测定指标和方法相同.
1.8.2 不同温度对菌株生长和产孢量的影响
用灭菌竹签挑取单菌落,点接至PDA培养基中央.将接种供试菌株的培养基分别置于18、23、28、33、38 ℃培养7 d.
1.8.3 不同聚乙二醇质量浓度对菌株生长和产孢量的影响
用聚乙二醇-6000(PEG-6000)调节PDA培养基渗透势为0、-0.45、-0.90、-1.34、-1.79 MPa,对应培养基PEG质量浓度为0、60、120、180、260 g/L.用灭菌竹签挑选单菌落,点接至不同渗透势的PDA培养基中央,28 ℃培养7 d.
1.9 数据分析与处理
实验数据用Excel 2016软件进行整理,SPSS 19.0软件进行单因素方差分析(one-way ANOVA)和独立样本T检验(independent-sample T test).利用R语言4.0.2进行变差分解,分析不同菌种及不同培养条件对木霉菌生长产孢的贡献量.
2 结果与分析
2.1 木霉属真菌生长曲线
所有供试木霉菌株前12 h生长情况相近,生长相对缓慢,在12 h后不同菌株生长速率差异开始体现(图1).HQ1在12~48 h的生长速率明显高于其他菌株;DS3的生长速率在36 h后明显提高,培养60 h率先长满9 cm培养皿;其次为BB1、DS1和GC3,60 h时菌落直径可接近前面2株菌;JYH11和BZL2的生长速度最慢,但所有菌株培养72 h时均可长满9 cm培养皿.

图1 木霉菌生长曲线Fig.1 Growthcurve of Trichoderma strains
2.2 木霉属真菌产孢量
由图2可见,HQ1产孢能力最强,培养7 d产孢量达到3.77×109cfu/mL;其次为DS3、DS1,产孢量接近3×109cfu/mL,3株菌产孢情况未见显著差异.BB1产孢量为2.295×109cfu/mL.GC3、JYH11和BZL2产孢量低于其他4株菌,这可能与菌株生长缓慢有关.

不同字母表示不同菌株产孢量差异显著(P<0.05).图2 木霉菌产孢量Fig.2 Sporulation of Trichoderma strains
2.3 羧基纤维素钠培养基初筛
经过刚果红对羧甲基纤维素钠培养基染色后发现,有4株菌表现出明显的纤维素降解能力,分别为HQ1、BB1、DS3和DS1(图3a-d),其中DS3(图3c)的透明圈直径最大,为5.583 cm,BB1(图3b)的透明圈直径与菌落直径比值最大,为0.925(表1).结合产孢量数据发现,木霉属真菌产纤维素酶能力可能与产孢能力相偶联,产孢量相对较低的菌株皆未表现出纤维素降解能力.

a.HQ1,b.BB1,c.DS3,d.DS1.图3 刚果红染色后木霉菌透明圈结果Fig.3 Transparent circle of Trichoderma strains after staining with Congo red

表1 木霉菌透明圈直径及其与菌落直径比值
2.4 固态发酵不同木质纤维素底物复筛
木质纤维素底物差异会显著影响菌株FPase活性(图4),以玉米秸秆为固态发酵基质,4株菌FPase活性差异相对较小,BB1表现出最高的FPase活性,为0.355 U/mL,显著高于其他3株菌,DS1、DS3和HQ1的FPase活性未见显著差异,都维持在0.32 U/mL左右;以甘草药渣为基质时,HQ1的FPase活性显著高于其他3株菌,为0.272 U/mL,其次是BB1和DS3,分别为0.165 U/mL和0.055 U/mL,DS1则没有表现出FPase活性.结合菌株生长速率和产孢量,选取HQ1和BB1为后续实验的供试菌株.
2.5 菌株分子鉴定及形态学特征
HQ1生长迅速,在培养48 h内开始产孢,产孢量大,产孢区呈同心轮纹排列,暗绿色,偶有白色杂斑点,能产生淡黄色色素,菌落背面随培养时间由无色转为黄绿色;菌丝在光学显微镜下呈现淡绿色,菌丝分支常单生,产孢菌丝主轴长,有次级分支为不规则单生;孢子为深绿色椭圆形,表面光滑,与Bissett[32]、杨合同[31]、孙军等[33]对T.longibrachiatum的形态学描述相符.BB1气生菌丝生长迅速,呈絮状,产孢相对较晚,开始于培养60 h后,产孢区形成于菌落外缘,呈黄绿色,培养前期未见色素产生,菌种老熟后会产生橘黄色色素;菌丝透明,壁光滑,分枝呈直角,多对生;孢子为浅绿色椭圆形,符合张广志[34]、Chaverri等[35]对Trichodermaafroharzianum的形态学描述.结合菌落形态、菌丝形态和DNA分子鉴定(图5-6),HQ1被鉴定为T.longibrachiatum;BB1被鉴定为T.afroharzianum,属于T.harzianum集合种.

图中加粗菌株为本实验测定菌株.图5 基于真菌rDNA ITS序列构建的HQ1和BB1系统发育树Fig.5 Maximum likelihood tree based on rDNA ITS region sequences of HQ1 and BB1

A.BB1,B.HQ1;1-4.分别为菌落形态、菌丝形态、分生孢子梗、分生孢子;Hy.菌丝;Cp.分生孢子梗;Co.分生孢子.图6 BB1和HQ1形态特征Fig.6 Morphological characteristics of HQ1 and BB1
2.6 pH对菌株生长和产孢量的影响
pH由低到高,HQ1和BB1菌落直径和产孢量先升后降,2株菌最佳生长pH均为6,最佳产孢pH分别为5和6,与其他pH处理下生长及产孢结果存在显著差异(图7).在最适环境下,HQ1菌落直径和产孢量均显著高于BB1,极端酸性环境(pH3)会完全抑制2株菌生长,pH4时BB1菌落直径和产孢量显著高于HQ1,表明BB1有更强的酸性胁迫适应性;中碱性环境(pH7~10)BB1菌落直径显著高于HQ1,但HQ1产孢量显著高于BB1,表明碱性环境对HQ1菌丝生长的抑制作用更大,对BB1产孢能力的抑制作用更大.

不同字母表示同一菌株在不同pH下差异显著(P<0.05);*表示不同菌株在同一pH下差异显著;* P<0.05;* *P<0.01(下同).图7 不同培养pH对2株木霉菌生长(a)及产孢量(b)的影响Fig.7 Growth and sporulation of the two Trichoderma strains under different pH treatments
2.7 温度对菌株生长和产孢量的影响
HQ1和BB1最佳生长温度皆为33 ℃,最佳产孢温度分别为28 ℃和33 ℃(图8).2株菌生长及产孢情况在28 ℃和33 ℃不存在显著差异,与其他温度结果都存在显著差异(23 ℃时的BB1菌落直径除外),表明28~33 ℃为2株菌理想的培养温度.随温度升高,2株菌菌落直径和产孢量皆表现为先升后降趋势,低温(18 ℃)显著降低了2株菌菌落直径和产孢量,高温(38 ℃)完全抑制了BB1生长,但对HQ1的影响不如低温显著,表明HQ1较BB1有更强的高温适应能力.

图8 不同培养温度对2株木霉菌生长(a)及产孢量(b)的影响Fig.8 Growth and sporulation of the two Trichoderma strains under different temperature treatments
2.8 不同PEG质量浓度对菌株生长和产孢量的影响
添加PEG后对2株菌生长和产孢显示出显著的抑制作用(图9),随PEG质量浓度升高,2株菌菌落直径均呈逐步降低趋势,除HQ1在PEG质量浓度60 g/L时的菌落直径未见显著减少外,其他处理结果均显著低于正常培养情况,说明轻度干旱条件对2株菌菌丝生长影响较小,但重度干旱可以抑制2株菌菌丝生长;2株菌产孢情况均表现出先降后升再降的趋势,PEG质量浓度60 g/L会显著抑制2株菌产孢,但当PEG质量浓度进一步升高后,2株菌产孢量又显著增加,表明2株菌可能通过增加产孢量应对干旱胁迫.HQ1在PEG质量浓度60、180、260 g/L时的菌落直径以及所有处理下的产孢量均显著高于BB1,表明HQ1较BB1有更强的干旱胁迫适应性.

图9 不同PEG质量浓度对2株木霉菌生长(a)及产孢量(b)的影响Fig.9 Growth and sporulation of the two Trichoderma strains under different PEG mass concentrations
2.9 木霉菌株生长及产孢变差分解
变差分解量化了不同菌种及不同培养条件对木霉菌生长产孢的贡献量(图10),菌种解释了木霉生长及产孢的11.8%;在培养条件中,不同PEG质量浓度解释了木霉生长产孢的29.4%,温度和pH的交互作用共解释了28.9%,不同培养条件间的交互作用共解释了7.9%,说明木霉菌生长速率及产孢情况会受到菌种差异的影响,但更多受培养条件差异影响.
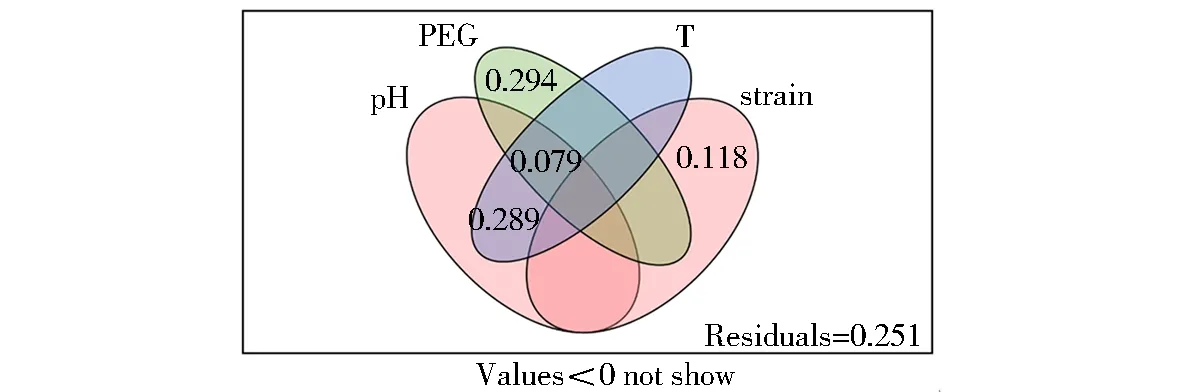
pH.不同培养pH;PEG.不同干旱胁迫程度;T.不同培养温度;strain.不同菌种.图10 菌种及不同培养条件对木霉菌生长及产孢量的变差分解Fig.10 Variation partitioning of different culture conditions and strains on the growth and sporulation of Trichoderma strains
3 讨论
木霉菌属于半知菌亚门丝孢纲丝孢目粘孢菌类,是一类常见于土壤和多种生态环境的丝状真菌,具有拮抗病原菌、促进植物生长、诱导植物抗性和产生胞外木质纤维素降解酶的特性[36-37],利用木霉菌降解木质纤维素是实现废料资源化的重要手段.本实验7株木霉菌经羧甲基纤维素钠培养基初筛,有4株菌表现出纤维素降解能力,分别为HQ1、BB1、DS3和DS1.经不同木质纤维素底物固态发酵培养基复筛发现,BB1以玉米秸秆为发酵基质时FPase活性最高,HQ1以甘草药渣为基质时FPase活性最高.结合菌落形态、显微结构和DNA分子鉴定,HQ1被鉴定为T.longibrachiatum,BB1为T.afroharzianum.2株菌生物学特性存在趋同性,最佳生长产孢pH为5~6,最佳培养温度为28~33 ℃,且都表现出抵御干旱胁迫的能力.
木霉菌产孢能力与生长速度的测定不仅对研究菌株的定殖能力、评价其生防作用有重要意义,也能为研究菌株生态功能提供参考依据[38].透明圈直径与菌落直径比值能在一定程度上代表菌株产胞外纤维素酶活性的高低和降解木质纤维素底物的能力[1],同时考察菌株生长速率、产孢量、透明圈直径与菌落直径比值,能为木霉菌促生生防功能、降解功能协同应用提供参考依据.本实验中,7株木霉菌的生长速率、产孢量、透明圈直径与菌落直径比值存在趋同性,HQ1、BB1、DS3和DS1生长速率快,产孢量大,透明圈直径与菌落直径比值大,表明这4株菌有重要的应用价值.
FPase活性代表菌株降解木质纤维素的总酶活,是表征菌株纤维素降解能力的重要指标之一.本实验供试木霉菌株FPase活性受底物差异影响介于0.05~0.36 U/mL,与前人研究结果接近.Li等[39]从西藏不同天然非腐生样本中分离的11株木霉菌,液态发酵时FPase活性为0.03~0.65 U/mL,其中T.harzianumLZ117 FPase活性最高为0.65 U/mL.Delabona等[40]利用马来西亚热带雨林土壤分离的T.harzianum降解甘蔗渣,FPase活性为0.69 U/mL.赵爽等[29]利用药用植物根区土壤分离的T.virideAG降解不同木质纤维素底物,在最佳培养条件下,FPase活性接近1.6 U/g. 由于本实验固态发酵培养基质和培养条件还未达到最佳水平,因此菌株酶活还有望进一步提高.
研究发现,木质纤维素基质组分差异会对不同菌种产纤维素酶起到不同的诱导效果[41-43]. 本实验中,不同菌株降解玉米秸秆及甘草药渣表现出不同的酶活特性,BB1以玉米秸秆为发酵基质时FPase活性最高,HQ1以甘草药渣为基质时FPase活性最高.这一结果可能与不同木霉菌株对底物适应性不同和2种木质纤维素底物组分含量差异较大有关.玉米秸秆为未经人工处理的天然木质纤维素废弃物,组分含量相对复杂,其纤维素质量分数为44.7%,还原糖质量分数为43.8 mg/g;甘草药渣为经过药用成分提取后剩余的废弃物,还原糖质量分数仅剩0.6 mg/g,纤维素质量分数为48.6%[29],其他菌株生长代谢可利用化合物也较玉米秸秆有明显降低.还原糖是菌株前期生长良好的可利用碳源,但过高的糖含量会形成葡萄糖阻遏效应,限制后续菌株纤维素酶产生,但当基质含糖量过低时,菌株前期生长会受到影响[44].BB1降解玉米秸秆酶活显著高于甘草药渣,HQ1降解2种木质纤维素底物酶活结果差异不显著,表明2株菌生长产酶对碳源的依赖性和对葡萄糖阻遏效应的响应不同.BB1较HQ1生长对易吸收碳源的依赖性更大,且产酶受葡萄糖阻遏效应的影响不明显.
研究表明,木霉菌生长代谢易受培养条件等诸多因素影响[45].本实验中,HQ1和BB1对pH、温度、水分胁迫响应规律趋同,在pH4~9,温度18~33 ℃、轻重度干旱胁迫环境中都可以生长和产孢,表明2株菌有较强的生态适应性,最适培养条件皆为28~33 ℃的弱酸性环境(pH 5~6),以上结果与前人研究成果相似.郭成等[46]研究发现,T.longibrachiatumGAAS L3-1-0.8最佳培养条件为25~30 ℃的偏酸性环境;柯仿钢等[47]报道T.harzianumgz-2菌株最适生长温度为28~30 ℃、最适培养pH为5~6;尹大川等[48]发现T.harzianumT28能耐受中轻度干旱胁迫,重度干旱胁迫可以减少菌丝生物量,但对生长速率无显著影响.温度、水分、pH值等培养条件与生物生长发育密切相关,因此控制了机体的生物代谢反应速率.探究菌种生物学特性,寻找最佳培养条件,可为后续优化HQ1和BB1降解不同木质纤维素底物固态发酵培养条件提供依据.
