腹腔注射α-GalCer对非酒精性脂肪性肝病的影响
2022-01-14梁蕊高翔滕景芳王建国程树杰孟明
梁蕊,高翔,滕景芳,王建国,程树杰,4,孟明
(1.河北大学 基础医学院,河北 保定 071000; 2.河北省炎性自身免疫性疾病发病机制及防治重点实验室,河北 保定 071000; 3.河北大学附属医院 肝胆外科,河北 保定 071000; 4.河北省普通外科数字医学基础研究重点实验室,河北 保定 071000)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是指非酒精摄取因素引起的以肝脏脂肪病变为主要特征的临床病理综合征[1].全球估计有17亿人患NAFLD,患病率约为25%[2-4]. NAFLD的疾病谱包括:单纯性脂肪变性/非酒精性脂肪肝(nonalcoholic fatty liver disease ,NAFL)、非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)、肝硬化(liver cirrhosis)及肝癌(hepatocellular carcinoma,HCC).NAFL的组织学定义为≥5%的肝脏存在脂肪变性,而没有肝细胞损伤.NASH的组织学定义为≥5%的肝脏存在脂肪变性且伴随肝组织学可见的炎症.患者可长期处于NAFL阶段,一旦进展为 NASH 阶段,发生肝纤维化、肝硬化、肝癌的风险明显升高[5-6].
恒定自然杀伤T细胞 (invariant nature kiler T cell,iNKT)是一群兼具NK细胞受体(NK1.1)和T细胞表面受体(TCR)的特殊T细胞群[7].与传统的T细胞不同,iNKT细胞是由抗原提呈细胞表面的MHC I类分子CD1d 提呈的糖脂类抗原激活,激活的iNKT细胞可以分泌抑炎和促炎型细胞因子(IL-4、IL-10、IFN-γ和TNF-α等 ),可与T细胞、B细胞、巨噬细胞、NK细胞、Treg细胞相互作用,在肿瘤、感染和自身免疫性疾病等多种疾病中发挥着重要的免疫调节作用[8-11].
iNKT细胞主要由胸腺中的CD4+CD8+双阳性细胞(DP)发育分化而来.根据转录因子和细胞因子分泌偏向,可分化为3个主要亚群:iNKT1亚群(表达转录因子T-bet,主要分泌IFN-γ)、iNKT2亚群(高表达GATA-3和PLZF,主要分泌IL-4和IL-13)、iNKT17亚群(表达PLZF和RORγt,主要分泌IL-17)[12].α-半乳糖神经鞘胺醇(α-galactosylceramide,α-GalCer)是一种从海绵中提取的iNKT 细胞特异性激活剂[8],可有效激活iNKT细胞,目前已广泛应用于肿瘤、感染和自身免疫病等模型的干预研究[13-15].近来研究表明,iNKT细胞亚群的特异性激活,可有效发挥其免疫调控和免疫治疗作用[16-17].
肝脏富含iNKT细胞,肝脏中iNKT细胞占T淋巴细胞的30%~40%[18].近来研究发现肝脏iNKT细胞在NAFLD的发生发展中扮演着重要角色,但对NAFLD的发生具有促进还是抑制作用仍然存在争议[19].笔者前期研究发现,腹腔注射α-GalCer可以选择性激活主要分泌Th2型抑炎性细胞因子的肝脏iNKT2亚群[20],同时减少了NAFL小鼠肝脏脂肪沉积[21].为验证腹腔注射α-GalCer能否有效改善NASH小鼠肝脏脂肪沉积和炎症反应,笔者采用高脂饮食或蛋氨酸/胆碱缺乏饮食分别喂养C57BL/6J小鼠,构建NAFL和NASH小鼠模型[22].模型构建成功后,给予腹腔注射α-GalCer,观察在不同疾病状态下肝脏iNKT细胞及亚群的变化情况以及其对2种模型小鼠的治疗作用,为NAFLD的免疫学防治提供参考依据.
1 材料与方法
1.1 实验动物
健康雄性C57BL/6J小鼠,4~5周龄,体质量(21.40±0.67)g和8~9周龄,体质量(24.24±0.54)g,北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006.饲养在河北大学医学实验动物中心SPF级动物室.适应性饲养1周后,采用高脂饲料或蛋氨酸/胆碱缺乏饲料分别喂养C57BL/6J小鼠,建立NAFL模型和NASH模型.严格遵守河北大学《实验动物保护条例》,所有实验操作都已经过河北大学动物福利伦理委员会的批准.
1.2 试剂与仪器
高脂饲料(H10060)(许可证号:SCXK(京)2016-0008);蛋氨酸/胆碱缺乏饲料(H10401)(许可证号:SCXK(京)2014-0008),购自北京华阜康生物科技股份有限公司;伊红、苏木素、促蓝液、曙红液购自赫贝科技有限公司;PE-T-selected-CD1d tetramer购自MBL International Woburn MA公司;FITC-Anti-MouseTCR-β(553170),PercP-Cy TM5.5 Mouseanti-T-bet(561316),Alexa Fluor647 Mouse Anti-PLZF(563490)购自BD公司;FoxP3/TranscriPtion Factor Staining Buffer购自eBioscience;α-半乳糖神经鞘胺醇(α-GalCer)购自ENZO Life Sciences;小鼠脏器组织淋巴细胞分离液试剂盒,购自Solarbio生物科技有限公司;OlymPusBX50光学显微镜(OlymPus公司);流式细胞仪Accuri C6 (BD 公司);COBAS6000 型全自动生化仪(德国罗氏诊断公司);TB-718E型生物组织自动包埋机(泰维科技有限公司);TK-218型恒温摊片烤片机(泰维科技有限公司);RM2255生物组织自动切片机(上海徐卡显微系统有限公司).
1.3 实验方法
1.3.1 动物分组
随机选取20只小鼠(4~5周龄和8~9周龄各10只)作为空白对照组,喂食标准饲料.随机选取20只4~5周龄小鼠喂食高脂饮食12周作为HFD组; 随机选取20只8~9周龄小鼠喂食蛋氨酸/胆碱缺乏饮食6周作为MCD组.模型构建成功后,分别从高脂饮食或蛋氨酸/胆碱缺乏饮食喂养的小鼠中各自随机选取10只腹腔注射α-GalCer (100 ng/g).3 d后,小鼠腹腔注射质量分数1% 苯巴比妥(50 mg/kg),深度麻醉状态下,摘眼球取血,脱颈椎处死进行后续实验.
1.3.2 小鼠状态评估
每周动态监测小鼠质量,每天观察小鼠活动情况、精神状态及毛发光泽度.
1.3.3 血清生化指标分析
小鼠深度麻醉状态下,摘眼球取血,离心取上层血清,全自动生化分析仪检测血清中总胆固醇(TCH),甘油三酯(TG),高密度脂蛋白(HDL),低密度脂蛋白(LDL),谷氨酸氨基转移酶(ALT),门冬氨酸氨基转移酶(AST)的含量.
1.3.4 肝脏外观、肝脏指数和肝脏H&E染色
小鼠深度麻醉状态下,脱颈椎处死,解剖分离肝脏,PBS清洗后,对小鼠肝脏进行称重,计算肝脏指数.肝脏指数=肝脏质量(mg)/体质量(g).
取肝脏相同部位组织,经福尔马林溶液固定及常规H&E染色后,通过光镜进行病理学检测.
1.3.5 流式细胞术检测肝脏iNKT频率
小鼠肝脏在预冷的PBS中剪碎、研磨,过74 μm细胞筛,制成单细胞悬液.细胞经PBS洗涤离心2次(4 ℃、1 000 r/min、5 min)后,利用小鼠脏器淋巴细胞分离液分离淋巴细胞.分离得到的淋巴细胞再经PBS洗涤离心2次(4 ℃、1 000 r/min、5 min)并计数,取1×106个细胞置于干净的流式管中,用FITC标记的Anti-TCRβ、PE标记的负载α-GalCer的CD1d四聚体(α-GalCer/CD1d tetramers)进行染色,4 ℃避光孵育30 min后,经流式细胞仪检测iNKT细胞频率.α-GalCer/CD1d tetramers为本实验室制备:体积分数0.5%Tween-20和质量分数0.9%NaCl将1 mg/mL的α-GalCer稀释至200 μg/mL,每100 μL CD1d Tetramer中加入5 μL稀释后的α-GalCer,室温孵育12 h,4 ℃储存.
1.3.6 流式细胞术检测肝脏iNKT1、iNKT2亚群频率
同1.3.5小节,上述分离的淋巴细胞,经FITC标记的Anti-TCRβ、PE标记的负载α-GalCer的CD1d四聚体(α-GalCer/CD1d tetramers)进行染色后,依据FoxP3/TranscriPtion Factor Staining Buffer的具体操作步骤对细胞进行透化固定处理,随后加入1 μL PerCP-CyTM5.5 Mouse anti-T-bet和1 μL Alexa Fluor® 647 Mouse Anti-PLZF,4 ℃避光孵育30 min,PBS清洗2次,500 μL PBS重悬细胞,流式细胞仪检测iNKT1和iNKT2亚群频率.
1.4 统计学分析

2 结果
2.1 小鼠外观及体重变化
与对照组比较,高脂饮食喂养的小鼠体质量逐渐上升,体型肥胖,皮下脂肪含量增多,喂养12周后,达到肥胖的标准(BMI>20%)(图1a、b),蛋氨酸/胆碱缺乏饮食喂养的小鼠体质量逐渐下降,体型消瘦,皮下脂肪含量减少(图1c,1d).

a. 正常饮食及 HFD组小鼠外观;b. 正常饮食及 HFD组小鼠体质量变化曲线;c. 正常饮食及 MCD组小鼠外观;d. 正常饮食及 MCD组小鼠体质量变化曲线.图1 2组饮食喂养的小鼠外观及体质量变化Fig.1 Appearance and body weight of mice fed with high-fat diet or methionine/choline deficiency diet
2.2 血清生化指标
与对照组比较,高脂饮食喂养的小鼠血清中TCH、HDL、LDL及ALT的浓度水平均显著升高(P<0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠血清中TCH、TG及LDL的浓度水平均显著降低(P<0.05).而ALT和AST的浓度水平显著升高(P<0.05).与模型组比较,腹腔注射α-GalCer后,高脂饮食喂养的小鼠血清中TCH、HDL及LDL的浓度水平均显著降低(P<0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠血清中ALT和AST的浓度水平显著升高(P<0.05)(图2a、b).

a.高脂饮食喂养的小鼠;b.蛋氨酸/胆碱缺乏饮食喂养的小鼠.图2 腹腔注射α-GalCer对不同饮食喂养的小鼠血清中TCH、TG、HDL、LDL、AST、ALT水平的影响Fig.2 Effects of intraperitoneal injection of α-GalCer on serum TCH, TG, HDL, LDL,AST, ALT level of mice fed with different diets
2.3 肝脏外观、肝脏指数和肝脏组织病理学变化
对照组小鼠肝脏颜色暗红,表面光滑,边缘锐利,质韧;高脂饮食喂养的小鼠肝脏体积增大,外观呈淡黄或奶油黄色,略白,表面有细小颗粒感,肿大易碎,边缘较钝,切面略带油腻感;蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏色泽暗淡,泛黄,质地尚软,触之有颗粒感.腹腔注射α-GalCer后,高脂饮食喂养的小鼠肝脏色泽偏粉,而蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏边缘发生红肿(图3a、d).
与对照组比较,高脂饮食喂养的小鼠肝脏指数无明显变化(P>0.05),而蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏指数明显增大(P<0.05).和模型组比较,腹腔注射α-GalCer后,高脂饮食喂养的小鼠肝脏指数仍无明显变化(P>0.05),而蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏指数进一步增大,但差异无统计学意义(P>0.05) (图3b、e).
H&E染色结果表明,对照组小鼠肝细胞大小和形态正常,肝索排列整齐,肝小叶结构正常,高脂或蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏中出现大量脂肪空泡,肝细胞胞质中脂质累积,出现肝脏脂肪变性,且蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏中除存在脂肪变性外,还有明显的炎细胞浸润.腹腔注射α-GalCer后,2种饮食喂养的小鼠肝脏脂肪变性均有所改善,而蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏中炎细胞浸润进一步加重(图3c,f).
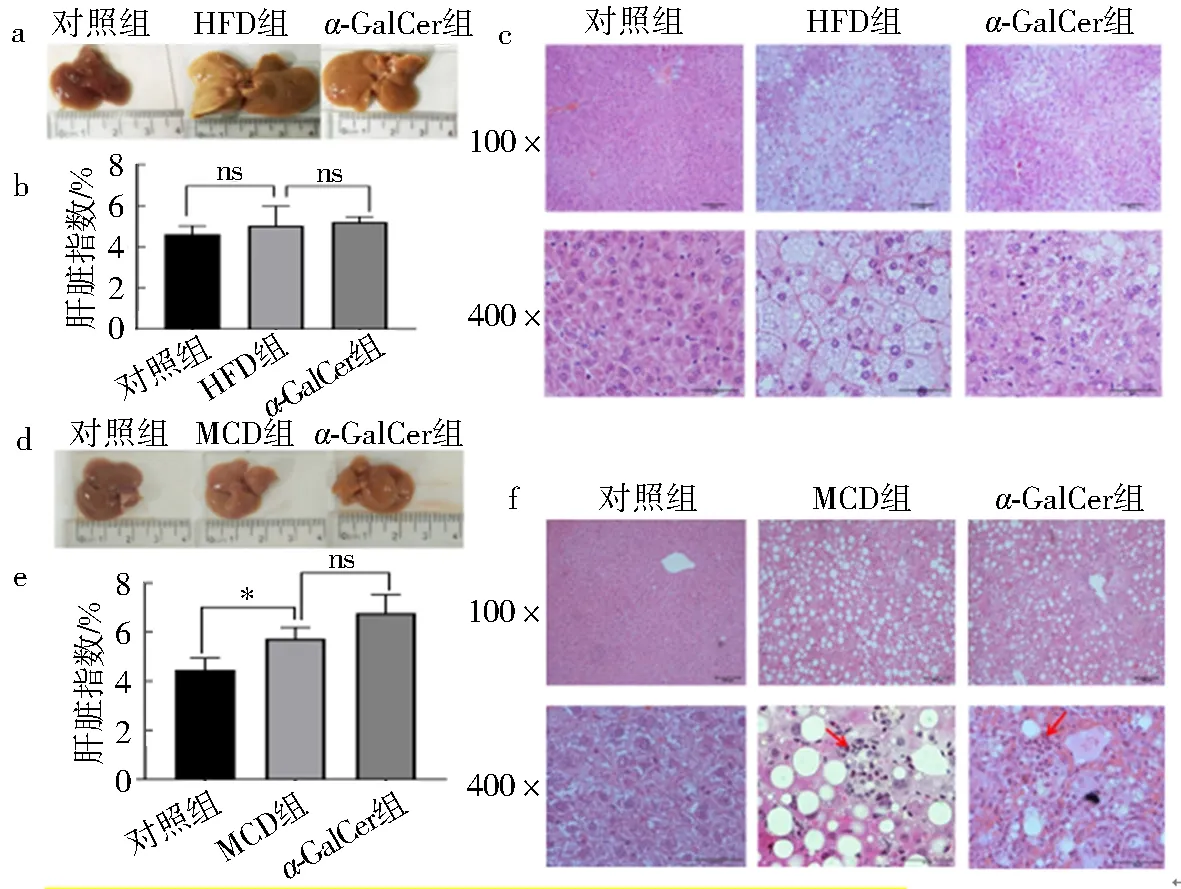
a. HFD组小鼠肝脏外观;b. HFD组小鼠肝脏指数变化;c. HFD组小鼠肝脏病理变化;d.MCD组小鼠肝脏外观;e. MCD组小鼠肝脏指数变化;f. MCD组小鼠肝脏病理变化.(100×∶100倍视野,400×∶400倍视野;红色箭头所示炎细胞浸润).图3 腹腔注射α-GalCer 对不同饮食喂养的小鼠肝脏外观、肝脏指数及病理学改变Fig.3 Effects of intraperitoneal injection of α-GalCer on liver appearance liver index and pathological changes in mice fed with different diets
2.4 腹腔注射α-GalCer对2种饮食喂养的小鼠肝脏iNKT频率的影响
与对照组比较,高脂饮食喂养的小鼠肝脏iNKT频率明显降低(P<0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT频率明显升高(P<0.05).与模型组比较,腹腔注射α-GalCer后,高脂饮食喂养的小鼠肝脏iNKT频率明显升高(P<0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT频率明显下降(P<0.05)(图4a-c).

a.HFD和MCD组小鼠肝脏iNKT频率的散点图;b和c.HFD和MCD组小鼠肝脏iNKT频率的统计图.图4 腹腔注射α-GalCer明显影响HFD组或MCD组小鼠肝脏iNKT细胞的频率Fig.4 Frequency of iNKT cells in the liver of mice fed with HFD or MCD diet was significantly affected by intraperitoneal injection of α-GalCer
2.5 腹腔注射α-GalCer对2种饮食喂养的小鼠肝脏iNKT亚群的影响
与对照组比较,高脂饮食喂养的小鼠肝脏iNKT1亚群比例明显升高(P<0.05),iNKT2亚群比例升高,但没有统计学意义(P>0.05)(图5a-c),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT1亚群比例明显升高(P<0.05),iNKT2亚群比例明显下降(P<0.05)(图5a,d,e).和模型组比较,腹腔注射α-GalCer后,高脂饮食喂养的小鼠肝脏iNKT1亚群比例明显下降,iNKT2亚群比例明显升高(P<0.05)(图5a-c),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT1亚群比例升高,但无统计学意义(P>0.05),iNKT2亚群比例也明显升高(P<0.05),但是以iNKT1亚群为主(图5a,d,e).
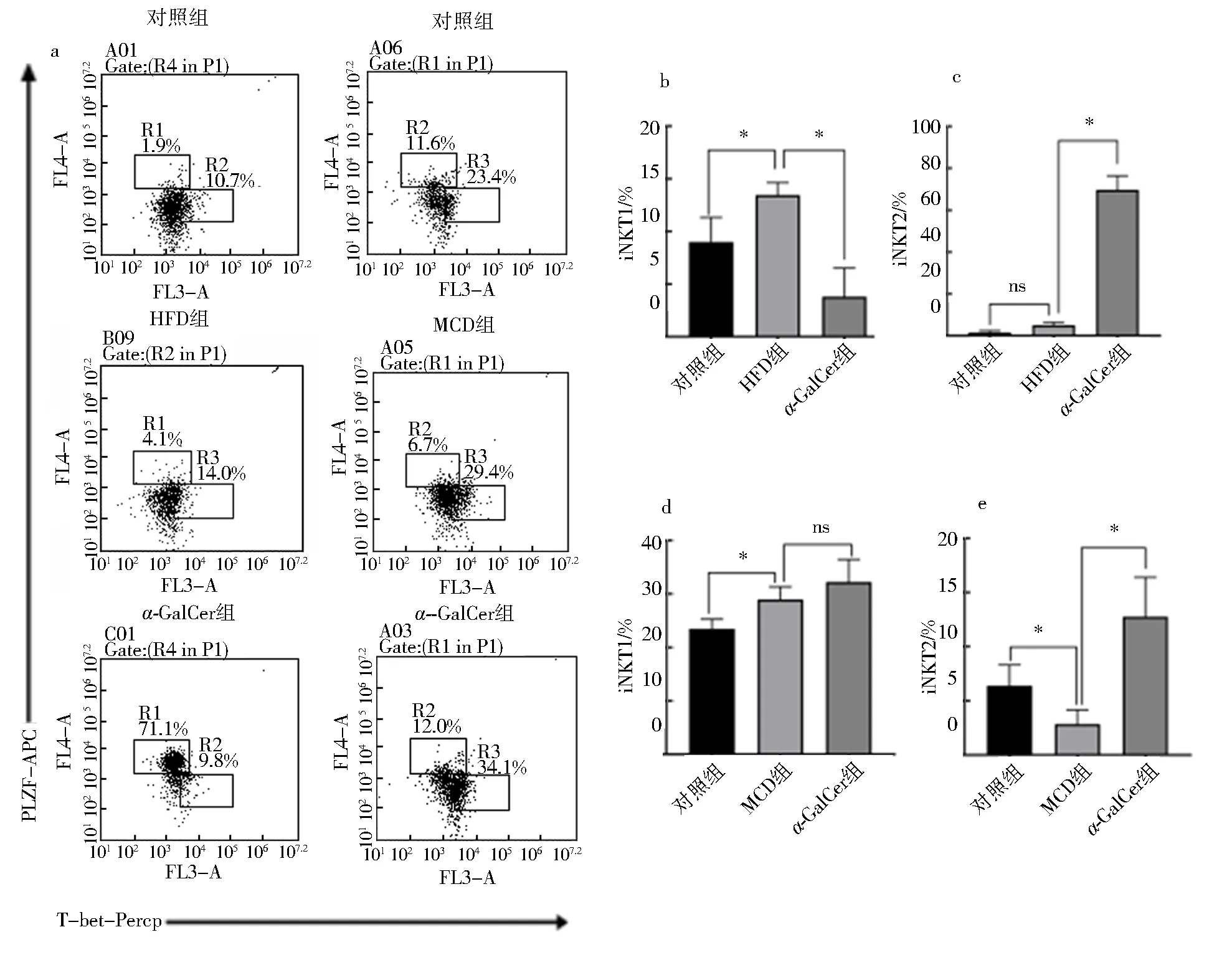
a.HFD和MCD组小鼠肝脏iNKT亚群频率的散点图;b、c、d、e.HFD和MCD组小鼠肝脏iNKT亚群频率的统计图.图5 腹腔注射α-GalCer明显影响HFD组或MCD组小鼠肝脏iNKT细胞亚群的分布Fig.5 Frequency of subsets of iNKT cells in the liver of mice fed with HFD or MCD diet was significantly affected by intraperitoneal injection of α-GalCer
2.6 腹腔注射α-GalCer对2种饮食喂养的小鼠肝脏iNKT1/iNKT2比值的影响
与对照组比较,高脂饮食喂养的小鼠肝脏iNKT1/iNKT2比值有降低趋势,但无统计学意义(P>0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT1/iNKT2比值也有降低趋势,但无统计学意义(P>0.05).和模型组比较,腹腔注射α-GalCer后,高脂饮食喂养的小鼠肝脏iNKT1/iNKT2比值进一步降低,但无统计学意义(P>0.05),蛋氨酸/胆碱缺乏饮食喂养的小鼠肝脏iNKT1/iNKT2比值有降低趋势,但无统计学意义(P>0.05)(图6a-b).

图6 腹腔注射α-GalCer对HFD(a)或MCD(b)组小鼠肝脏iNKT1/iNKT2比值的影响Fig.6 Effect of intraperitoneal injection of α-GalCer on the ratio of liver iNKT1/iNKT2 in HFD(a) or MCD(b) group
3 讨论
利用高脂饮食或蛋氨酸/胆碱缺乏饮食喂养小鼠是构建NAFLD动物模型常用的方法.蛋氨酸/胆碱缺乏饮食喂养的小鼠造模周期短,肝脏炎症反应明显,但不太符合人类NAFLD发生的特点.而高脂饮食喂养的小鼠造模周期长,与人类NAFLD的自然发生相似[23-24].本研究分别采用高脂饮食或蛋氨酸/胆碱缺乏饮食喂养小鼠建立NAFL和NASH 2种动物模型,结果发现,NAFL小鼠体质量明显增加,体脂含量也增加,而NASH小鼠体质量明显下降,体脂含量也降低.肝脏指数的比较结果表明,NAFL小鼠肝脏指数有上升趋势,但是没有统计学意义,而NASH小鼠肝脏指数明显增大,与Sung-Bae K和Ikawa-Yoshida A等[25-26]的报道一致,这可能由于NASH小鼠体质量明显下降,NAFL小鼠体质量明显上升所致.病理结果显示,NAFL小鼠肝细胞中有大量的脂肪空泡和肝脏大面积脂肪变性,而未出现炎细胞浸润;NASH小鼠肝细胞中也出现脂肪空泡和肝脏脂肪变性,并伴有大量炎细胞浸润.血生化指标显示,NAFL小鼠血清中TCH、HDL及LDL水平升高,ALT也升高,而NASH小鼠血清中TCH、TG、LDL水平降低,AST和ALT水平升高.这些结果表明,NAFL显示出单纯的肝脏脂肪变性,而NASH在肝脏脂肪变性的基础上出现了炎症反应.
随后笔者观察腹腔注射α-GalCer对模型组肝脏iNKT频率和亚群的作用以及对其他监测指标的影响.流式细胞术检测发现,腹腔注射α-GalCer提高了NAFL小鼠肝脏iNKT频率,明显增加了iNKT2亚群比例.此外,腹腔注射α-GalCer后,可明显改善NAFL小鼠肝脏脂肪变性,降低NAFL小鼠血清中TCH、HDL、LDL和ALT水平.这些结果表明,腹腔注射α-GalCer,激活了肝脏iNKT2亚群,有效改善了肝脏脂肪沉积.而同样是腹腔注射α-GalCer却明显增加了NASH小鼠肝脏iNKT1亚群比例,iNKT2亚群比例升高的并不明显;NASH小鼠肝脏的病理染色结果在腹腔注射α-GalCer后同样显示了肝脏脂肪沉积减少,但却出现了炎细胞浸润的加剧;血生化结果也出现了转氨酶水平的升高.据此笔者推测:腹腔注射α-GalCer通过激活肝脏iNKT2亚群改善了NAFL和NASH小鼠肝脏脂肪沉积,通过激活肝脏iNKT1亚群加重了NASH小鼠肝脏炎症反应.
同样腹腔注射α-GalCer,NAFL小鼠主要激活肝脏iNKT2亚群,而NASH小鼠激活的主要是iNKT1亚群,这可能是NAFL和NASH小鼠肝脏局部微环境的不同影响了iNKT亚群的差异性激活,其机制有待深入研究.该结果提示,腹腔注射α-GalCer激活的iNKT细胞在NAFLD发病不同阶段可能发挥着截然不同的作用.有研究显示,在可逆的NAFL阶段,NKT细胞可以改善NAFLD病情,当炎症出现,即NASH阶段时,iNKT细胞加剧NAFLD的发展[27].这与NAFLD不同阶段肝脏iNKT细胞不同亚群的激活密切相关.肝脏iNKT1亚群的激活,通过释放致炎性细胞因子直接或间接促进了肝脏的炎症反应;而肝脏iNKT2亚群的激活,有利于改善肝脏脂代谢,从而减轻肝细胞的脂质堆积.Szczepankiewicz等[28]的研究结果表明,成熟大鼠脂肪细胞中IL-4可以刺激脂肪生成并抑制脂肪分解.相关研究还指出,暴露于Th2型细胞因子(如IL-4)的脂肪组织可以诱导M2型巨噬细胞的增殖,而暴露于Th1型细胞因子(如TNF-α)则抑制了它们的增殖[29]. iNKT2亚群激活如何改善肝脏脂代谢,笔者推测可能是iNKT2细胞通过释放IL-4直接影响脂代谢相关通路或通过使M2型巨噬细胞极化间接调控脂代谢,详细的作用机制需要进一步研究.
肝脏作为机体重要的免疫和代谢器官,其免疫微环境是维持正常功能的重要因素.充分考虑肝脏组织微环境在免疫调控中的作用,利用肝脏免疫微环境的协同作用是未来治疗NAFLD的一种新策略.
