熊果酸抗肝纤维化作用与Ang Ⅱ/AT1R 信号通路的相关性
2022-01-12万思哲
陈 涛 刘 聪 万思哲 朱 萱▲
1.江西省抚州市第一人民医院消化内科,江西抚州 344099;2.南昌大学第一附属医院消化内科,江西南昌 330006
肝纤维化是各种病因(如病毒、血吸虫、酒精、非酒精性脂肪性肝炎、胆汁淤积、自身免疫性肝病等)引起肝损伤后细胞外基质(extracellular matrix,ECM)弥漫性过度沉积与瘢痕形成的病理过程,是肝脏对慢性损伤的病理修复反应[1-2]。肝纤维化的持续发展最终可导致肝硬化甚至肝癌,严重危害人类健康[3-4]。Marcellin 等[5-6]研究发现,早期对肝纤维化进行药物干预可逆转肝纤维化,从而降低死亡率。 在肝纤维化的发生和发展过程中,Ang Ⅱ被认为是重要的促纤维化因子之一,Sahara 等[7]研究发现Ang Ⅱ可以通过作用于 AT1R,诱导I 型胶原的合成,从而促进肝纤维化的发生发展。
中药单体熊果酸(ursolic acid,UA)是一种五环三萜羧基酸类化合物,具有保护肝脏功能、抗菌、抗癌、抗氧化和抗炎等药理活性[8-11]。 本课题组前期研究成果表明,UA 可能通过抑制NOX4/ROS 和RhoA/ROCK1信号通路,减少C57BL/6 野生型小鼠的肝脏内胶原沉积[12]。因此,本研究将进一步探讨UA 减少肝脏内胶原沉积是否与其抑制肝脏Ang Ⅱ/AT1R 信号通路有关,阐明UA 的抗肝纤维化分子机制,为其应用于肝纤维化治疗提供实验和理论依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂 UA(Sigma-Aldrich 公司);培哚普利(MedChemExpress 公司);血清谷草转氨酶(aspartate aminotransferase,AST)、谷丙转氨酶(alanine aminotransferase,ALT)、总胆红素(total bilirubin,TBil)检测试剂盒(武汉伊莱瑞特生物科技有限公司);BCA 蛋白浓度测定试剂盒(碧云天生物科技公司);天狼星红染色试剂盒(北京索莱宝科技有限公司);4%的多聚甲醛固定液(北京索莱宝科技有限公司);mRNA 引物(生工生物工程上海股份有限公司);总RNA 提取试剂盒、cDNA 第一链合成试剂盒、荧光定量PCR 试剂盒(北京天根生化科技公司);兔抗鼠Ang Ⅱ多克隆抗体(英国Abcam 公司);兔抗鼠AT1R 多克隆抗体(英国Abcam 公司)、兔抗鼠Ⅰ型胶原蛋白(Collagen-Ⅰ)多克隆抗体(英国Abcam 公司)、兔抗鼠α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)多克隆抗体(英国Abcam 公司);辣根过氧化物酶标记山羊抗兔IgG(北京中杉金桥有限公司);橄榄油(上海易恩化学技术有限公司);脱脂奶粉(北京索莱宝科技有限公司)。
1.1.2 实验动物 所有的SPF 级雄性纯系8 周龄SD大鼠40 只均从南昌大学动物科学部购入,体重(200±10)g,将大鼠置于光照/暗循环 12 h/12 h,室温(22±2)℃,湿度(55±5)%的环境中饲养,自由饮食和饮水。动物许可证号:SYXK(赣)2015-0001。 本实验符合国家及南昌大学实验动物中心规定的伦理学要求。
1.2 方法
1.2.1 大鼠分组及处理 将40 只SD 大鼠随机分为为对照组、模型组、培哚普利组、UA 干预组,每组10 只。对照组:橄榄油(2 ml/kg)灌胃 8 周,每周 2 次。 模型组:20%的四氯化碳(carbon tetrachloride,CCl4)溶液溶解于橄榄油中 2 ml/kg,灌胃 8 周,每周 2 次。 UA 干预组:CCl4溶液灌胃8 周,并在最后4 周同时给予UA,40 mg/(kg·d)灌胃。 培哚普利组:CCl4溶液灌胃 8 周,并在最后 6 周同时给予培哚普利,8 mg/(kg·d)灌胃。各组药物处理结束72 h 后,每组大鼠在乙醚麻醉下,使用一次性真空采血管留取门脉血待用, 取下肝脏,留取部分新鲜肝脏组织待用, 将其余组织固定于4%多聚甲醛固定液中,常规脱水包埋。 本实验所有程序均按照美国国立卫生研究院的《护理和使用实验动物指南》[13]执行。
1.2.2 HE 染色及天狼星红染色 新鲜的大鼠肝脏组织用4%的多聚甲醛固定,进行脱水和石蜡包埋处理,将控制切片厚度为6 μm,常规脱蜡。对切片使用苏木精和伊红染色, 中性树胶封片, 显微镜下观察, 采用METAVIR 评分系统[14]对切片进行评分,共分为4 个纤维化等级,F0:无纤维化;F1:门脉区纤维面积增大,未见隔膜形成;F2:门脉区纤维面积增大,少数隔膜形成;F3:多发隔膜形成,无肝硬化;F4:肝硬化。天狼星红染色液滴染1 h,Mayer 苏木精染色液染细胞核8 min,流水冲洗10 min。常规脱水透明,中性树胶封片,显微镜下观察肝脏内胶原沉积。
1.2.3 大鼠 AST、ALT、TBil 测定 在酶标板中加入100 μl 标准品或者待测样品,37℃孵育 90 min; 弃掉板内液体后,每孔加入100 μl 生物素抗体工作液,37℃孵育 60 min;洗涤 3 次后,每孔加入 100 μl HRP 酶结合物工作液,37℃孵育30 min;弃掉板内液体,洗板5次,每孔加入 90 μl 底物溶液,37℃孵育 15 min;每孔加入50 μl 终止液终止反应,随后在450 nm 波长下测量各孔的光密度(optical density,OD)值并处理数据。
1.2.4 Ang Ⅱ、AT1R、Collagen Ⅰ及 α-SMA mRNA表达的检测 分别从四组大鼠中获取约100 mg 肝组织,将组织在液氮中磨碎,并使用匀浆仪进行匀浆处理,4℃,12 000 r/min,5 min,转移上清至一个新的无核酶的离心管中,加入200 μl 氯仿,剧烈振荡15 s,经4℃,12 000 r/min 离心 10 min,样品分为 3 层,将水相中的RNA 转移至一个新的无核酶的离心管中, 将无水乙醇、500 μl 去蛋白液 RD、500 μl 漂洗液 RW 分批分次加入吸附柱CR3 中,加入50 μl 无核酶水后,经4℃,12 000 r/min 离心 2 min,获得 RNA。琼脂糖凝胶电泳鉴定RNA 完整性,NanoDrop One 型号核酸微量检测仪(Thermo)测定 RNA 浓度。 使用 cDNA 第一链合成试剂盒将RNA 逆转录成cDNA。随后以cDNA 为模板进行实时定量聚合酶链反应(quantitative realtime polymerase chain reaction, qRT-PCR), 每个样本设3 个复孔,记录每个组织样本各指标的循环数计为Ct 值,以 2-ΔΔCt值计算相对表达量。 引物序列见表 1。

表1 RT-qPCR 引物序列
1.2.5 Ang Ⅱ、AT1R、Collagen Ⅰ及 α-SMA 蛋白表达检测 采用Western blot 检测,通过总蛋白提取试剂盒提取肝脏总蛋白,BCA 法测定蛋白浓度。 配置10%SDS-聚丙烯酰胺凝胶进行电泳,实验条件为80 V、1 h,分离胶120 V、2 h。电泳分离蛋白后,将蛋白转移至硝酸纤维素膜(NC 膜)上,用5%脱脂奶粉于室温中封闭 1.5 h。 将 NC 膜分别与抗 Ang Ⅱ(1:1000)、抗AT1R(1:1000)、抗 α-SMA(1:1000)、抗 Collagen Ⅰ(1:1000)稀释液和抗GAPDH(1:1000)稀释液放置于摇床,4℃孵育过夜。 次日取出后,用TBST 洗膜3 次,每次5 min。洗膜结束后与辣根过氧化物酶标记山羊抗兔IgG 稀释液(1:5000)4℃孵育5 h,滴加化学发光显色液,iB-rightTMFL1500 凝胶成像仪(Thermo)曝光、显像,采用Image Lab 软件(BioRad)分析条带灰度值,以目的条带与内参GAPDH 条带灰度值的比值作为目的蛋白的相对表达量。
1.3 统计学方法
数据分析采用SPSS 25.0 软件, 使用 GraphPad Prism 7.0 软件进行图像制作和输出。 每次实验重复3次确保结果可信度。 多组间比较采用单因素方差分析,组间两两比较采用LSD-t 检验,以P<0.05 为差异有统计学意义。
2 结果
2.1 四组大鼠肝脏结构的比较
模型组比对照组出现更严重的肝脏肝小叶结构紊乱,肝索排列紊乱,大量炎症细胞浸润,胶原沉积明显,提示肝纤维化动物模型构建成功。 培哚普利组和UA 干预组的肝小叶结构, 肝细胞坏死程度低于模型组(图 1,封三)。

图1 肝脏 HE 染色(100×)及天儿狼星红染色(100×)
2.2 四组大鼠肝脏肝纤维化METAVIR 评分的比较
模型组的METAVIR 评分高于对照组、培哚普利组和 UA 干预组,差异有统计学意义(P<0.05)(图 2)。
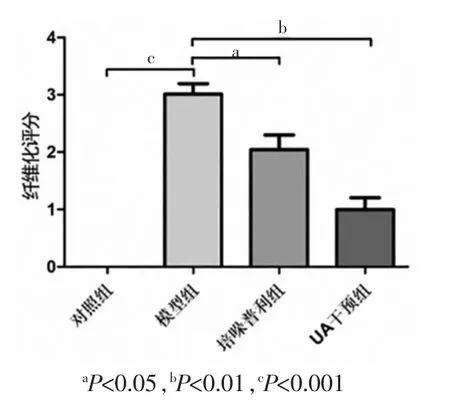
图2 各组大鼠肝脏肝纤维化METAVIR 评分
2.3 四组大鼠血清 AST、ALT、TBil 水平的比较
模型组的AST、ALT、TBil 水平高于对照组、培哚普利组和 UA 干预组,差异有统计学意义(P<0.05)(图3)。
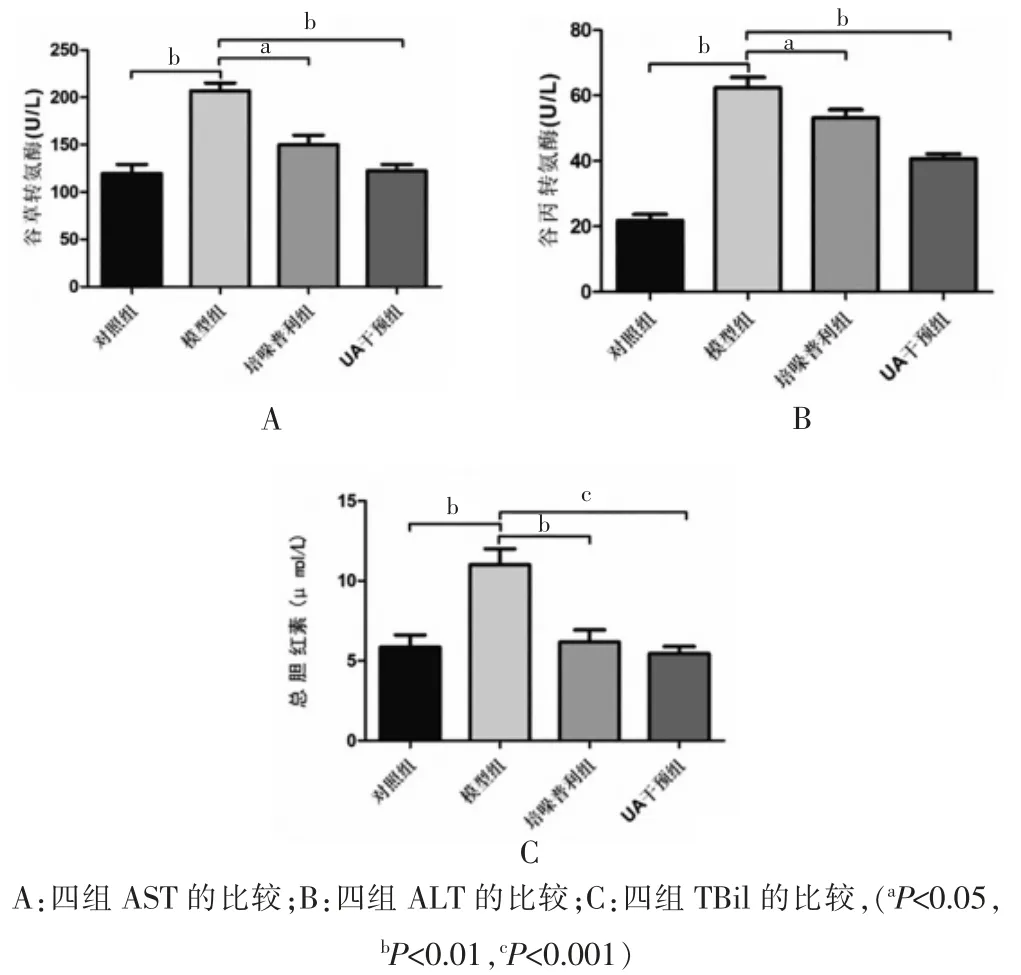
图3 四组大鼠血清AST、ALT、TBil 表达的比较
2.4 四组大鼠肝组织 Ang Ⅱ、AT1R、Collagen Ⅰ及α-SMA 蛋白 mRNA 表达的比较
模型组的 Ang Ⅱ、AT1R、Collagen Ⅰ及 α-SMA蛋白mRNA 表达高于对照组、培哚普利组和UA 干预组,差异有统计学意义(P<0.05)(图 4、5)。
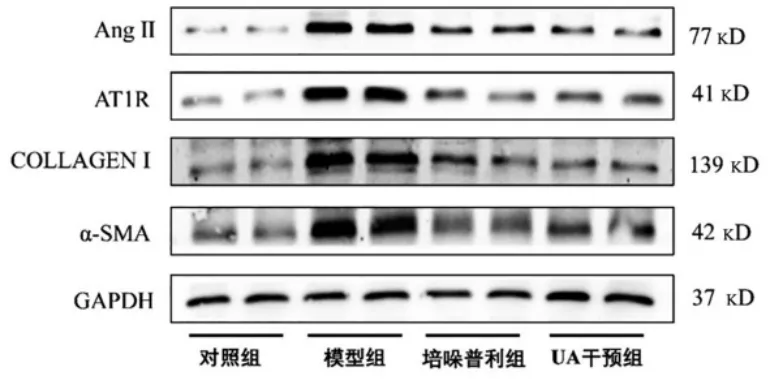
图4 各组大鼠肝组织 Ang Ⅱ、AT1R、Collagen Ⅰ及 α-SMA 蛋白表达的比较
3 讨论
UA 作为具有潜力的抗纤维化药物, 已被证实可以通过阻断氧化应激和脂质过氧化,进而抑制星状细胞活化,逆转肝纤维化[15],但涉及其中的具体分子机制尚未完全阐明。 本课题组长期致力于UA 抗纤维化的机制研究, 前期大量研究成果表明UA 能显著抑制瘦素、Ang Ⅱ、血小板衍生生长因子(platelet derived growth factor,PDGF)诱导的肝星状细胞 NADPH 氧化酶及其亚基表达,减少活性氧簇生成[16];并且阻断促肝纤维化因子诱导的 PI3K/Akt、P38MAPK、ERK1/2信号通路活化[17],抑制肝星状细胞增殖,促进其凋亡,减少 I 型胶原的生成[18]。Collagen Ⅰ及 α-SMA 是反映肝脏纤维化的经典指标,二者与肝纤维化严重程度成正比,在本研究中,模型组的Collagen Ⅰ及α-SMA 表达高于对照组, 表明大鼠肝纤维化模型造模成功;另外, 培哚普利组和 UA 干预组的 Collagen Ⅰ及 α-SMA 表达均低于模型组,与课题组之前的研究结果一致,表明UA 具有抗肝纤维化作用。

图5 各组大鼠肝组织Ang Ⅱ、AT1R、Collagen Ⅰ及α-SMA mRNA表达的比较
Ang Ⅱ是肾素-血管紧张素-醛固酮系统(Reninangiotensin-aldosterone system,RASS) 的主要活性成分。 Ang Ⅱ由血管紧张素原将肾素分解生成Ang Ⅰ后,再经过血管紧张素转换酶转化生成,最终Ang Ⅱ作用于AT1R,发挥收缩血管、促进细胞增殖和炎症反应等生物学功能[19]。 Bataller 等[20]研究发现,在大鼠体内输注Ang Ⅱ后,会加重肝脏炎症、氧化应激和血管损伤等严重程度,进而导致肝纤维化的发生发展。 进一步研究表明,Ang Ⅱ是通过与AT1R 结合, 诱导高水平的促炎和促纤维化细胞因子的分泌,从而使肝星性状细胞活化,加重肝脏损伤[21-22]。 本研究表明,在CCl4 诱导的肝纤维化大鼠肝内,Ang Ⅱ和AT1R 表达显著上升,然而在对肝纤维化大鼠进行了培哚普利处理后,伴随着Ang Ⅱ和AT1R 的下降,肝纤维化也出现了缓解, 结果再次证实了Ang Ⅱ在肝纤维化进展中的重要作用。
UA 是否通过靶向Ang Ⅱ发挥抗纤维化作用尚未被证实。为此,对CCl4 诱导的肝纤维化大鼠给予UA灌胃处理后,Ang Ⅱ和AT1R 的表达都出现了明显下降, 并且肝纤维化得到缓解。 上述实验结果表明UA可能通过抑制Ang Ⅱ/ AT1R 信号通路, 进而改善肝纤维化。
本实验以SD 大鼠为实验模型,进行体内实验验证UA 的抗纤维化机制。 然而,肝脏中具有肝细胞、库普弗细胞、肝窦内皮细胞、肝导管上皮细胞、肝脏间质细胞等多种细胞,UA 具体是通过其中的一种还是多种细胞发挥抗纤维化作用将值得深入研究。 另外,通过CRISPR/Cas9 技术构建基因敲除老鼠已十分成熟,在敲除Ang Ⅱ基因老鼠进行肝纤维化造模并给予UA干预,探讨其抗纤维化机制将是下一步的研究重点。
综上所述,UA 具有抗肝纤维化作用,显著缓解肝纤维化的进展, 其可能与Ang Ⅱ/AT1R 信号通路有关。 UA 有望成为未来针对靶向Ang Ⅱ/AT1R 信号通路发挥抗肝纤维化的候选药物。
