脐带间充质干细胞及其外泌体对HK-2细胞脂多糖损伤的作用研究*
2022-01-11秦华章张欣洲马华林
徐 莹,周 茹,秦华章,张欣洲,马华林**
(1.深圳市人民医院/暨南大学第二临床医学院/南方科技大学第一附属医院血液内科,广东 深圳 518020;2.深圳市人民医院/暨南大学第二临床医学院/南方科技大学第一附属医院肾内科/深圳市肾脏病重点实验室)
急性肾损伤(acute kidney injury,AKI)是脓毒症常见的并发症之一,脓毒症若并发AKI将明显加重脓毒症病情以及增加患者病死率[1-2]。有研究表明[3],肾小管上皮细胞急性损伤是脓毒症致AKI重要的病理生理机制。众多研究表明[4-6],脓毒症诱导的免疫反应参与促炎与抗炎的激活及后续的效应,包括细胞和体液免疫,接着产生一系列的炎症介质,其中包括IL-1、TNF-α和IL-6,并发展成为细胞因子风暴。我们课题组前期的研究结果表明[7],人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HuMSCs)对脂多糖(LPS)诱导的大鼠AKI模型可起到有效保护作用。本研究拟观察HuMSCs及其来源外泌体对人肾皮质近曲小管上皮细胞(human kidney-2,HK-2)LPS毒性的保护作用及机制。
1 材料与方法
1.1 实验细胞及材料
人肾皮质近曲小管上皮细胞(human kidney-2,HK-2),购自中科院典型培养物保藏委员会干细胞库。人脐带间充质干细胞的培养HuMSCs均由深圳市人民医学院干细胞研究中心实验室分离、扩增培养以及保存。实验中使用的人脐带间充质干细胞均经过流式细胞仪检测,细胞表型特征符合MSC表型;微生物检测结果为阴性。
1.2 实验方法
1.2.1 实验分组
培养HK-2细胞,mock组不做任何处理;其余组在加入LPS(1μg/mL)处理24h后,co-cul组采用共培养方式,将铺满已用TNFα预处理24h的人脐带MSC细胞的上室放入共培养体系(HK-2细胞在下室),其余各组更换新的培养基,HK-2细胞+LPS+人脐带MSC细胞-Ex分别加入不同浓度的人脐带MSC细胞来源的exosomes继续培养24h后,收集各组的HK-2细胞及上清液备用(MTS、凋亡预实验确定LPS诱导损伤浓度效果),每组7个复孔。
mock组:HK-2细胞
0μg/mL组:HK-2细胞+LPS
co-cul组:HK-2细胞+LPS+人脐带MSC细胞(TNFα预处理后的细胞)
25μg/mL组:HK-2细胞+LPS+25μg/mL人脐带MSC细胞-Ex
50μg/mL组:HK-2细胞+LPS+50μg/mL人脐带MSC细胞-Ex
75μg/mL组:HK-2细胞+LPS+75μg/mL人脐带MSC细胞-Ex
100μg/mL组:HK-2细胞+LPS+100μg/mL人脐带MSC细胞-Ex
1.2.2 MTS检测细胞增殖变化
细胞活力的MTS法检测HK-2细胞接种在96孔板内,将20μL检测液加入培养孔,继续培养4h后使用酶标仪上检测490nm波长时的吸光度。
1.3 方法
1.3.1 外泌体分离提取
根据试剂说明书,使用ExoQuick试剂沉淀试剂盒(System Biosciences,SBI,Mountain View,CA)通过聚合物配制方法从血清中分离外泌体。分离后立即将所有外泌体储存在-80°C备用。 使用标准的Bradford蛋白质测定法(Bio-Rad,弗吉尼亚州,美国)确定分离的外泌体总蛋白质浓度。
1.3.2 HuMSC-ex的鉴定
(1)透射电镜和纳米颗粒示踪技术(NTA)检测HuMSC-ex。
取20μL HuMSC-ex滴加于铜网上,静置5min,将残余液体吸去后置于磷钨酸(pH 6.8)液滴上行负染5min,然后采用透射电镜观察并拍照。取100μL HuMSC-ex,采用纳米颗粒分析仪进行检测及数据分析。
(2)Western blot检测HSPA8、Alix、CD63以及TSG101等标记蛋白分子的表达。
HuMSC-ex与RIPA按1∶1混匀,置于冰上10min,震荡1min,重复3次,然后离心15min取上清液,测得蛋白浓度后加入缓冲液,煮沸10min。配制SDS-PGAE,计算上样量,加样后行聚丙烯酰胺凝胶电泳。电泳结束后在恒流湿转2h,脱脂牛奶室温封闭1h。HSPA8、Alix、CD63以及TSG101抗体稀释后孵育过夜,洗膜后曝光。
1.3.3 qRT-PCR和Western blot检测各组TLR4的表达
qRT-PCR检测采用Invitrogen设计并合成了特异性引物qRT-PCR,所有的qRT-PCR分析均通过Light-Cycler480实时PCR系统(罗氏)来执行。免疫印迹(Western blot)法用Bio-Rad蛋白测定系统(Bio-Rad,Hercules,CA,USA)测定蛋白质浓度,然后用12% SDS聚丙烯酰胺凝胶电泳,转移到PVDF膜(Millipore)上。膜在室温下用5%脱脂奶粉堵塞1h,与初级抗体孵育一夜。膜与HRP标记的次级抗体孵育室温下1h,在TBST(三乙醇胺缓冲盐水与吐温)中洗涤3~10min。含有这些蛋白质的膜用适当的抗体进行免疫印迹。
1.3.4 Elisa检测培养上清液中炎症介质(IL-1、IL-6、TNF-α)的水平
按照试剂说明做好准备工作,配制好各种溶液。根据待测样品数量和标准品的数量决定所需的板条数。分别将标本和不同浓度标准品(100mL/孔)加入相应孔中,空白孔加样本/标准品稀释液100mL/孔,用封板胶纸封住反应孔,37℃孵箱孵育90min。洗板4次:甩尽孔内液体,每孔加洗涤液350uL,静置30秒后甩尽液体,在厚迭吸水纸上拍干。加入生物素化抗体工作液(100mL/孔)。用封板胶纸封住反应孔,37℃孵箱孵育60min。洗板4次。加入酶结合物工作液(100mL/孔)。用封板胶纸封住反应孔,37℃孵箱孵育30min。洗板4次。加入显色剂90mL/孔,避光,37℃孵箱孵育25~30min。加入终止液100mL/孔,混匀后即刻测量OD450值(5min内)。
1.4 统计学方法
应用SPSS13.0软件进行统计分析,采用单因素方差分析(ANOVA)比较样本均数,P<0.05为差异有显著性意义。
2 结 果
2.1 外泌体的分离和鉴定
大量培养人脐带MSC细胞,经浓度为10ng/mL TNF-α刺激48h后,收集上清液,分离exosomes。
(1)透射电镜下观察HuMSC-ex 的形态为圆形或者椭圆形囊泡状结构,直径约为 100nm左右,大小不均(图1A)。

A.外泌体(图中红色箭头)在透射电镜下为椭圆形或者圆形囊泡状;B.WB检测exosomes标志物CD63、TSG101、HSPA8及Alix;C.NTA结果
(2)WB检测exosomes标志物CD63、TSG101、HSPA8及Alix进行鉴定;发现HuMSC-ex表达特异性标记CD63、TSG101、HSPA8及Alix(图1B)。
(3)采用纳米颗粒示踪(NTA)进行exosomes大小鉴定;分离的外泌体中50%的直径小于118.1nm,90%的直径小于163.9nm,大小符合外泌体特征(图1C)。
2.2 MTS检测细胞增殖变化
MTS结果显示:LPS刺激后,HK-2细胞增殖水平明显降低(P<0.05);人脐带MSC细胞与HK-2细胞共培养后,HK-2细胞增殖水平明显增加(P<0.05),表明人脐带MSC细胞外泌体同样可以促进HK-2细胞的增殖。见图2。
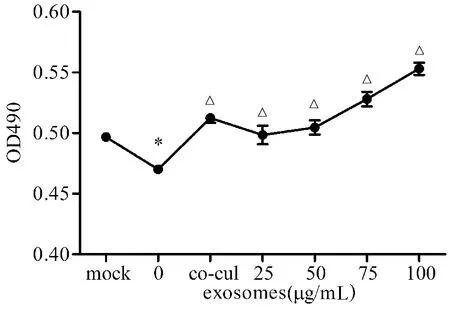
与mock组相比,*P<0.05;与0μg/mL组相比,△P<0.05,n=8
2.3 qRT-PCR和WB检测各组TLR4的表达
qRT-PCR和WB结果显示:给予LPS刺激后,HK-2细胞TLR4的表达水平明显增高(P<0.05),人脐带MSC细胞与HK-2细胞共培养后可抑制TLR4的表达(P<0.05),人脐带MSC细胞外泌体同样可以抑制TLR4的表达(P<0.05),而且随着外泌体的增加其抑制作用亦增强。见图3。

A.qPCR检测不同处理组TLR4 mRNA的表达(与mock组相比, *P<0.05;与0μg/mL组相比,△P<0.05,n=8);B.WB检测不同处理组TLR4蛋白的表达
2.4 Elisa检测培养上清液中炎症介质(IL-1β、IL-6、TNF-α)的水平
LPS刺激后,HK-2细胞的炎症因子IL-1β、IL-6和TNF-α水平明显升高(P<0.05),人脐带MSC细胞与HK-2细胞共培养后,可以降低IL-1β、IL-6和TNF-α的表达(P<0.05),人脐带MSC细胞外泌体亦可降低它们的表达(P<0.05)。见图4。
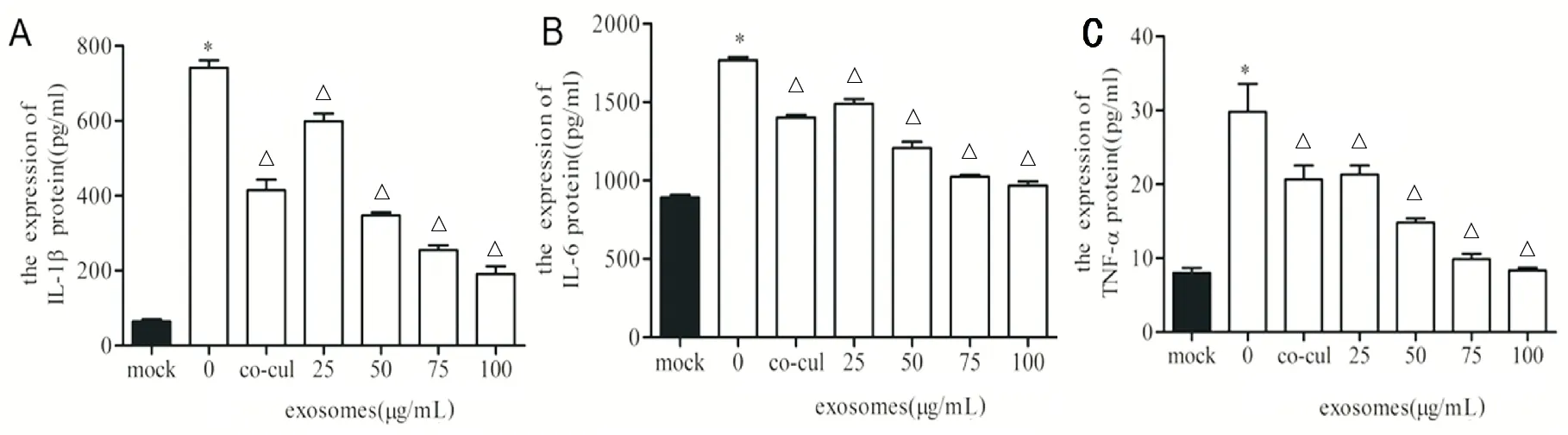
A.各组IL-1β水平;B.各组IL-6水平;C.各组TNF-α水平(与mock组相比,*P<0.05;与0μg/mL组相比,△P<0.05,n=8)
3 讨 论
AKI是脓毒症最常见的并发症也是增加其救治难度和病死率以及影响预后的重要原因[8]。近年有研究表明[3],脓毒症引起AKI的重要环节是LPS诱导的肾小管上皮细胞损伤,但其具体机制暂未明确。
HuMSCs是人体最重要的成体干细胞之一,其来源非常广泛,增殖速度快,经诱导可分化为软骨细胞、脂肪细胞以及成骨细胞等[9]。目前有学者认为间充质干细胞协调肾脏保护的作用是通过分泌大量趋化因子和细胞因子并释放诸如外泌体等活性物质来实现的,并与其通过免疫调节、趋化、抗凋亡和血管生成等机制密切相关[10]。MSC释放的外泌体选择性地将含有mRNAs、microRNAs和蛋白质等具有一定特异性的物质参与蛋白水解、细胞转运、凋亡和血管生成等途径[11-12]。有证据表明在体内外MSC分泌的外泌体均具有与MSC相似的功能,均可降低实验动物近端肾小管坏死、氧化应激、凋亡和体内大量管状蛋白铸型的形成,保护其肾功能[13]。
本研究发现:LPS抑制HK-2细胞的增殖,TNFα刺激人脐带MSC细胞与HK-2细胞共培养,以及人脐带MSC细胞外泌体可以修复LPS带来的损伤。以上结果表明,HuMSC-ex的预处理可明显降低LPS对 HK-2 细胞的损伤作用。TLR4作为重要的受体家族成员,可以通过识别LPS主要受体参与炎症反应。通过阻断TLR4信号转导通路后调节其炎症免疫反应,抑制炎症介质表达,提高脓毒症患者的生存率[14]。本研究结果发现LPS促进HK-2细胞TLR4的表达,人脐带MSC细胞外泌体亦可以抑制TLR4的表达。而且研究中发现LPS促进HK-2细胞IL-1β、IL-6、TNF-α的表达,TNFα刺激人脐带MSC细胞与HK-2细胞共培养,以及人脐带MSC细胞外泌体会抑制LPS导致的炎症因子表达升高。
综上所述,在体外人脐带间充质干细胞及其外泌体均能显著促进LPS诱导的肾小管上皮细胞增殖;抑制LPS导致的HK-2细胞TLR4及炎症因子表达。
