4,4′-二(4氢-1,2,4-三氮唑-4)-1,1′-联苯锌(Ⅱ)配合物的合成、结构及热分解特性
2022-01-10屈晓妮潘桂旭吴柏君王文浩
屈晓妮,潘桂旭,褚 超,吴柏君,张 哲,王文浩
(西安工程大学 环境与化学工程学院,陕西 西安 710048)
0 引 言
配合物由于自身特殊的化学结构,因而在催化、磁性、发光、储能、吸/脱附等领域具有广泛应用[1-5],这也促使对配合物材料的热稳定性要求更高。1,2,4-三氮唑是一类富电子的N杂环化合物,这种类型的有机配体不仅兼具稳定性好、结构紧凑、氮含量高、配位模式多样等特性[6],而且能够与诸多过渡金属离子进行配位,从而使该类化合物成为构筑配合物的优选材料,备受科学家们青睐,并且一些结构新颖、性能优异的三唑类配合物已被相继报道[7-12]。然而,配合物在构筑过程中存在不可预测性,骨架中常伴有游离或配位的溶剂分子,易导致材料热稳定性降低而限制了其应用范围[13-15]。因此,选取合适的金属离子与稳定性好、配位模式多样的三唑衍生物有机配体组装配合物是制备热稳定性好的三唑类衍生物配合物的有效方法。
本文在水热条件下,选择4,4′-二-(4氢-1,2,4-三氮唑-4)-1,1′-联苯(dtb)为有机骨架与过渡金属Zn2+构筑1例锌(Ⅱ)配合物[Zn(dtb)Cl2]·2H2O(1),对其组成、结构和热稳定性进行表征,并对主框架坍塌过程中的非等温动力学参数进行计算。
1 实 验
1.1 试剂与仪器
1.1.1 试剂 4,4′-二-(4氢-1,2,4-三氮唑-4)-1,1′-联苯(吉林中科研伸科技有限公司);六水合氯化锌(ZnCl2·6H2O,天津市大茂化学试剂厂);乙腈(天津市科密欧化学试剂有限公司);蒸馏水(自制),以上试剂和药品均未经纯化直接使用。
1.1.2 仪器 X-射线单晶面探仪(Bruker D8 Venture型,德国布鲁克公司);台式X-射线衍射仪(MiniFlex600型,日本理学株式会社);红外光谱仪(Nicolet 5700-*型,美国尼高力公司);紫外分光光度计(UV2450型,日本岛津公司);热重分析仪(METTLER 851e型,瑞士梅特勒托利多); X-射线单晶衍射仪(Rigaku Oxford Diffraction XtaLAB Synergy-S)。
1.2 配合物制备
分别称取14.6 mg(0.05 mmol)4,4′-二-(4氢-1,2,4-三氮唑-4)-1,1′-联苯(dtb)和7.4 mg(0.05 mmol)ZnCl2·6H2O置于聚四氟乙烯内胆的不锈钢反应釜中,加入10 mL乙腈与蒸馏水的混合溶剂,充分搅拌后放入烘箱,100 ℃下晶化 3 d,然后以2.5 ℃/h的控温速率降至室温,得到黄色块状晶体,回收率71.82%(基于Zn)。配合物1(ZnC16H16N6Cl2O2,Mr =460.62 g/mol)的元素分析结果(%)为理论计算值:H,3.47、C,41.68、N,18.25;实测值:H,3.42、C,41.66、N,18.27。红外光谱测试结果(KBr压片法,cm-1):3 537(s)、3 399(s)、3 107(s)、2 059(w)、1 919(w)、1 789(w)、1 634(m)、1 546(s)、1 342(m)、1 307(m)、1 236(s)、1 114(s)、1 074(s)、1 001(m)、911(m)、821(s)、625(m)、529(m)、439(m)。
1.3 晶体结构测试
借助显微镜选取合适尺寸、外形透明规则配合物1的晶体,采用X-射线单晶衍射仪,以Cu Kα射线(λ=0.154 184 nm)为光源,在293(2) K温度下,通过ω扫描方式收集衍射点,所有数据用CrystAlisPro软件进行处理。晶体结构通过SHELXL[16-17]和OLEX2[18]解析得到。所有非氢原子通过差值傅里叶方法获得并精修至各向异性。配合物1中含有无序混乱的水分子(红外测试结果证明了水的存在),对精修结果有很大的影响,在PLATON软件上利用SQUEEZE程序对其进行处理[19]。配合物1的晶体学数据参数见表1,配合物1的部分键长(Å)和键角(°)数据见表2。表2中,

表 1 配合物1的晶体学数据表

表 2 配合物1的部分键长(Å)和键角(°)
R1= ∑‖F0|-|Fc‖/∑|F0|
wR2=[∑w(F02-Fc2)2/∑w[(F02)2]1/2。
2 结果与讨论
2.1 单晶结构
X-射线单晶衍射结果显示,配合物1属于单斜晶系,I12/a1空间群。每一个不对称单元是由1个Zn2+与1个dtb、2个Cl-和2个游离水分子构成。
配合物1中Zn2+的配位环境如图1所示,图1中每个Zn2+与来自2个dtb配体中的2个N(N3A、N3B)原子和2个Cl-(Cl1A、Cl1B)形成4配位结构,Zn2+处于四面体中心,其中Zn—Cl、Zn—N键长分别为2.247 7 Å、2.014 5 Å,Zn—N键长较Zn—Cl键长更短,说明N原子与Zn2+的配位能力比Cl-更强。N—Zn—Cl键角为103.69(5)°,Cl—Zn—Cl键角为113.19(3)°,N—Zn—N键角为113.50(10)°,N—Zn—Cl键角为111.53(5)°,在文献的报道范围内[20-21]。另外,Zn2+与周围临近3个Zn2+之间的距离在6.042 1~7.739 3 Å范围内,在空间形成了六边形结构。同时,每一个dtb配体采用μ2-3,3配位模式(图2)将邻近2个Zn2+连接,在空间形成了一维链状结构(图3)。
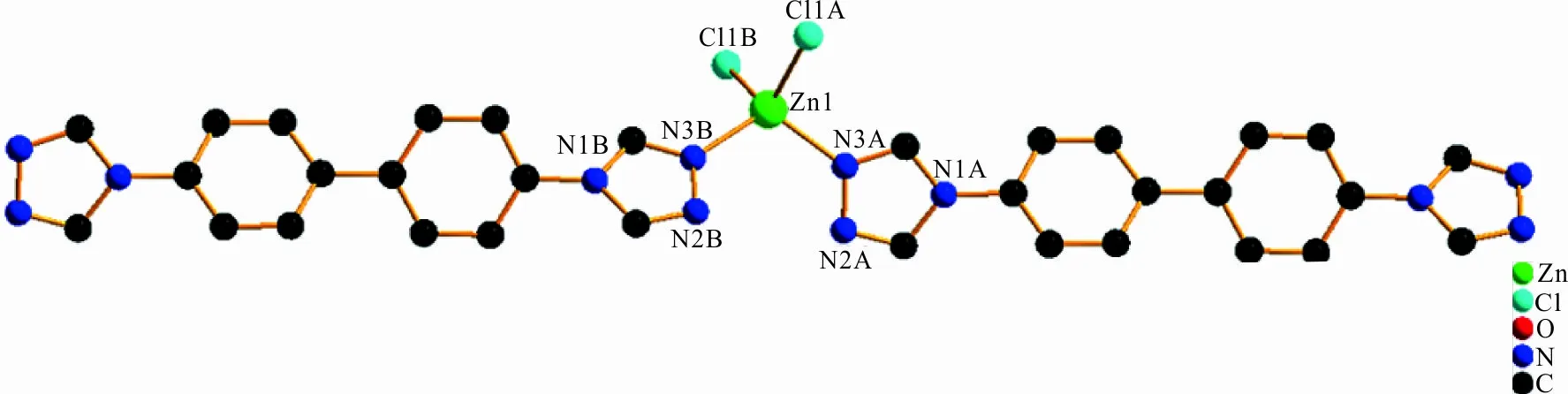
图 1 配合物1中Zn2+的配位环境图
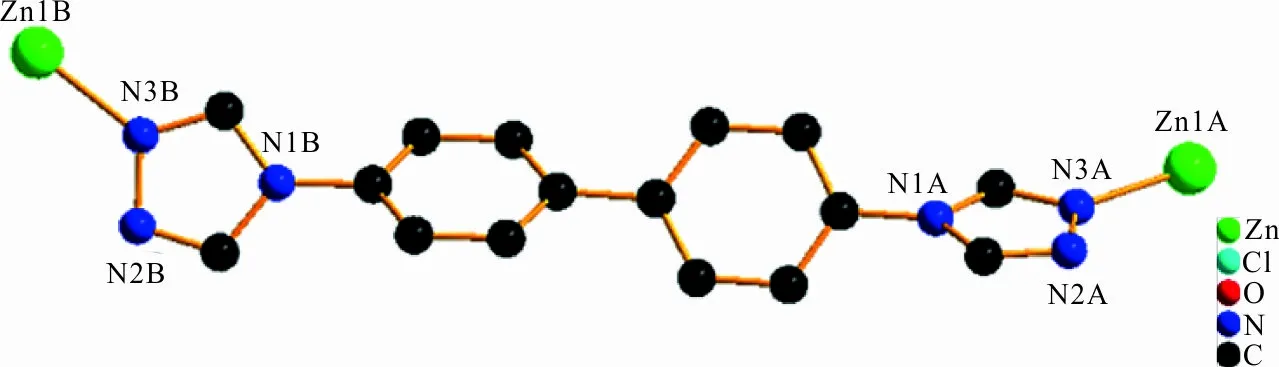
图 2 配合物1中dtb配体的配位模式图

(a) 溶剂水分子
2.2 PXRD和红外吸收光谱
X-射线粉末衍射在室温、台式衍射仪上进行,测试所条件为Cu Kα射线(λ=0.154 06 nm),电压60 kV,电流300 mA,扫描范围5°~50°,扫描速度5(°)/min,扫描步长0.02°。配合物1的PXRD如图4所示,图4中配合物1的粉末衍射峰的峰型和单晶样品理论模拟的PXRD图峰型十分吻合,表明合成的样品纯度较高。
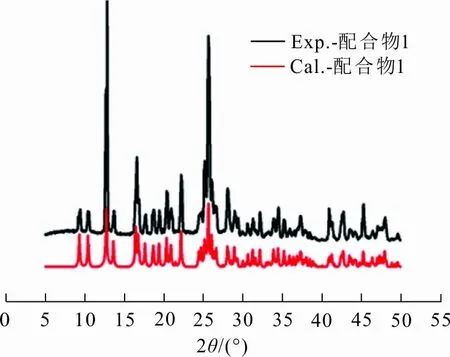
图 4 配合物1的PXRD曲线
配合物1红外光谱如图5所示。从图5可以看出,3 399 cm-1处强而尖的峰为O—H的伸缩振动峰,表明有游离的水分子存在。3 537 cm-1处N—H强而尖的吸收峰向低波数发生了移动,表明五元环上N原子参与了配位,进一步说明了配合物1的生成。
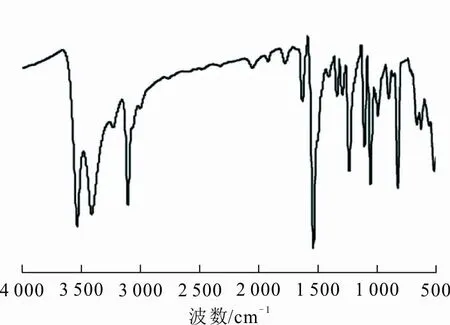
图 5 配合物1的红外光谱
2.3 紫外可见吸收光谱
在室温条件下,利用紫外分光光度计进行紫外可见吸收光谱实验,配合物1和dtb配体的紫外吸收光谱如图6所示。
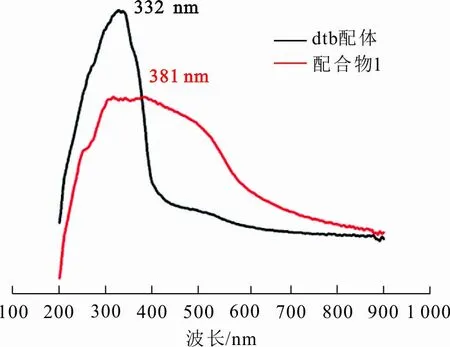
图 6 配合物1和dtb配体的紫外吸收光谱
图6中,dtb配体与配合物1均在紫外区有明显吸收,dtb配体最强吸收出现在332 nm处,配合物1有1个宽吸收带,最强吸收出现在382 nm处,但吸收强度较dtb配体明显变弱,是电子从配体向金属发生了转移的结果。
2.4 热稳定性和热分解行为
为综合评价配合物1的热稳定性和热分解行为,在氮气气氛,升温速率为10 ℃/min,温度范围为室温~800 ℃实验条件下,对配合物1进行TG实验。
由于dtb配体未经任何纯化,dtb配体中难免会有游离溶剂和空气中的水分子,配合物1和dtb配体的TG如图7所示。

图 7 配合物1和dtb配体的TG
从图7可以看出,dtb配体经历了三步质量损失过程,第一步(87.14 ~98.57 ℃)和第二步(217.29 ~236.01 ℃)主要归结于dtb配体中游离溶剂的离去;第三步质量损失从366.20 ℃开始,至375.32 ℃结束,该过程发生了dtb配体整体结构的坍塌,即配体的热分解反应,对应DTG曲线上的峰温为370.90 ℃。相比文献[6-8]的三唑类配体(Tp(atrz)=313 ℃,Tp(DNBT)=251 ℃),具有较高的热稳定性。
相比于dtb配体,配合物1进行了两步质量损失过程,第一步质量损失发生在86.75~105.96 ℃温度范围内,对应于DTG曲线上的峰温为97.38 ℃,归结于配合物1中游离水的离去,第二步是由于配合物1中配位键断裂,主框架坍塌,即在该温度下配合物1发生了热分解反应,Zn2+掉落,温度区间为379~401.48 ℃,对应于DTG曲线上的峰温为392.35 ℃。因此,通过TG分析可以得到,配合物1呈现出较dtb配体和其他报道的三唑类配合物[6,11,13,22]更高的热分解峰温,应归因于配合物1中由配位键所产生的1D链状结构,配合物1、dtb配体及部分三唑类配合物的物理化学性质参数见表3。

表 3 配合物1、dtb配体及部分三唑类配合物的物理化学性质参数
2.5 非等温动力学参数
为了进一步探究配合物1主框架分解过程中的热动力学稳定性,分别进行了升温速率为5、10、15、20 ℃/min下的TG实验,分别利用Kissinger[23]和Flynn-Wall-Ozawa[24-25]法估算表观活化能E(kJ/mol)和指前因子A(s-1),Kissinger和Ozawa-Doyle方程为
(1)
(2)
式中:Tp为DTG曲线中的峰温,℃;A为指前因子,s-1;E为表观活化能,kJ/mol;R为摩尔气体常数,R=8.314 J/(mol·K);β为线性升温速率,℃/min;C为常数。
配合物1在4种升温速率下的TG图如图8所示。从图8可以看出,当升温速率为5、10、15、20 ℃/min时主框架坍塌过程的峰温依次为383.79、392.35、401.36、405.34 ℃。因此,随着线性升温速率的升高,主框架坍塌过程的峰温也随着向高温方向移动。同时,由Kissinger方法计算的表观活化能Ek为218.67 kJ/mol,指前因子lgA为15.115 s-1,线性相关系数Rk为0.992 3;Ozawa-Doyle方法计算的表观活化能E0为218.50 kJ/mol,线性相关系数R0为0.993 0。2种方法计算的表观活化能较接近,线性相关系数(Rk、R0)接近1,表明数据可靠。由以上数据计算的配合物1主框架热分解过程中的活化能为218.59 kJ/mol(Ek和E0的平均值),所以Arrhenius方程为lgk=15.115-218.59×103/(2.303RT),由此估算主框架热分解过程中不同温度下的反应速率。

图 8 配合物1在不同升温速率下的TG图
3 结 论
1) 以4,4′-二-(4氢-1,2,4-三氮唑-4)-1,1′-联苯(dtb)为配体制备了热稳定性较高的锌(Ⅱ)配合物[Zn(dtb)Cl2]·2H2O(1)。
2) X-射线单晶衍射结果表明,配合物1中每个Zn2+处于四面体中心,每个dtb配体采用μ2-3,3配位模式与邻近的Zn2+连接,整个结构在空间呈一维链。
3) 紫外可见吸收光谱显示,电子从配体向金属的转移导致配合物1(382 nm)的紫外可见吸收位置相比于dtb配体(332 nm)发生明显红移,但吸收强度明显变弱。
4)热重实验分析表明,配合物1主框架发生热分解反应的温度区间为379 ~401.48 ℃,主框架热稳定性良好。
