基于胃黏膜活检对儿童幽门螺杆菌多重耐药及毒力基因分型的关联性分析
2022-01-05王教常黄达栋王荣徐贤坐林敏林福旭汤清清孟飞林李淼
王教常 黄达栋 王荣 徐贤坐 林敏 林福旭 汤清清 孟飞 林李淼*
幽门螺杆菌(Hp)自1983年被发现后一直备受关注。众多研究已证实其与胃炎,消化性胃溃疡等一系列胃部疾病相关,甚至与胃癌的发生密切相关[1]。目前,Hp全球感染率已超50%,儿童Hp感染状况不容乐观[2-4]。儿童作为一个特殊群体,在Hp感染患儿中,仅部分有发病症状,且根除Hp效果也不尽相同。究其原因,可能与Hp毒力和抗生素耐药有关。作者收集胃黏膜活检组织标本,进行Hp分离培养鉴定,并进一步对其毒力基因分型及6种抗生素耐药性进行检测,分析儿童Hp毒力基因分型与耐药情况的关联性,为本地区儿童Hp临床根除治疗及预防提供参考。
1 资料与方法
1.1 临床资料 招募2019年1~12月本院因上消化道症状就诊且行胃镜检查的患儿430例。纳入标准:(1)有腹痛、腹胀等消化道症状者;(2)4周内未使用抗生素、铋剂、质子泵抑制剂或H2受体拮抗剂者;(3)经患儿监护人知情同意,胃镜下取胃黏膜活检标本。排除标准:(1)患有严重的肝、肾疾病;(2)对本研究中6种抗生素过敏者;(3)有精神疾病等不能正确表达主诉及不能合作者。胃黏膜组织Hp分离培养阳性患儿249例,其中男111例,女138例;年龄4~14岁,平均年龄(9.27±2.71)岁。
1.2 方法 (1)Hp分离培养:将胃黏膜组织充分研磨后,涂布于Hp专用培养基上,置于37℃微需氧环境(5% O2,10% CO2,85% N2)培养 3~5 d,挑选透明可疑菌落进行初步镜检,经尿素酶、氧化酶及过氧化氢酶反应均为阳性后,判定为Hp阳性菌株。(2)Hp耐药检测:采用琼脂稀释法,将6种抗生素(克拉霉素、左氧氟沙星、阿莫西林、甲硝唑、呋喃唑酮、盐酸四环素)分别加入Hp专用培养基中稀释成临界浓度,制备含不同抗生素的平板。将鉴定后的Hp阳性菌株分别接种于含不同抗生素平板上,置于37 ℃微需氧环境(5%O2,10%CO2,85%N2)培养3 d。所选抗生素及其耐药临界点标准为:克拉霉素1 μg/mL、左氧氟沙星2 μg/mL、阿莫西林2 μg/mL、甲硝唑8 μg/mL、呋喃唑酮2 μg/mL、盐酸四环素 2 μg/mL[5]。本研究质控菌株为:Hp ACTC11637。(3)毒力基因分型检测:通过细菌基因组DNA提取试剂盒(天根生化科技(北京)有限公司)对所获得的Hp菌株进行DNA提取。通过PCR扩增,对毒力基因VacA-s和VacA-m进行扩增。具体反应体系如下::2×T5 Super PCR Mix 15 μL,正反向引物(10 μmol/L)各1μL,模板DNA 2μL,5×Enhancer buffer 6μL,ddH2O 5μL。扩增条件为:98℃预变性3 min;98℃ 30 s,退火(退火温度56℃)10 s,72 ℃延伸10 s,PCR循环30次;最后72℃后延伸5 min。PCR产物经2%琼脂糖凝胶电泳检测后,送至杭州擎科梓熙生物技术有限公司进行Sanger测序。PCR反应引物由杭州擎科梓熙生物技术有限公司合成,引物序列及扩增片段长度见表1。
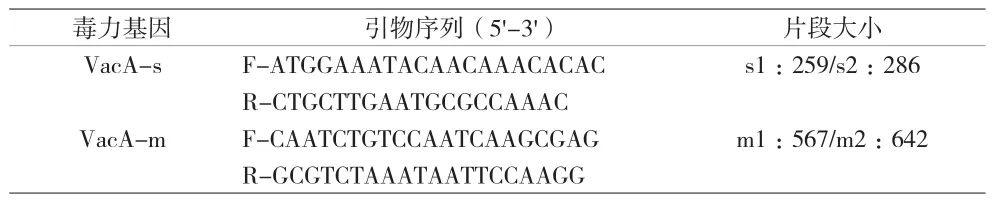
表1 Hp毒力基因VacA引物序列
1.3 统计学方法 采用SPSS22.0统计软件。计数资料用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 Hp耐药率 249例Hp阳性患儿对6种抗生素的耐药率分别为:克拉霉素60.24%、左氧氟沙星42.17%、甲硝唑78.31%、阿莫西林0%、呋喃唑酮0%、盐酸四环素0%。其中,对两种抗生素组合耐药66例,占比26.51%;对三种抗生素组合耐药81例,占比32.53%。见表2。
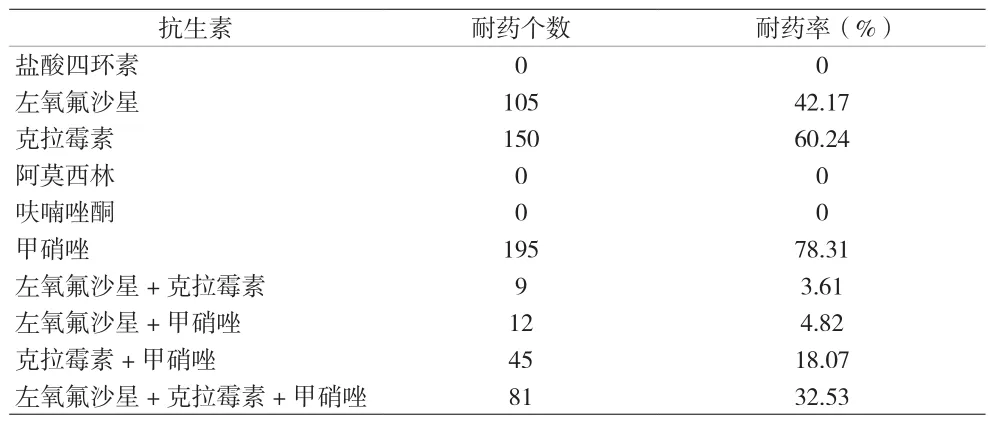
表2 儿童Hp对6种抗生素耐药情况统计
2.2 Hp毒力基因分型结果 249例儿童Hp进行了毒力基因VacA(s1/s2、m1/m2)的检测。VacA基因的检出率为100%,其中VacAs1、VacAs2、VacAm1及VacAm2的检出率分别为98.80%、1.20%(3/249)、38.55%及61.45%。VacA基因嵌合体中,基因亚型VacAs1m1占37.35%,基因亚型VacAs1m2占比最高,为61.45%,VacAs2m1为1.2%,VacAs2m2为0%。见表3。
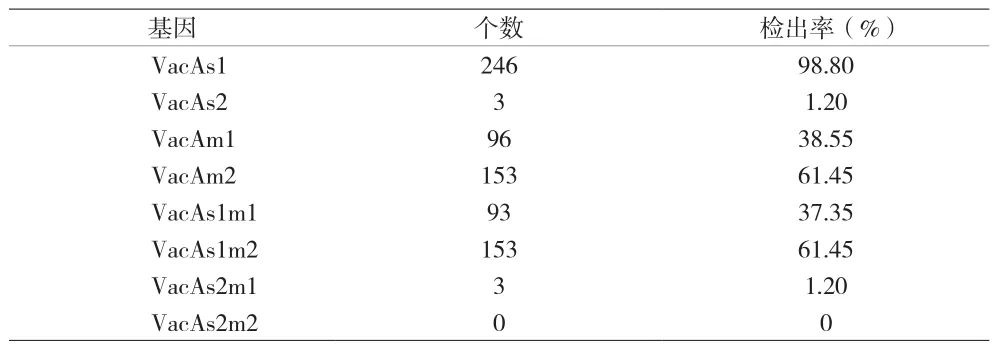
表3 Hp毒力基因各基因型分型及其组合的检出率统计
2.3 Hp毒力基因分型和耐药情况的关联性 单一耐药和双重耐药型在毒力基因亚型VacAs1m1和VacAs1m2之间都表现为无差异,但三重耐药型在毒力基因亚型VacAs1m1和VacAs1m2之间差异明显(P<0.05)。见表4。在毒力基因亚型VacAs1m2中,单一耐药、双重耐药及三重耐药型之间无明显差异(P>0.05)。在毒力基因亚型VacAs1m1中,单一耐药、双重耐药及三重耐药型之间差异明显(P<0.05)。见表5。
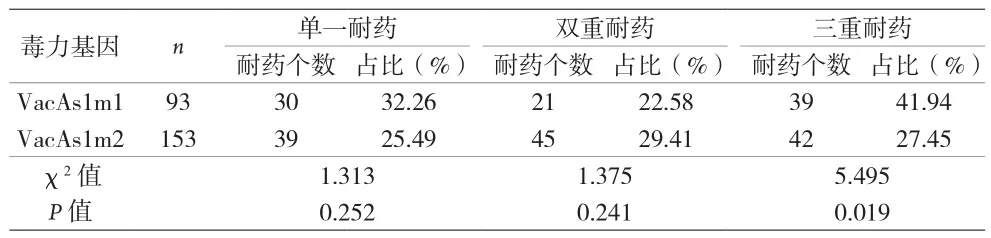
表4 不同耐药型在毒力基因亚型VacAs1m1和VacAs1m2的关系
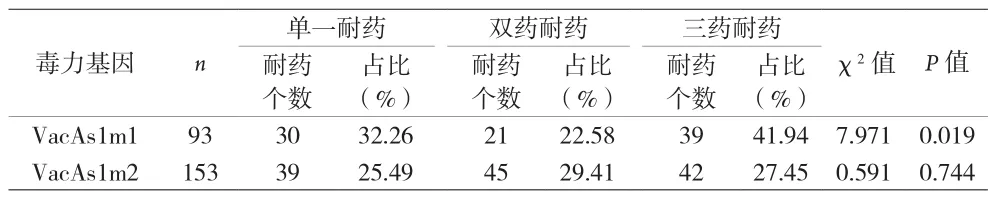
表5 毒力基因亚型在不同耐药型之间的关系
3 讨论
Hp是一种定植于人体胃黏膜上的革兰氏阴性菌,可以导致儿童肠道疾病的发生[6]。儿童感染Hp后,其临床根治效果主要受到Hp菌株耐药和Hp毒力基因分型的影响。目前,临床上常用于儿童感染Hp的药物主要有克拉霉素、阿莫西林、甲硝唑等,但是随着抗生素在食品及药品方面的滥用,Hp耐药现象愈发严重,影响儿童Hp的根除效果。本研究成功分离出249例患儿Hp阳性菌株,结果发现,克拉霉素、左氧氟沙星及甲硝唑的耐药率分别为60.24%、42.17%及78.31%,尤其克拉霉素耐药率普遍高于其他地区,如嘉兴地区[7](克拉霉素14.81%,甲硝唑51.85%),台州地区[8](克拉霉素20.94%,左氧氟沙星10.26%),萧山地区[9](克拉霉素16.74%,左氧氟沙星5.02%,甲硝唑71.55%)。究其原因,可能于当地抗生素耐药有关。经浙江省Hp监测大数据[5]分析发现,温州地区克拉霉素耐药率明显高于嘉兴、台州及杭州等浙江省内地区。此外,本研究中双重耐药Hp菌株占比26.51%,三重耐药Hp菌株占比达32.53%,可见本地区儿童Hp多重耐药情况已十分严重,需引起足够重视。
毒力基因VacA可通过编码VacA蛋白释放空泡毒素,引起细胞损伤及凋亡[10]。毒力基因VacA不同亚型中,VacAs1m1型可以产生大量毒素故而毒性最强具有高毒素活性,VacAs1m2型空泡毒性次于VacAs1m1型则具有次高毒素活性,VacAs2m2不能诱导空泡形成可视为无毒素活性[11-12]。本研究结果显示,本地区儿童Hp感染VacA基因亚型以VacAs1m2为主(61.45%),其次为基因型 VacAs1m1(37.35%),VacAs2m1(1.20%),无毒素活性基因型VacAs2m2并未发现,与上海某三甲医院Hp毒力研究得出的结论相一致(基因型VacAs1m1占39%,VacAs1m2占61%)[13]。不同国家、地区人群Hp菌株的VacA基因型各有不同,日本儿童[14]及中国东北地区[15]VacA基因亚型以VacAs1m1为主,美国VacAs1m1和VacAs2m2各占约50%。
目前,国内外开展较多关于Hp毒力基因分型和耐药情况的关联性研究[16-18]。本研究结果显示,单一耐药和双重耐药型在毒力基因亚型VacAs1m1和VacAs1m2间差异无统计学意义(P>0.05),但三重耐药型Hp在毒力基因亚型VacAs1m1和VacAs1m2间差异有统计学意义(P<0.05)。表明毒力基因亚型VacAs1m1(高毒素活性)的Hp菌株出现对抗生素多重耐药的几率较大。原因可能与VacA可使Hp持续定植于胃黏膜相关[19],高毒素活性毒力基因致使Hp更易定植于胃黏膜从而加大Hp根除难度,加重多重耐药的可能性。高毒素活性毒力基因亚型VacAs1m1中,单一耐药、双重耐药及三重耐药型间差异有统计学意义(P<0.05),三重耐药比例明显高于单一耐药及双重耐药比例;而次高毒素活性基因亚型VacAs1m2中,三种耐药型间无明显差异。表明高毒素活性毒力基因型Hp菌株更容易产生多重耐药的情况。
综上所述,本研究地区儿童Hp毒力基因亚型以VacAs1m2为主,毒素活性相对较弱,然而Hp多重耐药情况依然十分严重。本地区儿童Hp毒力基因VacA与耐药型存在一定相关性,高毒素活性毒力基因型(VacAs1m1)Hp菌株更容易产生多重耐药,为Hp根除提供新思路,对于本地区儿童抗生素用药具有一定指导意义。
