基于SEER数据库构建肺癌骨转移预测模型
2022-01-05沈岳传何慧张永奎
沈岳传 何慧 张永奎*
肺癌在全球范围内是常见肿瘤之一,发病率和病死率均位于前列[1-2]。近年来随着诊治技术的提升,肺癌患者病死率下降,生存期相对延长,随之肺癌远处转移发生率相应增加[3]。据报道,肺癌骨转移患者中位生存期仅为6~10个月[4]。目前有关肺癌骨转移患者相关临床特征及预后的研究还较少[5]。SEER数据库为临床研究提供了良好的数据支持[6-7]。而Nomogram图因其直观方便的特点已被广泛应用到乳腺癌、前列腺癌等各种医学研究中[8]。本研究提取SEER数据库中肺癌骨转移患者资料,对影响肺癌骨转移预后的相关临床病理因素进行探讨,建立肺癌骨转移Nomogram预测模型,并对此模型进行验证,为肺癌骨转移患者的临床治疗提供一定理论支持。
1 资料与方法
1.1 临床资料 从美国医疗保险监督、流行病学和最终结果(SEER)数据库中收集2010年1月至2015年12月肺癌患者相关资料,纳入标准:(1)患者年满18周岁;(2)病理诊断为单原发性肺癌,而非多原发性;(3)有明确的病理诊断;(4)有完整的随访信息。排除标准:(1)多原发癌;(2)患者的相关信息存在缺失。
1.2 方法 纳入的变量包括年龄、性别、种族、婚姻状况、肿瘤原发部位、病理类型、组织学等级、手术情况、放疗情况、化疗情况、T分期和N分期。(1)年龄分为四组:≤60岁、61~70岁、71~80岁、>80岁;(2)性别分为男性和女性;(3)种族包括白人、黑人、其他(包括黄种人、棕色人等)三组;(4)婚姻分为已婚和未婚;(5)原发部位分为右上肺、右中肺、右下肺、左上肺、左下肺;(6)病理类型分为腺癌、鳞癌、小细胞癌、其他(包括腺鳞癌、大细胞癌等);(7)组织学等级分为Ⅰ级、Ⅱ级、Ⅲ级、Ⅳ级四组;(8)根据有无手术分为手术组和未手术组;(9)根据放疗情况分为放疗组和未放疗组;(10)根据化疗情况分为化疗组和未化疗组;(11)T分期分成T1、T2、T3、T4、Tx 5组;(12)N分期分成N0、N1、N2、N3、NX,其中T分期和N分期标准参考美国癌症联合委员会(AJCC)第7版TNM分期;(13)按转移部位分为:①无器官转移或单独骨转移,②合并脑转移,③合并肝转移,④合并肺转移,⑤多发转移。
1.3 统计学方法 从SEER数据库中共提取74,466例患者信息,采用R软件(3.6.2版本)中随机抽样函数按7:3比例分成建模组和验证组,其中建模组52,128例,验证组22338例。两组比较采用卡方检验。建模组中的变量包括年龄、性别、种族、婚姻、肿瘤原发部位、病理类型、组织学等级、手术情况、放疗情况、化疗情况、T分期和N分期等单因素分析采用卡方检验,并利用Lasso回归分析筛选影响肺癌骨转移的因素,将有统计学意义变量引入多因素Logistic回归分析中,得到独立预后因素,以此为基础构建列线图生存预测模型,采用C指数和接受者操作特性曲线(ROC)对该模型进行评价并绘制校正曲线。使用验证组中病例对该模型进行外部验证,将验证组数据进行1000次重采样绘制校正曲线并计算C指数。P<0.05为差异有统计学意义。
2 结果
2.1 建模组和验证组临床病理因素比较 见表1。
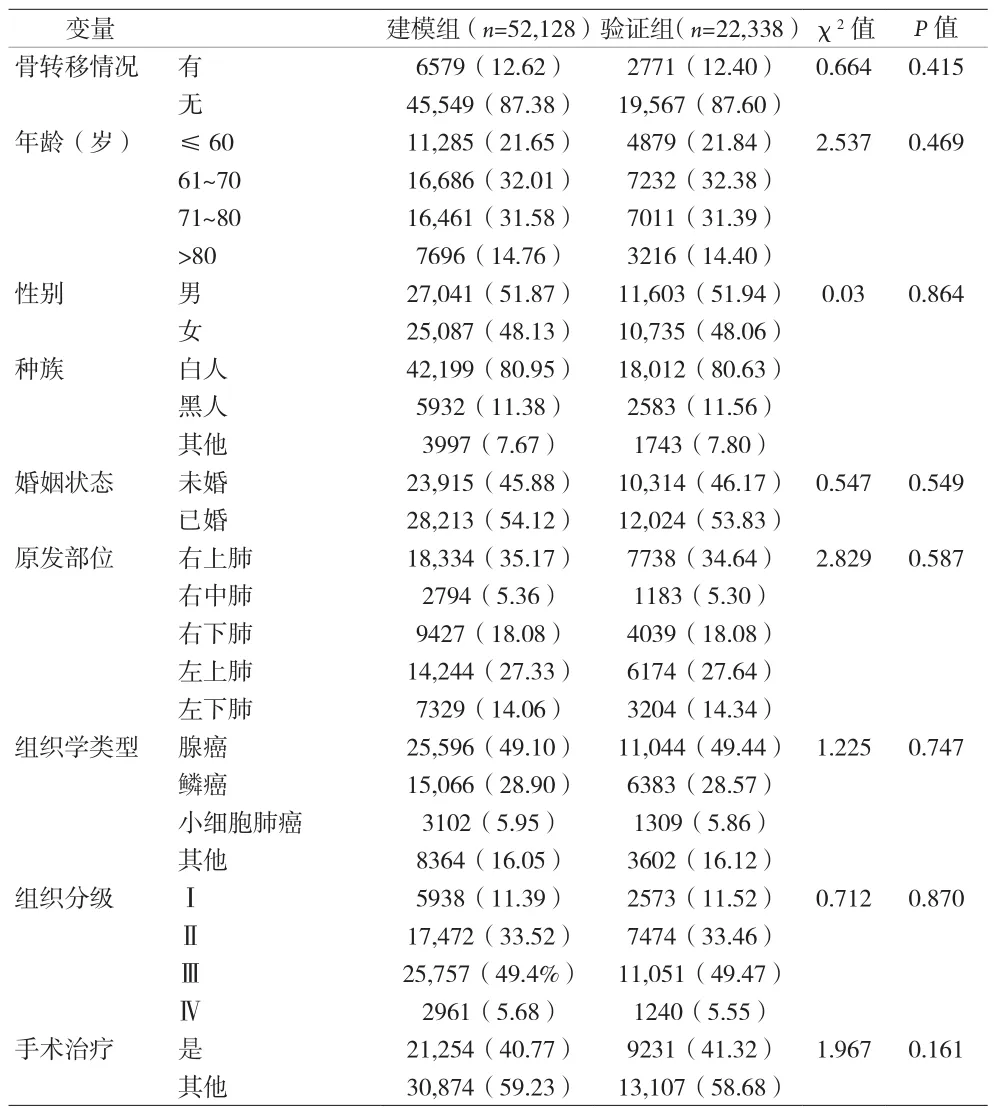
表1 建模组和验证组患者变量单因素比较[n(%)]
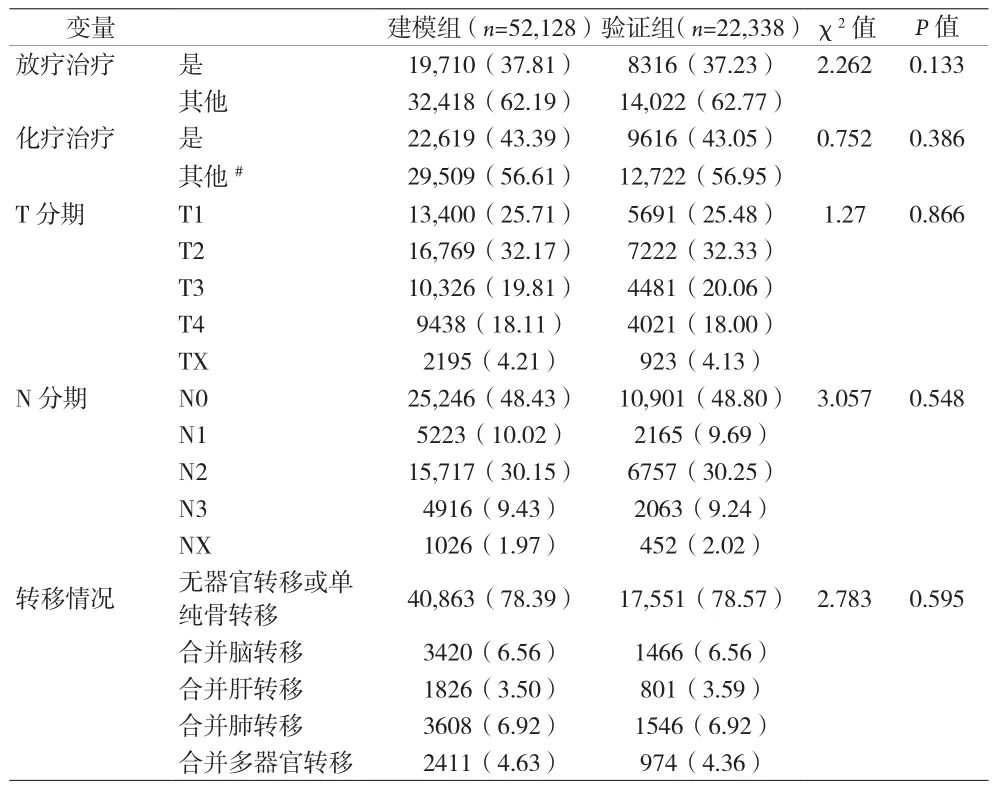
表1 (续)
2.2 单因素分析 影响肺癌骨转移的变量有12个,分别为年龄、性别、种族、婚姻状况、病理类型、组织学等级、手术情况、放疗情况、化疗情况、T分期、N分期、转移情况(P<0.05)。见表2。

表2 肺癌骨转移影响因素单因素分析(建模组)
2.3 Lasso回归分析 对建模组中影响肺癌骨转移的各变量进行lasso回归分析,剔除了种族这个变量,共筛选出12个变量,为年龄、性别、婚姻状况、肿瘤原发部位,病理类型、组织学等级、手术情况、放疗情况、化疗情况、T分期和N分期、转移情况。见图1、2。
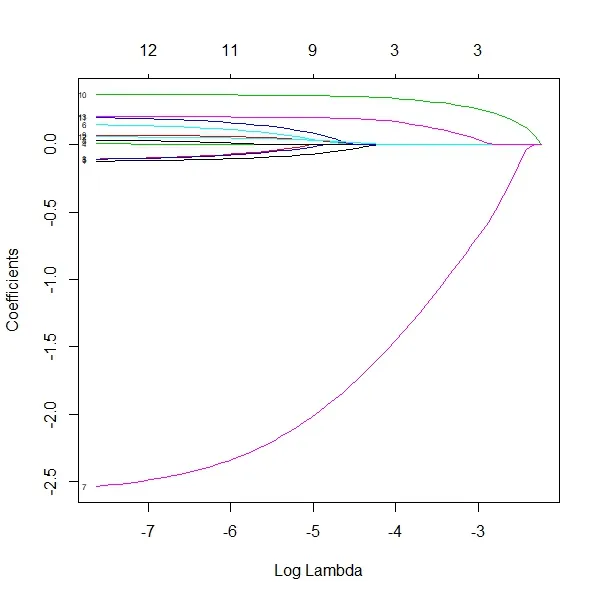
图1 Lasso回归系数变化图
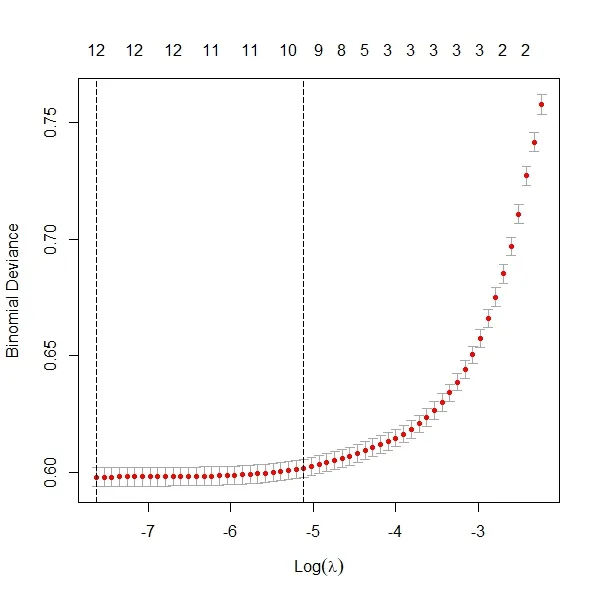
图2 Lasso回归CV变化情况
2.4 多因素分析 由于单因素方差分析结果和lasso回归分析结果存在差异,结合专业知识判断,将所有研究变量纳入多因素Logistic回归分析中,结果显示,年龄增加、性别为女、行手术治疗为肺癌骨转移发生的保护因素;另外在病理类型方面,腺癌比鳞癌、小细胞肺癌或其他类型肺癌发生肺癌骨转移风险低(P<0.05)。已婚,组织分级增高、T分期增高、N分期增高,合并转移器官增多,发生肺癌骨转移风险增高(P<0.05)。见表3。
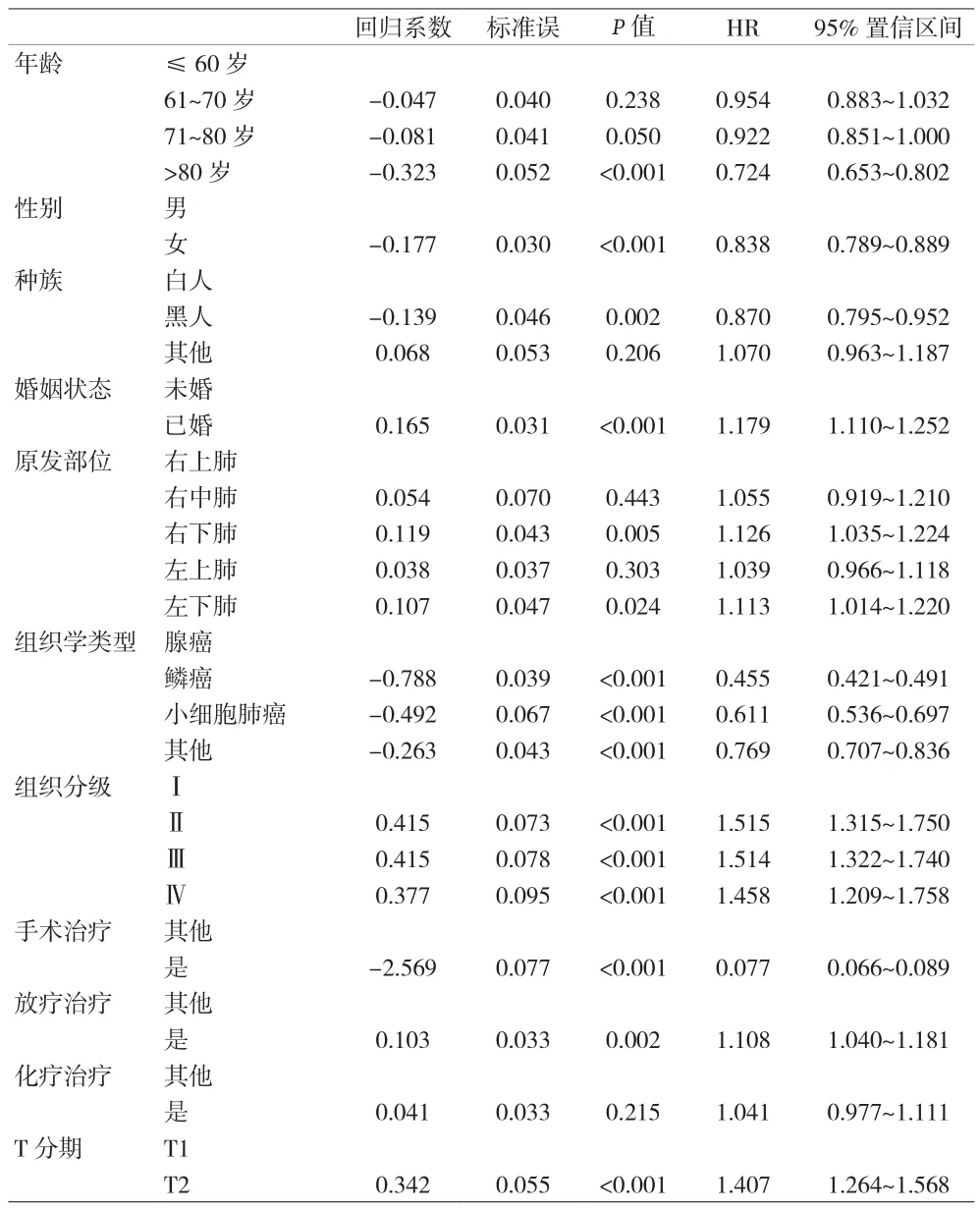
表3 肺癌骨转移影响变量多因素分析
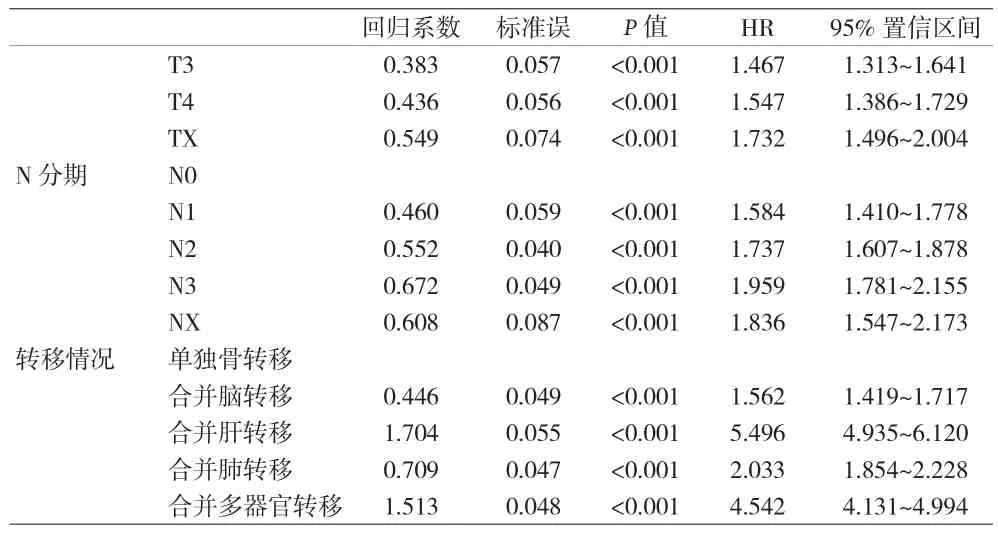
表3 (续)
2.5 Nomogram图构建 根据单因素分析和多因素Logistic结果,结合专业知识判断,Nomogram 图构建中共纳入11个变量(年龄、性别、婚姻状况、病理类型、组织学等级、手术情况、放疗情况、T分期、N分期、转移情况),见图3。根据每个变量的不同分类垂直投射到向上的小标尺(Points)得到每一项的分值,分值越高,肺癌骨转移发生风险越高,将每一项的分值相加得到总分,从总标尺(Total Points)垂直投射到下方的风险栏(Risk)即得到肺癌骨转移发生概率。
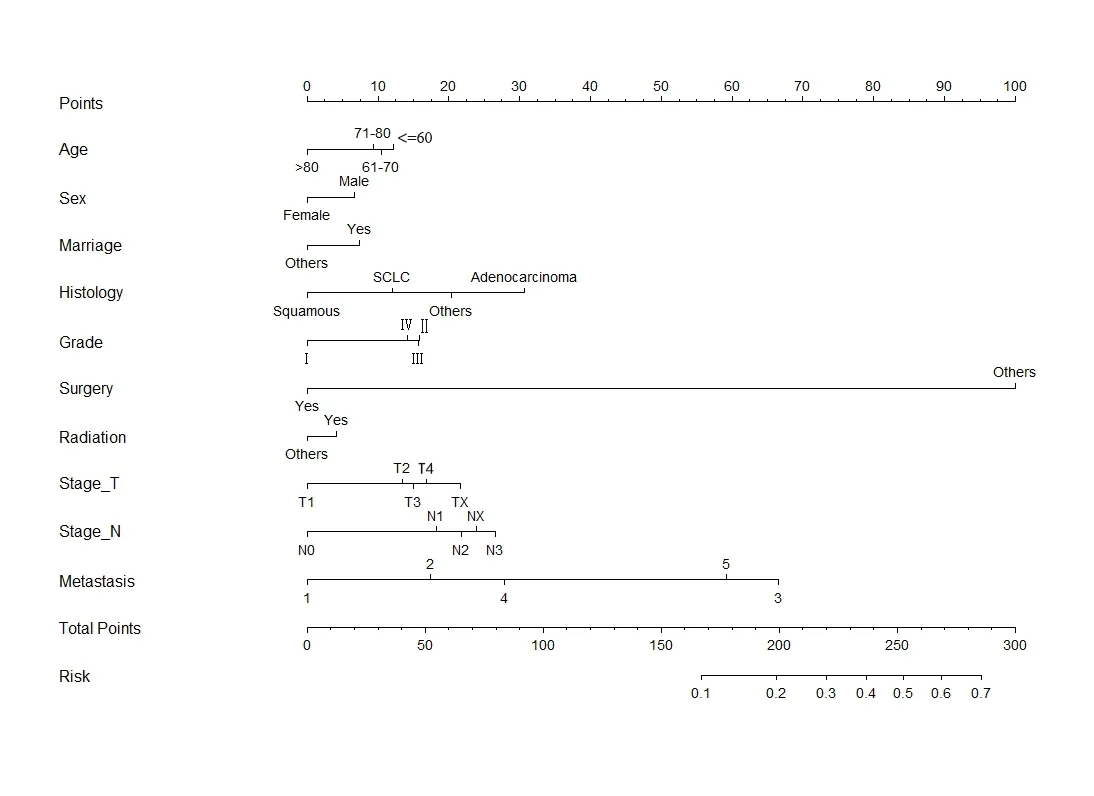
图3 预测肺癌骨转移Nomogram图
2.6 Nomogram图验证 对构建的Nomogram图进行内部验证和外部验证,建模组一致性指数(C-index)为0.835(95%CI:0.831~0.839),验证组的 C 指数为 0.836(95%CI:0.829~0.843),表明该模型具有良好的预测功能。建模组和验证组的校正图曲线均靠近理想的45°虚线,建模组ROC曲线AUC为0.819,验证组AUC为0.820,表明该模型预测能力较好。见图4、5。
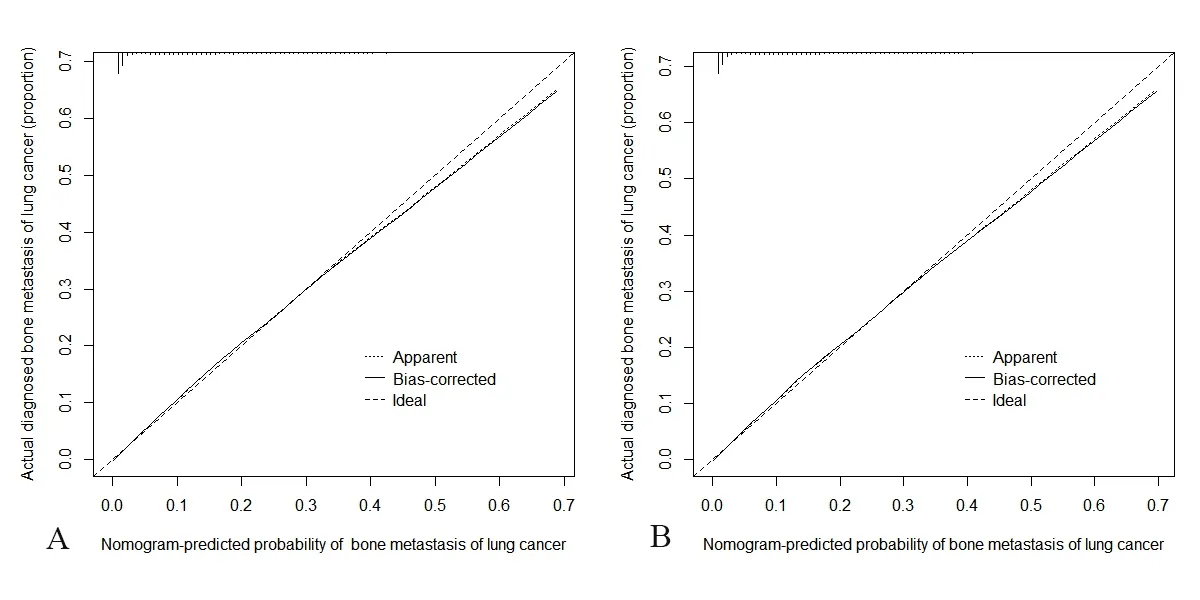
图4 建模组和验证组校正曲线图
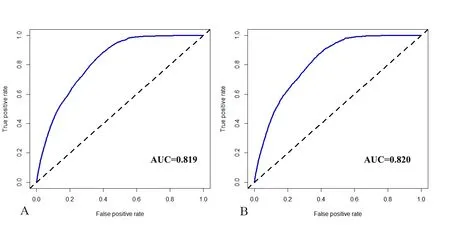
图5 建模组和验证组ROC曲线图
3 讨论
肺癌是全球最常见肿瘤,不仅发病率和病死率高,肿瘤远处转移也常见[5,10]。骨骼是肺癌常见转移部位之一,据报道,约15%~40%的肺癌会出现骨转移[11]。良好的预测模型可提高肺癌骨转移患者早期发现率,有助于临床医师做出针对性治疗,从而改善其预后。可能是由于单中心肺癌骨转移患者病例较少,目前尚无较为完善的可预测肺癌骨转移的评分系统。
本研究中年龄为发生肺癌骨转移的保护因素,即随着年龄增长,肺癌骨转移发生率降低,这与SILVA等[12]研究结果一致,其对非小细胞肺癌中骨转移进行临床病理特征分析发现,年龄增加1岁,非小细胞肺癌骨转移发生率即下降3%。这可能是由于年轻的肺癌患者预后较好,增加肺癌发展为骨转移的风险。另外,肺癌转移除血液转移途径外还有一条重要途径即淋巴结转移途径,而有报道认为,随着年龄增长人类的癌症免疫监视体系功能会逐渐减弱,淋巴结也随之退化,且淋巴回流减少,从而减少肺癌转移至骨的风险[13]。
近年来,男性肺癌发病率有下降趋势,女性肺癌发病率却有增加趋势,这可能与近年来女性吸烟人数增加相关[14]。性别对肺癌骨转移的影响已有研究[11],多数认为性别对肺癌骨转移发生的影响差异无统计学意义。但本研究结果显示,男性比女性更易发生肺癌骨转移,这可能与男性更易发生淋巴结转移有关,引起肺癌骨转移中性别差异的具体病理生理机制尚需进一步研究。
据多项研究结果显示,婚姻是较多癌症发生的保护性因素[15],同时与未婚人士相比,已婚人士的生存期较长,这可能是良好的家庭关系以及家人的照顾对患者产生积极正面的影响,良好的心理状态及经济支持使患者生存期相对延长。在本研究中,婚姻为肺癌骨转移发生的危险因素,可能是已婚组相对生存期较长,增加肿瘤发生远处转移的概率。
目前有多篇文献报道认为肺癌骨转移与其原发部位肿瘤的病理类型有关,其中肺腺癌更易发生骨转移[16]。本研究中也发现与鳞癌比,腺癌和小细胞肺癌更易发生骨转移。这可能是由于腺癌侵袭性较强,且肿块多位于肺边缘区,易直接侵犯脊柱或肋骨。也有可能骨组织中血运丰富,而肺腺癌肿瘤细胞易通过血行转移途径转移至骨组织。肿瘤细胞一到达骨髓的微环境中,便可分泌特殊细胞因子,增加RANK配体的表达等,加速破骨形成,其具体的病理分子机制需进一步研究[17]。对于组织学分级,一般认为高分化肿瘤发生肿瘤远处转移概率低,肿瘤细胞随着分化程度的降低而侵袭性增强,本研究结果与以往研究一致,但当组织学分级为Ⅳ级最低分化时,肺癌骨转移率并非最高,这可能是因当肿瘤分化太低时,肿瘤恶性程度高,患者生存周期短,来不及发展为远处转移。
目前较少有研究能直接证明行手术治疗可预防骨转移发生,但本研究发现行手术治疗是肺癌骨转移的保护因素,且在Nomogram图中行手术治疗这一项所占分值较高,即行手术组中肺癌骨转移发生概率较低,但这也有可能是由于在肺癌确诊有转移时即失去手术价值,因此非手术组中肺癌骨转移率高。本研究中放疗治疗反而为肺癌骨转移发生的风险因素,这可能是由于患者在确诊有转移时即行放疗治疗,行放疗组中肺癌骨转移发生率较高。而化疗对肺癌骨转移的影响无统计学意义。
关于TNM分期,T分期主要反映肿瘤原发灶的体积大小,周围浸润情况,N分期指淋巴结浸润情况,是肿瘤进展程度的重要指标之一,也是评估放化疗效果的重要指标。多篇研究指出,TNM分期是影响肿瘤预后的重要因素[7],另外T分期和N分期越高,肺癌发生骨转移概率随之升高,本研究结果与此类似,T分期和N分期是肺癌骨转移模型构建的重要影响因素。对于肿瘤大于5cm,发现有淋巴结转移的肺癌患者,临床医师要提高警惕,注意其发生骨转移的可能,及时进行针对性治疗。关于多发转移情况,本研究结果显示,合并其他器官转移是肺癌骨转移发生的危险因素,其中合并肝转移发生骨转移风险最高,甚至高于合并多发器官转移组,但这其中的原因尚不清楚,需进一步深入研究。
