新生儿脓毒症NLR、HMGB1、PCT水平与炎性因子、脏器功能及预后的相关性
2021-12-24刘海红杨春光王凤东
刘海红,杨春光,王凤东,刘 军
新生儿脓毒症主要是由于病原菌侵入血液,并在其中生长、繁殖导致的全身感染性疾病[1]。近年来,临床对胎膜早破的强化管理以及产前抗生素的应用,使新生儿感染发病率明显降低,但脓毒症仍是威胁新生儿生命安全的主要原因之一。据统计,脓毒症是导致新生儿死亡的第三大直接原因,病死率可高达19%[2]。因此,早期诊断以及评估新生儿脓毒症病情是降低病死率的关键。既往研究表明,部分脓毒症患儿早期缺乏典型症状,导致病情评估困难,而影响预后[3]。免疫状况及炎症反应在脓毒症的发生发展中具有重要作用,高迁移率族蛋白B1(HMGB1)是一种重要的炎性介质,通过与Toll样受体结合激活炎症反应[4]。外周血中性粒细胞/淋巴细胞比值(NLR)和身体免疫状况及炎症反应密切相关,其中中性粒细胞可提示非特异性炎症,而淋巴细胞对炎症反应具有防御和调控作用[5]。降钙素原(PCT)通常在人体被细菌感染后显著升高,在检测感染性疾病上具有简单快速、重复性好的优势,已被纳入脓毒症诊断标准[6]。目前国内已有研究证实,NLR、HMGB1、PCT可用于脓毒症的诊断,但在新生儿脓毒症预后评估价值方面尚需进一步研究。本研究旨在探讨NLR、HMGB1、PCT水平与新生儿脓毒症炎性因子、脏器功能及预后的相关性,以期明确NLR、HMGB1、PCT水平在评估病情和预后方面的价值。
1 资料与方法
1.1一般资料 选择2018年6月—2021年3月我院确诊为脓毒症的61例新生儿作为研究组。纳入标准:①符合脓毒症诊断标准[7]:血液非特异性检查≥2项阳性,脑脊液检查异常,血液检出特种细菌的DNA或抗原,满足上述任一条件即可确诊;②出生3~28 d的新生儿;③产妇分娩前血常规检查无异常;④母婴临床资料完整,家属对研究知情同意。排除标准:①合并妊娠期高血压、糖尿病等可能影响NLR、HMGB1、PCT水平的产妇;②存在染色体异常、先天畸形、遗传代谢性疾病的新生儿;③合并血液或免疫系统疾病、恶性肿瘤的产妇。选择同期在我院出生的健康新生儿65例作为对照组。研究组男32例,女29例;胎龄36~40(38.15±0.73)周;早产儿17例,足月儿44例。对照组男37例,女28例;胎龄36~40(38.23±0.81)周;早产儿21例,足月儿44例。两组一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准执行。
1.2方法 所有新生儿均于纳入研究时抽取外周血2~3 ml,分为两份,一份标本肝素抗凝后,采用全自动生化分析仪检测天冬氨酸转氨酶(AST)、丙氨酸转氨酶(ALT)水平,采用血细胞分析仪检测中性粒细胞和淋巴细胞,计算NLR;另一份标本静置30 min,3000 r/min离心分离血清,采用酶联免疫吸附试验检测PCT、HMGB1、肿瘤坏死因子-α(TNF-α)、超敏C反应蛋白(hs-CRP)、尿素(BUN)、血肌酐(Scr)、肌钙蛋白I(cTnI)和肌酸激酶同工酶(CK-MB)水平,试剂盒均由北京豪迈生物工程有限公司提供。
1.3观察指标 比较研究组和对照组NLR、HMGB1、PCT、炎性因子及脏器功能指标水平;分析NLR、HMGB1、PCT与炎性因子及脏器功能指标的相关性。所有新生儿脓毒症治疗后随访28 d,根据预后情况分为死亡组和存活组,比较NLR、HMGB1、PCT水平,并分析上述指标对新生儿脓毒症预后预测价值。
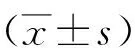
2 结果
2.1研究组和对照组NLR、HMGB1、PCT水平比较 研究组NLR、HMGB1、PCT水平高于对照组(P<0.01)。见表1。

表1 新生儿脓毒症和健康新生儿两组NLR、HMGB1、PCT水平比较
2.2研究组和对照组炎性因子和脏器功能指标比较 研究组TNF-α、hs-CRP、AST、ALT、BUN、Scr、cTnI和CK-MB水平均高于对照组(P<0.01)。见表2。

表2 新生儿脓毒症和健康新生儿两组炎性因子和脏器功能指标比较
2.3NLR、HMGB1、PCT与炎性因子及脏器功能指标相关性 NLR、HMGB1、PCT分别与TNF-α、hs-CRP、AST、ALT、BUN、Scr、cTnI、CK-MB呈正相关(P<0.01)。见表3。

表3 NLR、HMGB1、PCT与新生儿脓毒症炎性因子及脏器功能指标相关性
2.4不同预后新生儿脓毒症NLR、HMGB1、PCT水平比较 随访28 d后,61例新生儿脓毒症中死亡10例。死亡组NLR、HMGB1、PCT水平高于存活组(P<0.01)。见表4。

表4 不同预后新生儿脓毒症NLR、HMGB1、PCT水平比较
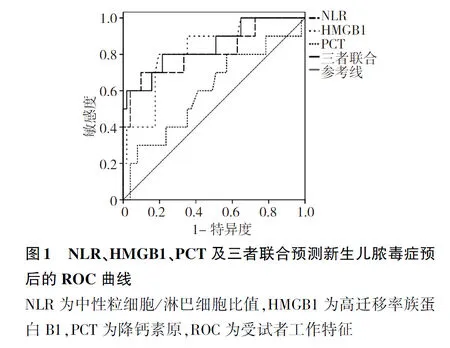
2.5NLR、HMGB1、PCT对新生儿脓毒症预后预测价值 ROC曲线分析显示,NLR、HMGB1、PCT均对新生儿脓毒症预后具有较好的预测价值,但三者联合预测的曲线下面积为0.845,敏感度为83.00%,均最高。见表5和图1。

表5 NLR、HMGB1、PCT及三者联合预测新生儿脓毒症预后的ROC曲线结果
3 讨论
脓毒症是新生儿时期的危重症,临床症状和体征隐匿且缺乏特异性,目前仍缺乏理想的实验室指标协助其病情评估。近年来多种生化标志物应用于临床检测感染性疾病,并表现出良好的诊断效能。新生儿受胎龄、应激反应、自身免疫力低等因素影响,导致实验室检验指标的判读与成人存在一定差异,给新生儿疾病的诊疗带来了一定的困难。
PCT在检测新生儿感染性疾病方面表现出较好的优势,其水平高低可判断感染程度,也能作为监测抗菌药物治疗时间的有效指标。PCT是降钙素的初级代谢产物,细菌感染时,促炎因子会促使全身多种细胞释放PCT,引起血液中PCT水平升高[8]。HMGB1由活化的单核或巨噬细胞、坏死细胞释放,通过相关受体信号传导通路刺激多种炎性介质的产生和释放,从而增强机体炎症反应[9]。NLR是系统性炎症生物标志物,可反映机体免疫平衡失调和全身炎症反应情况。近年研究发现,NLR与心血管疾病、自身免疫性疾病、感染性疾病等的发生密切相关[10-11]。国外研究证实,脓毒症患儿体内PCT、NLR水平高于健康新生儿[12-13]。本研究显示,研究组NLR、HMGB1、PCT水平高于对照组,提示NLR、HMGB1和PCT水平的异常变化与脓毒症密切相关。分析其原因为脓毒症会使骨髓内成熟中性粒细胞迅速动员,引起循环中性粒细胞明显增加,从而导致NLR水平升高;脓毒症是病原菌产生的毒素入血后导致的炎症反应,细菌感染时肝脏内巨噬细胞、肠道淋巴细胞大量释放PCT和HMGB1,导致二者水平升高[14]。
病原菌入侵机体产生的毒素以及炎症反应,会对脓毒症患儿的脏器功能造成损伤,严重者会因多脏器功能障碍而死亡[15-16]。本研究结果显示,研究组炎性因子和脏器功能指标水平均高于对照组,提示新生儿脓毒症存在明确的炎症反应和脏器功能损伤。本研究通过相关性分析发现,NLR、HMGB1、PCT分别与TNF-α、hs-CRP、AST、ALT、BUN、Scr、cTnI、CK-MB呈显著正相关,提示NLR、HMGB1、PCT水平的变化可客观反映机体炎症反应和脏器功能损伤程度,有利于辅助评估患儿病情进展。脓毒症的发生会导致机体非特异性免疫功能紊乱,随着病情进展,感染以及免疫功能紊乱加剧,进而导致肝细胞坏死、肾功能损伤[17];同时炎症反应还会导致心肌组织损伤,引起cTnI、CK-MB等释放。此外,本研究还显示死亡组NLR、HMGB1、PCT水平高于存活组,NLR、HMGB1、PCT均对新生儿脓毒症预后具有较好的预测价值,但三者联合预测的曲线下面积及敏感度最高,提示PCT、NLR和HMGB1对预测新生儿脓毒症的不良预后具有重要意义。
综上所述,PCT、NLR和HMGB1水平与新生儿脓毒症炎症反应程度以及脏器功能损伤密切相关,同时对不良预后具有较好的预测价值,可为临床病情进展和预后评估提供客观依据。但本研究为单中心回顾性研究,样本量少,后期可进一步通过多中心、大样本数据论证本研究结果。
