lncRNA RPAIN在子痫前期患者胎盘组织中的表达及对滋养细胞增殖和侵袭的影响
2021-12-24朱清华
赵 丹,安 杰,刘 倩,李 力,朱清华
子痫前期又称为先兆子痫,指妊娠期出现血压升高和尿蛋白增加,如果在轻度子痫前期病情控制不理想,就会发展成为重度子痫前期,出现肝脏损伤、心力衰竭、胎儿发育受限、肾功能异常等[1-3]。子痫前期的发生可能与母体、胎盘、胎儿等多种因素具有相关性[4]。长链非编码RNA(lncRNA)是一类长度>200 nt的非编码RNA,在表观遗传学、转录调控及转录后调控方面发挥重要作用[5]。有研究表明,lncRNA可能参与子痫前期的发生和发展[6]。本研究探讨lncRNA RPAIN在子痫前期患者胎盘组织中的表达及对滋养细胞增殖和侵袭的影响及相关机制。
1 材料与方法
1.1材料
1.1.1主要试剂:胎盘滋养细胞株HTR-8/SVneo购自中科院上海细胞库;胎牛血清、PRIM1640培养基购自美国Hyclone公司;MTT试剂购自北京索莱宝生物科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自赛默飞世尔科技有限公司;PCR引物购自上海生工生物工程有限公司;Transwell小室购自美国Corning公司;Matrigel胶购自美国BD公司;BCA蛋白测定试剂盒购自上海碧云天生物科技有限公司;Wnt/β-catenin信号通路特异性抑制剂ICG001购自美国Selleck公司;基质金属蛋白酶-9(MMP-9)、Wnt5a、β-catenin、血管内皮生长因子(VEGF)和β-actin单克隆抗体及辣根过氧化物酶标记的山羊抗兔二抗均购自北京中杉金桥生物科技有限公司;si-NC、si-RPAIN购自广州市锐博生物科技有限公司。
1.1.2组织标本:选取2018年8月—2019年12月在我院剖宫产分娩的30例子痫前期作为试验组,排除多胎及生殖器官畸形,妊娠期糖尿病、原发高血压病、慢性肾炎等。同期选取30例剖宫产分娩的正常妊娠孕妇作为对照组。试验组和对照组孕妇均为单胎且剖宫产分娩。取胎盘母体面距脐带附着处2~3 cm的胎盘组织标本,避开机化灶、钙化灶、出血灶。两组年龄、孕周、孕次等一般资料比较差异无统计学意义(P>0.05),具有可比性。本研究经医院医学伦理委员会批准执行,患者及家属均签署知情同意书。
1.2细胞培养和分组 HTR-8/SVneo细胞使用含10%胎牛血清的PRIM1640培养基,置于37 ℃、含5% CO2培养箱中培养,倒置显微镜下观察细胞增殖状态,若细胞增殖良好,融合度达80%~90%时进行传代。将HTR-8/SVneo细胞分为NC组、si-NC组和si-RPAIN组。NC组为空白对照,si-NC组和si-RPAIN组为分别转染si-NC和si-RPAIN的HTR-8/SVneo细胞,转染过程严格按照Lipofectamine2000说明书操作,培养48 h后收集细胞检测转染效果,合格后进行后续实验;在转染si-RPAIN的HTR-8/SVneo细胞中加入ICG001处理,作为ICG001处理组。
1.3RT-qPCR检测RPAIN表达水平 试验组和对照组的胎盘组织使用0.9%氯化钠注射液冲洗干净,置于液氮中冻存。将冻存的胎盘组织取出,使用Trizol试剂提取细胞总RNA,逆转录试剂盒逆转录为cDNA,PrimeScript RT Master Mix试剂盒进行Realtime PCR扩增反应,SYBR® Premix Ex TaqTM试剂盒进行PCR。反应条件为95 ℃ 5 min,95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环;60 ℃延长5 min。以β-actin为内参,采用2-ΔΔCt法计算RPAIN相对表达量。RPAIN上游引物:5'-CGCTCCCTGTACAAACTGGT-3',下游引物:5'-GCCATAGTTTCATGGCAGGC-3';β-actin上游引物:5'-GACTCATGACCACAGTCCATGC-3',下游引物:5'-AGAGGCAGGGATGATGTTCTG-3'。
1.4MTT法检测细胞增殖能力 各组细胞培养48 h,以2.5×105/ml接种于96孔板,每孔100 μl,继续培养24 h,然后每孔加入MTT试剂20 μl,继续培养4 h,弃去上清液,每孔加入DMSO 150 μl,室温孵育5 min,用酶标仪检测实验孔在450 nm的光密度(OD)值。
1.5流式细胞术检测细胞凋亡率 各组细胞培养48 h后用预冷的PBS漂洗2次,与500 μl的结合缓冲液混匀。先加入10 μl的Annexin V-FITC,再加入5 μl的PI,混匀后避光孵育10 min。用流式细胞仪检测细胞凋亡率。
1.6Transwell实验检测细胞侵袭能力 各组细胞培养48 h,用稀释的基质胶包被Transwell上室膜进行侵袭实验。每组取1×104个HTR-8/SVneo细胞接种于Transwell上室,加入200 μl无血清培养基。下室加入500 μl含10%胎牛血清的细胞培养基作为诱导剂。培养箱孵育24 h,棉签除去基质胶和未过膜细胞。用4%多聚甲醛溶液固定侵袭过膜的细胞,结晶紫染色15 min。显微镜观察细胞,随机选取5个视野计数,计算平均数表示细胞侵袭数。
1.7Western blot检测蛋白表达 各组细胞培养48 h,裂解细胞提取总蛋白,BCA蛋白测定试剂盒检测蛋白质浓度。采用SDS-PAGE凝胶电泳分离等量的蛋白,并利用湿法转膜仪转移至PVDF膜,封闭液封闭,加入MMP-9、Wnt5a、β-catenin和VEGF一抗(稀释比例均为1∶1000),4 ℃孵育过夜。然后加入二抗(稀释比例均为1∶5000),孵育2 h,显影,定影,应用Quantity One软件测定各组蛋白条带的灰度值,以目的条带和β-actin条带的比值作为蛋白表达水平。
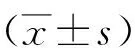
2 结果
2.1胎盘组织RPAIN表达水平比较 对照组胎盘组织RPAIN表达水平为1.00±0.10,试验组为3.82±0.34。与对照组比较,试验组胎盘组织RPAIN表达水平明显升高,差异有统计学意义(P<0.01)。
2.2沉默RPAIN对HTR-8/SVneo细胞增殖的影响 si-NC组RPAIN表达水平、OD值与NC组比较差异无统计学意义(P>0.05)。与si-NC组比较,si-RPAIN组RPAIN表达水平明显降低,OD值明显升高,差异有统计学意义(P<0.01)。见表1。

表1 3组HTR-8/SVneo细胞RPAIN表达水平和OD值的比较
2.3沉默RPAIN对HTR-8/SVneo细胞凋亡的影响 NC组、si-NC组和si-RPAIN组细胞凋亡率分别为(16.88±2.39)%、(17.26±2.52)%和(8.12±1.08)%。si-NC组细胞凋亡率与NC组比较差异无统计学意义(P>0.05)。与si-NC组比较,si-RPAIN组细胞凋亡率明显降低,差异有统计学意义(P<0.01)。见图1。

2.4沉默RPAIN对HTR-8/SVneo细胞侵袭的影响 si-NC组细胞侵袭数、MMP-9蛋白表达水平与NC组比较差异无统计学意义(P>0.05)。与si-NC组比较,si-RPAIN组细胞侵袭数明显增加,MMP-9蛋白表达水平明显升高,差异有统计学意义(P<0.01)。见图2,表2。


表2 3组HTR-8/SVneo细胞侵袭数和MMP-9蛋白表达比较
2.5沉默RPAIN对HTR-8/SVneo细胞Wnt/β-catenin信号通路相关蛋白表达的影响 si-NC组细胞Wnt5a、β-catenin、VEGF蛋白表达水平与NC组比较差异无统计学意义(P>0.05)。与si-NC组比较,si-RPAIN组Wnt5a、β-catenin、VEGF蛋白表达水平明显升高,差异有统计学意义(P<0.01)。见表3,图3。

表3 3组HTR-8/SVneo细胞Wnt/β-catenin信号通路相关蛋白表达比较

2.6ICG001逆转沉默RPAIN对HTR-8/SVneo细胞增殖和侵袭的影响 与si-RPAIN组比较,ICG001处理组OD值、MMP-9、Wnt5a、β-catenin、VEGF蛋白表达水平明显降低,细胞凋亡率明显升高,细胞侵袭数明显减少,差异有统计学意义(P<0.01)。见表4。

表4 si-RPAIN组和ICG001处理组HTR-8/SVneo细胞增殖和侵袭指标比较
3 讨论
子痫前期是妊娠期常见的疾病,是导致孕妇和胎儿死亡的重要原因之一[7]。子痫前期的发病机制可能与胎盘发育受损有关,进而引起内皮功能障碍、全身炎症反应、氧化应激等一系列病理过程[8-9]。有证据揭示,lncRNA RPAIN在子痫前期胎盘组织中呈高表达,在疾病的发展过程中发挥关键调控作用[10]。本研究结果发现,与对照组比较,试验组胎盘组织RPAIN表达水平明显升高,与上述研究结果一致。
研究表明,lncRNA通过影响滋养细胞增殖、凋亡、迁移和侵袭,参与子痫前期的发生与进展[11]。陈小斌和乔宠[12]研究表明,lncRNA TINCR在胎盘组织和滋养细胞中表达水平明显升高,还能抑制HTR-8/SVneo细胞的增殖、迁移和浸润。陈芳荣等[13]研究表明,lncRNA KCNQ1OT1能负调控miR-146a-3p的表达,促进滋养细胞的增殖、迁移和侵袭。陈国庆[14]研究表明,重度子痫前期患者胎盘组织中lncRNA DANCR表达量减少,并影响滋养细胞的生物学行为。彭迎春等[15]研究表明,lncRNA-SNHG5通过调控miR-155表达,影响滋养细胞增殖能力。以上研究均表明子痫前期的发生、进展与lncRNA密切相关。本研究通过转染si-RPAIN沉默HTR-8/SVneo细胞中RPAIN的表达,结果发现,沉默RPAIN后HTR-8/SVneo细胞OD值和MMP-9蛋白表达明显升高,细胞侵袭数明显增加,细胞凋亡率明显降低。表明沉默RPAIN能够促进HTR-8/SVneo细胞的增殖和侵袭能力,并抑制细胞凋亡。
β-catenin信号通路参与人体的多种正常生理过程。高度保守的Wnt信号通路能够调控人体的生长发育、疾病、衰老、死亡等生命过程[16]。马云鹏[17]研究发现,sFRP5能够抑制滋养细胞、内皮细胞的侵袭和迁移能力,其抑制作用通过Wnt/β-catenin信号通路介导,并进一步参与子痫前期的发生与发展。研究证实,Wnt/β-catenin信号通路能对重度子痫前期患者胎盘滋养层细胞的侵袭和增殖产生影响[18-19]。还有研究显示,SATB1通过调控Wnt/β-catenin信号通路使滋养细胞的侵袭力减弱,最终导致子痫前期的发生[20]。有学者发现,miR-152通过Wnt1/β-catenin信号通路参与子痫前期发病过程[21]。本研究结果显示,与si-NC组比较,si-RPAIN组Wnt5a、β-catenin、VEGF蛋白表达水平明显升高。为进一步探究沉默RPAIN是否通过Wnt/β-catenin信号通路影响HTR-8/SVneo细胞的增殖和侵袭,本实验在沉默RPAIN的HTR-8/SVneo细胞中添加Wnt/β-catenin信号通路特异性抑制剂ICG001,结果发现,ICG001能够有效逆转沉默RPAIN对HTR-8/SVneo细胞增殖和侵袭的促进作用。以上研究数据表明,沉默RPAIN能够通过激活Wnt/β-catenin信号通路促进HTR-8/SVneo细胞的增殖和侵袭。
综上所述,RPAIN在子痫前期患者胎盘组织中的表达升高,沉默RPAIN能够通过激活Wnt/β-catenin信号通路促进滋养细胞增殖和侵袭,进而参与子痫前期的发病。
