吡虫啉、苯醚甲环唑和百菌清在甘蓝中的消解及残留分布
2021-12-23高庆超胡家萌李亚辉张志勇
高庆超, 胡家萌, 李亚辉,2, 梁 颖*,,2, 张志勇*,,2
(1. 江苏省食品质量安全重点实验室,南京 210014;2. 江苏省农业科学院 农产品质量安全与营养研究所,南京 210014)
甘蓝茎叶脆嫩,富含维生素C、叶酸、异硫氰酸盐和酚酸等多种营养成分[1-3],具有抗氧化[4-5]、抑制肿瘤[6-7]和保护心血管健康[8]等多种生理活性功能,在居民饮食健康方面占据重要地位[9]。甘蓝生长过程中易受病虫害侵染,软腐病、黑斑病以及菜青虫、蚜虫等均会严重影响甘蓝的产量和品质,而施用农药是避免或降低病虫害危害的必要手段。吡虫啉登记用于甘蓝的产品超过100 种,主要用于防治甘蓝蚜虫;百菌清登记用于叶菜类蔬菜的产品超过10 种,主要用于防治叶菜类蔬菜白粉病和霜霉病,但登记用于甘蓝的产品仅1 种,用于防治甘蓝霜霉病;苯醚甲环唑虽没有登记用于甘蓝的产品,但有20 余种登记用于防治大白菜黑斑病[10]。黑斑病也是甘蓝的主要病害,实际调研中发现,苯醚甲环唑用于甘蓝黑斑病防治的情况时有出现,中国国家标准中也对苯醚甲环唑在结球甘蓝中的限量做出了规定[11]。
近年全国各省、市食用农产品质量安全例行监测及农产品质量安全监督抽查公布数据,发现我国农产品质量安全合格率虽已有大幅提升,但叶菜类蔬菜合格率相比其他蔬菜较低,其中,近些年来,在河南省、陕西省及四川省成都市、河北省石家庄市等地采集的大批蔬菜样品中,吡虫啉、苯醚甲环唑和百菌清的超标率和检出率较高[12-15]。甘蓝是叶菜类蔬菜中重要的蔬菜,其生长周期短,施用农药时直接喷洒在可食用部分,采收间隔期短,居民消费量高,因此,甘蓝中农药残留的风险不容忽视。
目前已有采用液相色谱串联质谱 (LC-MS/MS)技术检测吡虫啉和苯醚甲环唑在蕹菜、秋葵等蔬菜残留的报道[16],而百菌清的残留分析多采用气相色谱法 (GC) 进行[17-19]。针对目前叶菜类蔬菜中农药残留现状及安全风险,本研究以露地栽培的甘蓝为对象,选择叶菜类蔬菜中常用及检出率较高的吡虫啉、苯醚甲环唑和百菌清,通过田间试验,分别采用LC-MS/MS 和GC 检测方法,研究3 种农药在露地甘蓝中的消解动态和残留分布规律,以期为其在甘蓝中的合理使用和安全食用提供理论参考。
1 材料与方法
1.1 仪器和试剂
Agilent 1290-6470 液相色谱-质谱联用仪和Agilent 6890B 气相色谱仪 (Agilent,美国) ;NEVAP 型氮吹仪 (Organomation,美国) ;液氮打样机 (Philips,美国) ;WH-3 微型旋涡混合仪 (上海沪西分析仪器厂有限公司) ;超纯水仪 (Millipore,法国) 。
吡虫啉 (imidacloprid)、苯醚甲环唑 (difenoconazole)、百菌清 (chlorothalonil) 标准品 (≥99%,Sigma 公司);10% 吡虫啉可湿性粉剂 (甘蓝中推荐用量为有效成分 22.5~30 g/hm2,山东曹达化工有限公司);10%苯醚甲环唑水分散粒剂 (大白菜中推荐用量为有效成分52.5~75 g/hm2,瑞士先正达作物保护有限公司);75% 百菌清可湿性粉剂 (甘蓝中推荐用量为有效成分1 271.25~1 721.25 g/hm2,山东大成生物化工有限公司);N-丙基乙二胺固相吸附剂 (PSA,Agela Technologies 公司);乙腈 (色谱纯,德国Merck 公司);氯化钠 (分析纯,西陇化工股份有限公司);正己烷 (色谱纯,上海中实化工总公司)。
1.2 田间试验
试验在江苏省农业科学院院内试验田中进行。参照NY/T 788—2018《农作物中农药残留试验准则》要求[20],设计消解动态试验和最终残留试验。供试甘蓝品种为京丰1 号结球甘蓝 (Brassica oleraceaL.var.capitataL.,中蔬种业科技有限公司) 。露地栽种甘蓝,小区面积为50 m2,小区定苗300 株左右,小区间设保护行,另设空白对照小区,常规管理。甘蓝长至结球中期时进行喷雾施药,每处理设3 次重复,随机排列,施药剂量 (有效成分) 为:吡虫啉30 g/hm2,苯醚甲环唑75 g/hm2,百菌清1 721.25 g/hm2,喷雾量600 L/hm2。
1.2.1 消解动态试验 于甘蓝长至结球中期时喷雾施药1 次,分别于施药后0(2 h)、1、3、5、7、10 和14 d 采集样品。采用五点取样法采集生长正常、没有病害的甘蓝样品2 kg 左右,四分法缩分留样250 g,一部分切碎、匀浆后于 −20 ℃储存,待测;另一部分分别取外叶 (除甘蓝球外的莲座叶) 、外球叶 (甘蓝球外部包裹的2~3 片叶片)和内球叶 (除去甘蓝外球叶的部分) ,切碎、匀浆后于 −20 ℃中储存,待测。
1.2.2 最终残留试验 于甘蓝长至结球中期时喷雾施药2 次和3 次,施药间隔期为7 d,分别于施药后0(2 h)、7 和14 d 采样,采样方法同1. 2. 1 节。
1.3 测定方法
1.3.1 样品提取及净化 准确称取10 g 样品于50 mL 离心管中,加入10 mL 乙腈,振荡提取20 min 后,加入5 g 氯化钠,继续振荡2 min 后于5 000 r/min 下离心5 min;移取2 mL 上清液于10 mL 离心管中,加入0.2 g 无水硫酸镁和50 mg PSA,涡旋1 min 后于5 000 r/min 下离心5 min;取上清液过0.22 μm 滤膜,待LC-MS/MS 法检测吡虫啉和苯醚甲环唑;取上清液1 mL 于20 mL 玻璃试管中,氮吹至近干,用正己烷定容至10 mL,过0.22 μm 滤膜,待GC 检测百菌清。
1.3.2 仪器检测条件 LC-MS/MS 条件:Agilent ZORBAX SB-C18色谱柱 (2.1 mm × 50 mm,3.5μm);流动相为V(乙腈) :V(体积分数为0.1%的甲酸水溶液) = 90 : 10;流速0.3 mL/min,柱温30 ℃;进样量5 μL。
6470 电喷雾三重四极杆串联质谱条件 : 正离子 (ESI+) 模式;离子源温度150 ℃;雾化器压力241.32 kPa;干燥气流速8.0 L/min;干燥气温度350 ℃;毛细管电压4.0 kV。吡虫啉和苯醚甲环唑质谱参数见表1。

表1 吡虫啉和苯醚甲环唑碎片离子及质谱参数Table 1 Transitions and mass spectrometry parameters of imidacloprid and difenoconazole
GC 条件:AB-5 毛细管柱 (0.25 mm × 30 mm,0.25 μm);不分流;载气为氮气,流速1 mL/min;进样量1 mL;进样口温度260 ℃;程序升温:初始温度80 ℃,保持1 min,以20 ℃/min 的速率升温到260 ℃,保持10 min;电子捕获检测器,检测器温度280 ℃。
1.3.3 标准溶液配制和标准曲线绘制 分别准确称取吡虫啉和苯醚甲环唑标准品各10 mg,用甲醇溶解,配成1 000 mg/L 的标准储备液;准确称取百菌清标准品10 mg,用正己烷溶解,配成1 000 mg/L 的标准储备液于4 ℃下遮光保存。用空白甘蓝基质提取液稀释各储备液,配制成质量浓度分别为0.01、0.02、0.05、0. 1、0.2、0.5和1 mg/L 的基质匹配标准溶液,按 1.3.2 节的条件检测,得出响应峰面积-标准溶液质量浓度标准曲线,并建立回归方程。
1.3.4 添加回收及最低检出限试验 称取10 g 甘蓝空白样品,分别添加0.05、0.1 和0.5 mg/kg 3 个水平的吡虫啉、苯醚甲环唑和百菌清标准溶液,每个水平5 次重复,同时设空白对照,按照1.3.1 节进行提取净化,1.3.2 节的条件进行检测,计算添加回收率和相对标准偏差 (RSD)。按 3 倍信噪比计算各农药的检出限 (LOD)。
2 结果与分析
2.1 方法的线性曲线、检出限、准确度及精密度
结果(表2)表明:在0.01~1 mg/L 质量浓度范围内,吡虫啉、苯醚甲环唑和百菌清在甘蓝基质中的质量浓度与响应值有良好的线性关系。
LC-MS/MS 检测吡虫啉、苯醚甲环唑的LOD 均为0.01 mg/kg,GC 检测百菌清的LOD 为0.001 mg/kg (表2)。添加回收实验结果 (表3) 表明:甘蓝中吡虫啉的平均回收率为90%~98%,RSD 为1.1%~2.2%,苯醚甲环唑的平均回收率为89%~97%,RSD 为1.7%~2.1%;百菌清的平均回收率为92%~102%,RSD 为0.87%~3.7%。所建立的方法符合农药残留分析的要求[19]。

表2 3 种农药的标准曲线及检出限Table 2 Equation of linear regression and LODs of three pesticides

表3 3 种农药在甘蓝中的添加回收率及相对标准偏差Table 3 Recovery and RSD of three pesticides in cabbage
2.2 3 种农药在甘蓝中的消解动态
由表4 可知,3 种农药在甘蓝中的消解动态均符合一级动力学方程。吡虫啉于施药后3 d、苯醚甲环唑于施药后5 d 和百菌清于施药后14 d,消解率达到80%以上,其中吡虫啉于施药10 d 后已达到未检出状态。3 种农药中,吡虫啉消解最快,苯醚甲环唑次之,百菌清最慢,消解半衰期分别为1.35、2.28 和2.47 d,均属于易降解农药 (< 30 d)。

表4 3 种农药在甘蓝中的消解动态Table 4 Dissipation dynamics of 3 pesticides in cabbage
关于吡虫啉在蔬菜中消解动态的研究报道较少,矫健等[21]的研究显示,吡虫啉在不同蔬菜中的半衰期差异大,其中在甘蓝中的半衰期为1.4 d,本研究结果与之基本一致。关于苯醚甲环唑在水果、稻米中的消解动态研究较多[22],在蔬菜中的研究极少,仅有Wang 等[23]报道了苯醚甲环唑在大白菜中的半衰期在6.6~7.8 d 之间,而本研究结果与之相比半衰期时间较短,表明研究对象和气候条件不同均可能影响农药的半衰期。虽然百菌清在蔬菜中的消解动态研究报道较多,但尚未见其在甘蓝中消解的报道。Abd Al-Rahman 等[24]报道番茄中百菌清半衰期为2.06 d,本研究结果与之接近。
2.3 3 种农药在甘蓝中的最终残留量
由表5 可知,吡虫啉在甘蓝采收间隔期7 d 时的残留量已低于其MRL 值 (1 mg/kg),14 d 时未检出;苯醚甲环唑在甘蓝采收间隔期14 d 时的残留量为0.23 mg/kg,仍高于其MRL 值 (0.2 mg/kg);百菌清在间隔期14 d 时的残留量低于其MRL 值(5 mg/kg)。

表5 3 种农药在甘蓝中的最终残留量Table 5 Terminal residues of 3 pesticides in cabbage
2.4 3 种农药在甘蓝不同部位中的残留分布
按推荐剂量的最高剂量在露地甘蓝上分别喷雾施用吡虫啉、苯醚甲环唑和百菌清,从施药后2 h开始,按不同采收间隔期采集甘蓝外叶、甘蓝外球叶以及甘蓝内球叶进行检测,结果见表6。可见:对于吡虫啉,甘蓝内球叶在施药3 d 后未检出;外球叶和外叶中检出量分别在施药1 d 和3 d 后低于MRL 值。对于苯醚甲环唑,甘蓝内球叶在施药 3 d 后未检出;外球叶中检出量在施药5 d 后低于MRL 值;外叶中检出量在施药 14 d 后降至0.31 mg/kg,含量依然较高。对于百菌清,甘蓝内球叶未检出;外球叶中检出量在施药1 d 后降至MRL 值以下;外叶中检出量在施药14 d 后降至6.32 mg/kg,仍高于MRL 值。3 种农药在甘蓝内球叶、外球叶及外叶不同部位的残留差异显著(P<0.05) ,甘蓝外叶>甘蓝外球叶>甘蓝内球叶。甘蓝内球叶中农药残留未检出或检出量非常低,外球叶中初始含量较低,在1 d 至5 d 可降至MRL值以下,表明农药残留主要集中在外叶,苯醚甲环唑和百菌清在施药14 d 后含量仍在MRL 值以上,建议消费者避免食用甘蓝外叶。
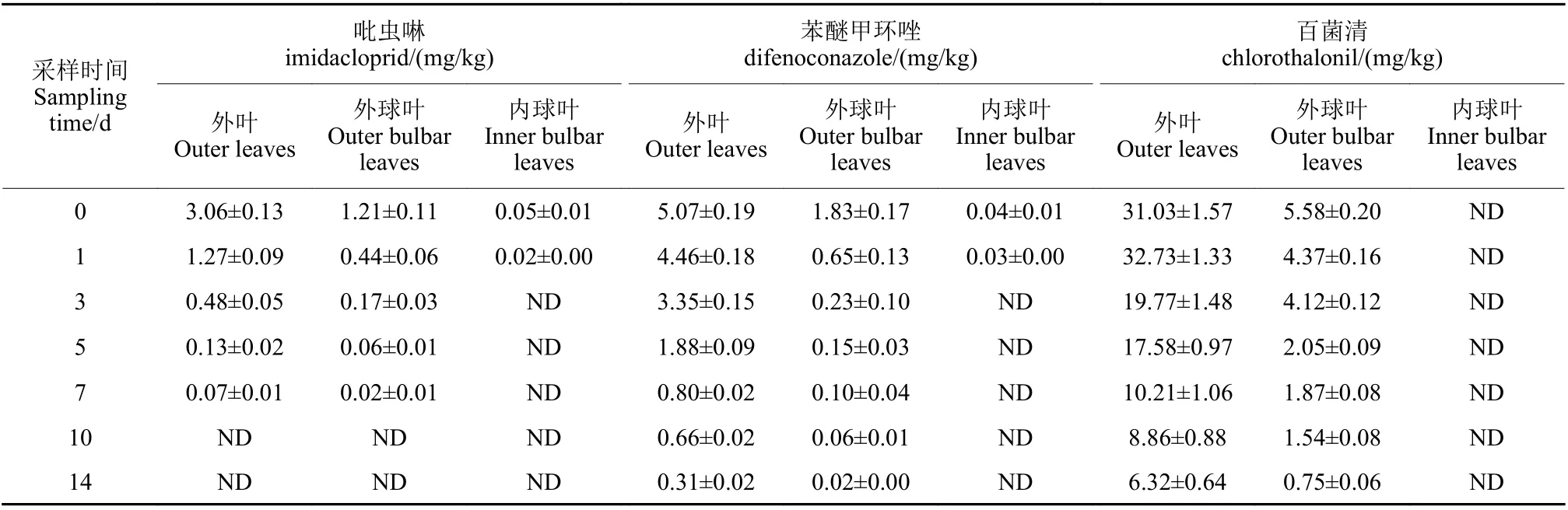
表6 3 种农药在甘蓝不同部位的残留量Table 6 Residues of three pesticides in different parts of cabbage
3 结论
本研究以露地栽培甘蓝为对象,采用LCMS/MS 和GC 检测方法研究了吡虫啉、苯醚甲环唑和百菌清在露地甘蓝中的消解动态以及残留规律。结果发现,3 种农药在露地甘蓝中的消解动态均符合一级反应动力学模型,半衰期分别为1.35、2.28 和2.47 d,均属于易降解农药,其中吡虫啉消解最快,百菌清最慢。最终残留试验结果表明,甘蓝中吡虫啉、百菌清分别在施药7 和14 d 后降至食品中农药最大残留限量值以下,而苯醚甲环唑残留量在施药14 d 后未能达标。3 种农药在露地甘蓝不同部位的残留差异显著 (P<0.05),残留量由高到低:甘蓝外叶>甘蓝外球叶>甘蓝内球叶。甘蓝内球叶中农药残留未检出或极低,外球叶中初始含量较低,1 至5 d 可降至最大残留限量值以下,外叶农药残留显著高于其他部位。甘蓝外叶为非主要食用部位,可以认为吡虫啉、苯醚甲环唑和百菌清按照推荐剂量最高剂量及施用次数在露地甘蓝上施用,在采收间隔期大于7 d 前提下,农药残留量可满足食品中农药最大残留限量要求。建议采后处理甘蓝时去除其外叶,以降低甘蓝中的农药残留量,提高质量安全水平。本研究结果可为露地甘蓝中农药的安全、科学使用提供科学依据,同时为引导消费者安全饮食提供服务。
