外源单宁酸对茶叶中农药胁迫作用的缓解效应
2021-12-23刘尚可潘灿平贾厚振刘铭钰
刘尚可, 王 越, 潘灿平, 贾厚振, 刘铭钰, 邹 楠*,
(1. 山东农业大学 植物保护学院 农药毒理与应用技术重点实验室,山东 泰安 271018;2. 中国农业大学 理学院 应用化学系农药创新研究中心,北京 100193;3. 山东省农业科学院 茶叶研究所,济南 250131;4. 山东省临沂市农业技术推广中心,山东 临沂 276007)
茶叶作为中国具有资源优势、文化底蕴和消费传统的特色农产品,是人类饮食中最受欢迎的植物之一。茶叶具有保健功能,可降低人体内胆固醇,减低心脑血管发病率,提高免疫力[1]。但在栽培过程中病虫害多发,农药施用频繁,茶园化学农药不合理使用现象突出[2],导致土壤污染增加,茶叶生长受损[3]。据国家茶叶质量监督检验中心抽样监测发现,茶叶中联苯菊酯严重超标,含量在0.03~0.15 mg/kg 之间,超过其最大残留限量值 (0.005 mg/kg)[4]。此外,农药过度施用还可能破坏茶树的各种代谢过程,诱导活性氧 (ROS) 的形成,影响茶叶的生理和生化特征,包括营养成分、颜色和风味[5]。研究表明,茶树上施用联苯菊酯对茶叶色泽、质感、茶多酚含量、水浸出物、香气成分、氨基酸和黄铜含量都有一定的影响[6]。
单宁酸 (tannic acid,图式1) 因其内部核心结构具有疏水性、外部结构属于亲水结构而使其成为水溶性抗氧化剂[7]。单宁酸可直接与氧分子发生反应,或氧化成醌类,或电离成苯酚离子,发挥抗氧化作用[8]。单宁酸可以作为熟制鸡肉中优良的抗氧化剂,降低脂类和蛋白质的氧化[9]。单宁酸会影响葡萄酒的质量,增强抗氧化能力,在葡萄酒陈年过程中,单宁酸可改善葡萄酒的颜色和风味[10-11]。基于单宁酸优异的抗氧化、抗菌性功能,推测其可能会对缓解农药等非生物胁迫有积极的作用。本研究拟通过茶叶中抗氧化酶活性和非酶物质含量的变化,以及茶叶营养物质水平的变化,探究外源单宁酸在缓解茶叶农药胁迫中的积极作用,旨在为改善茶叶品质提供理论依据,并为深入探索植物对农药胁迫的响应机制奠定基础。
1 材料与方法
1.1 试验材料
1.1.1 仪器和试剂 BIOTEK 多功能酶标仪 (美国伯腾仪器有限公司) ;UV-1780 紫外-可见分光光度计 (岛津公司) ;安捷伦1200 高效液相色谱仪(安捷伦科技有限公司) ;BSA124S 万分之一电子天平 (塞多利斯科学仪器有限公司) ;MTV-100 多管涡旋振荡器 (杭州奥盛仪器有限公司) ;TDL-40B 低速大容量离心机 (上海安亭科学仪器厂) ;HC-2517 高速离心机 (安徽中科中佳科学仪器有限公司) ;T10 高速均质仪 (德国 IKA 公司) 。
98%吡虫啉 (imidacloprid) 、97%联苯菊酯(bifenthrin) 和98%吡唑醚菌酯 (pyraclostrobin) 原药,山东康桥生物科技有限公司;单宁酸、氯化钠和无水硫酸镁 (分析纯) ,天津市凯通化学试剂有限公司;乙腈 (色谱纯) ,默克化工技术 (上海)有限公司;甲醇 (色谱纯) 和乙酸铵 (分析纯) ,阿拉丁试剂 (上海) 有限公司;99%没食子酸 (GA)和98% 谷氨酸标准品,上海安耐吉化学有限公司; 99%咖啡碱标准品,北京伊诺凯科技有限公司;超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶 (CAT) 、抗坏血酸过氧化物酶 (APX) 、谷胱甘肽 (GSH) 、丙二醛 (MDA) 、脯氨酸 (Pro)和自由基清除率及总抗氧化能力试剂盒,苏州科铭生物技术有限公司;乙二胺四乙酸 (EDTA),山东锦沅新材料科技有限公司;磷酸缓冲盐溶液(PBS),武汉普诺赛生命科技有限公司;聚乙烯吡咯烷酮 (PVP),上海安耐吉化学有限公司。
1.1.2 生物试材 供试茶树Camellia sinenesis(L.)O. kuntze 品种为福鼎大白,茶苗由临沂临港经济开发区春秋茶业有限公司提供。挑选叶片健康、生长状况良好、大小形状相似的茶苗,定植于直径为20 cm 的盆中,置于25 ℃的温室中培养至株高15~20 cm 时用于盆栽试验。
1.2 试验方法
1.2.1 药剂配制与施用 准确称取吡虫啉原药0.102 0 g、联苯菊酯原药0.103 1 g 和吡唑醚菌酯原药0.102 0 g,分别用乙腈溶解,配制成质量浓度为1 000 mg/L 的标准储备母液,再用去离子水稀释相应倍数且无晶体析出,待用。试验均采用叶面喷雾法施药。单宁酸用去离子水稀释成相应浓度。
1.2.2 药剂浓度筛选 根据农药登记的茶园防治病虫害中最常用的吡虫啉、联苯菊酯和吡唑醚菌酯3 种农药,结合大田推荐剂量 (有效成分分别为:21~42 g/hm2、30~37.5 g/hm2和56.25~112.5 g/hm2) ,吡虫啉和联苯菊酯的质量浓度设置10、20、50 和100 mg/L 4 个梯度,吡唑醚菌酯设置20、50、100 和200 mg/L 4 个梯度。用于筛选对茶叶产生氧化胁迫的药剂浓度。
1.2.3 单宁酸浓度筛选 单宁酸浓度越高,对氧化反应的抑制作用越强,但超过阈值后,氧化速率趋于恒定,会出现饱和效应[12]。参考外源单宁酸对黄瓜植株施用噻虫胺后氧化应激行为和植株生长的影响[13],并结合单宁酸的浓度效应,根据预试验确定单宁酸的质量浓度为5、10 和20 mg/L。
1.2.4 试验设计与样品采集 吡虫啉、联苯菊酯和吡唑醚菌酯分别设置空白对照、农药、农药 +5 mg/L 单宁酸、农药 + 10 mg/L 单宁酸、农药 +20 mg/L 单宁酸,共15 个处理。每一处理设置9 盆,每盆种4 株茶苗。参考3 种农药登记的安全间隔期,分别于施药后3、5、7、14 和21 d 采用随机取样法采集茶叶样品。根据农事操作实际采茶要求,取茶苗植株的新鲜嫩叶,加入液氮研磨粉碎,装入自封袋并于 −80℃保存,用于抗氧化酶活性、非酶物质含量和营养物质含量测定。每处理采集9 个重复样本,试验重复3 次。
1.2.5 抗氧化酶活性测定 粗酶液的提取参照文献方法[14]:称取0.2 g 叶片鲜样,加入4 mL 100 mmol/L 的PBS 缓冲液[pH 7.0,含0.1 mmol/L的 EDTA 和1% (W/V) PVP] (1 mL 研磨,3 mL 冲洗),进行冰浴匀浆。将所有样品置于4℃、10 000g下离心15 min,取上清液用于酶活性测定。9 个生物学重复和3 个技术重复。
采用氮蓝四唑光还原法[15]测定 SOD 活性。采用愈创木酚法[16]测定 POD 活性。参照紫外分光光度法[17]和试剂盒方法测定 CAT 活性。使用酶标仪参照文献方法[18]测定APX 活性。
1.2.6 抗氧化非酶物质含量测定 参照文献方法[19]测定丙二醛(MDA) 含量。
参照试剂盒方法测定脯氨酸(Pro)含量:用磺基水杨酸 (SA) 提取Pro,加热处理后,Pro 与酸性茚三酮溶液反应生成红色;加甲苯萃取后在 520 nm处测定吸光度。
参照林恋竹等[20]的方法评价3 种农药胁迫下茶叶的总抗氧化能力 (DPPH) 和自由基清除率:用吸光度的变化并以Trolox 作为对照体系量化抗氧化物质的抗氧化能力。
采用分光光度法[21]测定茶叶中茶多酚含量。
参照试剂盒方法测定还原型谷胱甘肽 (GSH)含量:5,5′-二硫代-双- (2-硝基苯甲酸) (DTNB) 与GSH 反应生成复合物,在 412 nm 处有特征吸收峰;其吸光度与 GSH 含量成正比,测定GSH 含量。
1.2.7 茶叶营养成分和品质测定 采用万分之一天平测定茶叶的生物量,包括茶苗地上部叶片和茎的鲜重。
茶叶叶绿素含量测定参照文献方法[22],稍作调整:准确称取液氮研磨好的叶片0.2 g,用高速均质仪匀浆后,用V(丙酮) :V(水)=80 : 20 提取,黑暗避光摇动14 h,取上清液用酶标仪测定。
采用紫外分光光度法[23]测定茶叶中维生素C 含量。 采用考马斯亮蓝法[24]测定茶叶中蛋白质含量。 参照国家标准测定茶叶中咖啡碱[25]含量和茶叶水浸出物中的游离氨基酸[26]含量。
1.3 数据统计分析
采用SPSS (V20.0) 对试验数据进行统计分析,使用Origin 2018 和Excel 2019 制作图表,图片剪切整理使用Photoshop CC 2019 进行。
2 结果分析与讨论
2.1 吡虫啉、联苯菊酯和吡唑醚菌酯供试浓度筛选
农药通过产生活性氧、提高叶绿素酶活性和分解叶绿素分子等途径对植物产生毒害作用[27]。综合茶叶的生物量、光合色素含量、自由基清除率和DPPH 总抗氧化能力4 个指标,评价在不同质量浓度下3 种农药对茶叶的氧化胁迫水平。由表1 可知:相较于空白对照处理,茶叶的生物量随3 种农药的质量浓度提高而降低。在吡虫啉与联苯菊酯处理中,50 mg/L 的处理茶叶生物量最低,分别为2.06 与2.19 g FW/株;在吡唑醚菌酯处理中,200 mg/L 的处理茶叶生物量最低,仅为1.61 g FW/株。50 mg/L 联苯菊酯和200 mg/L吡唑醚菌酯处理显著降低了茶叶的光合色素含量。3 种农药分别在50、50 和200 mg/L 处理下,茶叶自由基清除率和总抗氧化能力显著降低。综合以上结果,最终确定3 种农药的施用浓度分别为吡虫啉50 mg/L、联苯菊酯50 mg/L 和吡唑醚菌酯200 mg/L。
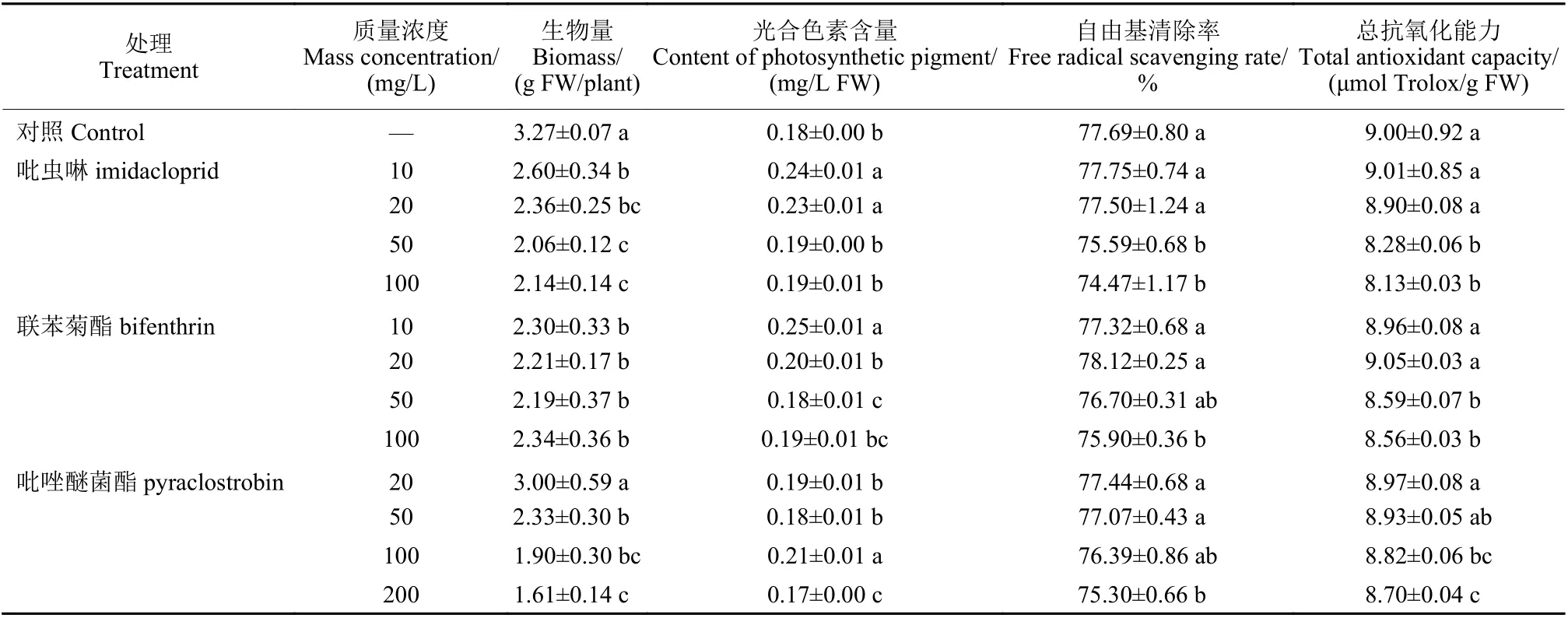
表1 吡虫啉、联苯菊酯和吡唑醚菌酯质量浓度的筛选Table 1 Screening the concentration of imidacloprid, bifenthrin and pyraclostrobin
2.2 外源单宁酸对吡虫啉、联苯菊酯和吡唑醚菌酯胁迫下茶叶的影响
植物的抗氧化系统分为酶类和非酶类两种,两者协作使植物体内的活性氧处于动态平衡,使细胞内自由基维持在较低水平,防止自由基毒害[28]。目前针对逆境引起的植物活性氧代谢研究较多,但关于克服或缓解农药引起的作物氧化胁迫研究较少。通过分析发现,施药后14 d 时单宁酸对茶叶抗氧化系统的影响最大,因此本文主要针对该天测定的相关结果进行讨论。
2.2.1 外源单宁酸对吡虫啉、联苯菊酯和吡唑醚菌酯胁迫下茶苗生长的影响 从图1 所示,单独施用吡虫啉 (50 mg/L)、联苯菊酯 (50 mg/L) 和吡唑醚菌酯 (200 mg/L) 后,茶苗的生长受到明显抑制;而加施单宁酸后,茶苗长势良好,且叶片更加鲜绿,表明添加单宁酸可缓解农药引起的氧化胁迫。但其对农药氧化胁迫的缓解作用难以肉眼观察,需配合抗氧化酶活性和非酶物质含量进一步分析。
2.2.2 外源单宁酸对吡虫啉、联苯菊酯和吡唑醚菌酯胁迫下茶叶抗氧化酶活性的影响 由图2A 可知:加施单宁酸可缓解吡虫啉和联苯菊酯对茶叶SOD 活性的抑制作用,显著提高SOD 活性,但对吡唑醚菌酯的作用不明显。其中联苯菊酯 + 10 mg/L单宁酸处理后,茶苗的SOD 活性最高,达到283.74 U/g FW,比对照和单独用药分别提高了27.67%和24.06%。
与空白对照相比,单独施用吡虫啉、联苯菊酯和吡唑醚菌酯后,茶叶POD 活性略微升高。而加施单宁酸后其活性有明显提高,其中,吡虫啉 +10 mg/L 单宁酸的处理POD 活性最高,达到960 U/g FW,比对照和单独用药分别提高了124.99%和87.01%。联苯菊酯 + 10 mg/L 单宁酸处理的POD 活性为1 100 U/g FW,比对照和单独用药显著提高157.81%和57.14%。茶叶POD 活性也在吡唑醚菌酯 + 10 mg/L 单宁酸的处理达到最高值2 000 U/g FW,分别是对照、吡唑醚菌酯处理的4.69 倍和3.13 倍。说明单宁酸可通过提高茶叶POD 活性,缓解农药作为胁迫因子给植物带来的氧化损伤 (图2B) 。
由图2C 可以看出,吡虫啉、联苯菊酯和吡唑醚菌酯3 组处理中,农药 + 10 mg/L 单宁酸的CAT活性最高,分别为826.20、596.04 和678.34 nmol/(min·g FW),比单独施用3 种农药分别提高了160.87%、131.89%和71.84%。可见,外源单宁酸对于茶叶中活性氧的清除和CAT 活性的提高效果显著。
图2D 显示,吡虫啉、联苯菊酯和吡唑醚菌酯单独施用后APX 活性比对照显著降低。而加施单宁酸后以10 mg/L 处理的APX 活性最高,分别达到1.19、1.46 和1.97 μmol/(min·g FW),比单独施药分别提高了340.74%、114.71%和271.70%。究其原因可能是单宁酸与抗坏血酸代谢相互作用促进APX 活性升高,进而提高了植物对农药胁迫的耐受性。
2.2.3 外源单宁酸对吡虫啉、联苯菊酯和吡唑醚菌酯胁迫下茶叶抗氧化非酶物质含量的影响 从图3A 可以看出,吡虫啉 + 10 mg/L 单宁酸处理的MDA 含量最低,达到49.79 nmol/g,比对照和单独用药分别降低了12.67%和13.45%。联苯菊酯 +10 mg/L 单宁酸处理的MDA 含量为54.44 nmol/g,比单独用药降低了10.59%。单独施用吡唑醚菌酯后MDA 含量比对照显著升高了46.61%,与3 种浓度的单宁酸混用后丙二醛含量显著降低。MDA含量高,说明植物细胞膜质过氧化程度高,细胞膜受到的伤害严重。单宁酸降低了MDA 含量,表明单宁酸能够缓解植物细胞膜质过氧化程度,降低茶叶细胞受到的氧化损伤。
Pro 是一种自由基清除剂,可以螯合单线态氧和羟基自由基,减轻氧化伤害,因此Pro 积累可以作为植物受到胁迫的一种信号[29]。农药 + 10 mg/L 单宁酸处理的Pro 含量在每一组中都显著高于同组的其他处理,分别达到55.14、108.48 和74.73 μg/g FW,比单独施用吡虫啉、联苯菊酯和吡唑醚菌酯分别提高了55.92%、92.70%和117.19%(图3B) 。
吡虫啉、联苯菊酯和吡唑醚菌酯和10 mg/L单宁酸混用比单独用药总抗氧化能力分别升高了4.32%、8.15%和5.34% (图3C) ,显著提高了各种抗氧化物质和抗氧化酶等构成总抗氧化水平。
茶多酚具有良好的自由基清除能力,它在生物体的氧化还原反应中与过量的自由基反应,形成较为稳定的酚氧自由基,从而保护生物体免受自由基的氧化损伤[30]。此外,茶多酚还是形成茶叶的颜色和香气的主要成分,直接影响茶叶的感官品质。农药 + 10 mg/L 单宁酸处理的茶多酚含量显著高于单独用农药的处理,比单独施用吡虫啉、联苯菊酯和吡唑醚菌酯分别提高了84.80%、402.52%和158.84% (图3D) 。说明单宁酸能够通过刺激茶多酚含量的升高,进而缓解农药带来的氧化损伤。
GSH 直接参与抗氧化系统,具有清除 ROS 和调节氧化还原平衡的重要功能并且还参与仅存在于植物中的抗坏血酸-谷胱甘肽 (ASA-GSH) 循环,该循环对植物的正常代谢以及对氧化应激的防御是必不可少的[31]。从图3E中可以看出,联苯菊酯加施10 mg/L 单宁酸处理的GSH 含量最高,达到1.35 μmol/g FW,比单独施用联苯菊酯提高了35.54% 。
Li 等[32]发现,纳米硒通过激活抗氧化酶可最大限度地减少丙二醛、过氧化氢和超氧阴离子的积累,证明其可通过调节次生代谢和抗氧化能力来减轻农药诱导的氧化胁迫。本研究发现,单宁酸同样可以显著降低膜脂过氧化产物,提高自由基清除剂Pro 和茶多酚的含量,从而提高茶叶的抗氧化性能,表明单宁酸在提高植物对农药胁迫的耐受性和维持ROS 动态平衡方面很有潜力。单宁酸在体外可以定量地抑制葡萄糖苷酶介导的生氰糖苷的水解,干扰生氰糖苷水解释放氰化氢(HCN),从而降低其毒性效应[33]。农药胁迫可影响苯丙烷类代谢途径的关键基因上调,包括苯丙氨酸解氨酶 (PAL) 和查尔酮合成酶 (CHS)[34-35],单宁酸可能影响该途径以及与其他次级代谢系统的相互作用。
2.2.4 外源单宁酸对吡虫啉、联苯菊酯和吡唑醚菌酯胁迫下茶叶营养物质的影响 测定结果 (表2)显示,吡虫啉、吡唑醚菌酯与单宁酸混用后,茶叶中维生素C 的含量明显上升,其中加施10 mg/L单宁酸处理的维生素C 含量较单独用药分别提高了5.56%和12.4%。维生素C 是茶叶中重要的营养成分之一,表明添加单宁酸可改善茶叶品质。
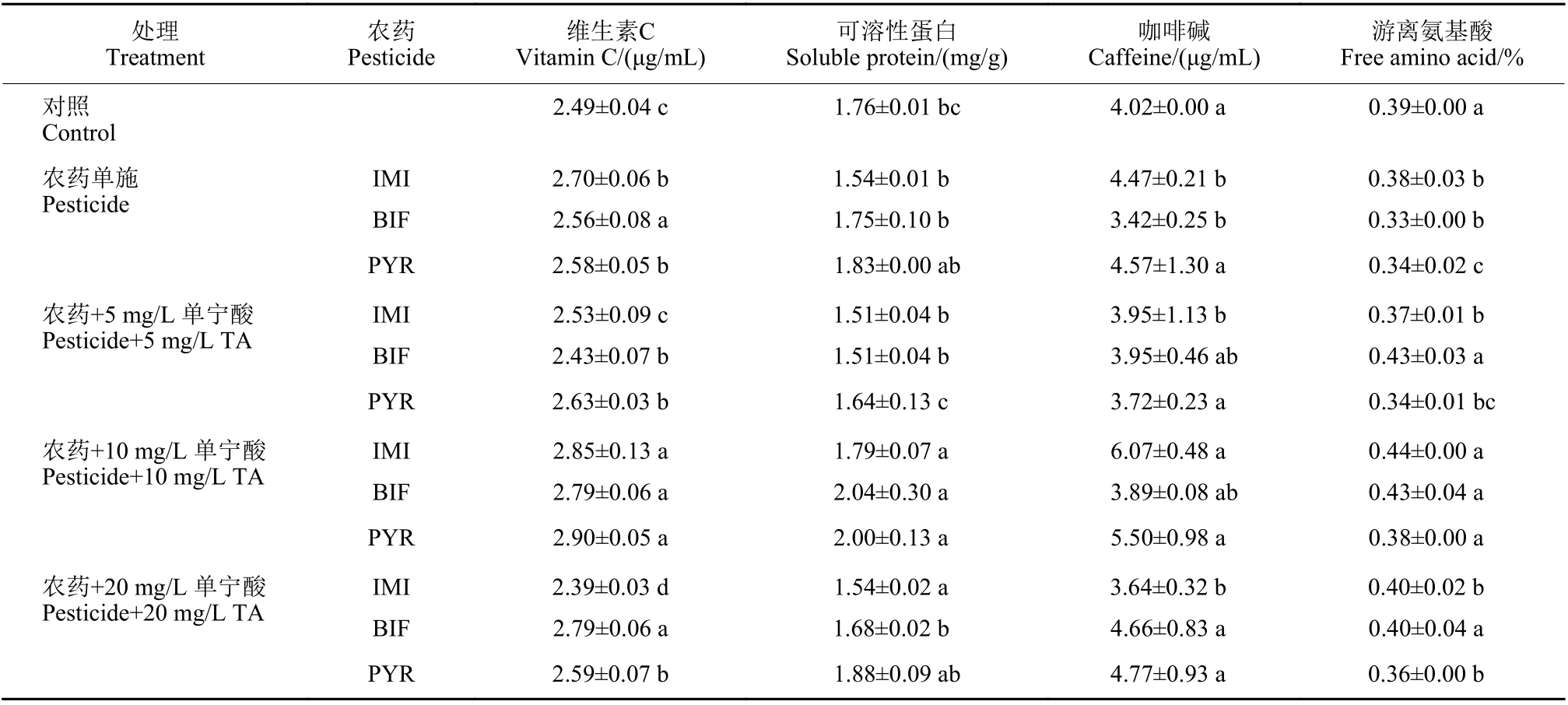
表2 外源单宁酸对茶叶维生素C、可溶性蛋白、咖啡碱和游离氨基酸含量的影响Table 2 Effects of exogenous tannic acid on the contents of vitamin C, soluble protein,caffeine and free amino acids in tea leaf
可溶性蛋白是茶叶的内源物质,为茶苗的生长提供能量。吡虫啉单独处理后茶叶可溶性蛋白含量明显降低,加施单宁酸后,可溶性蛋白含量较单独施药明显升高,吡虫啉和联苯菊酯分别与10 mg/L 单宁酸混用,可溶性蛋白含量较单独用药分别提高了16.23%和16.57%。说明吡虫啉可抑制茶叶中正常蛋白的合成,而单宁酸又降低了这种影响,从而导致可溶性蛋白含量的升高。
咖啡碱是茶叶中主要的生物碱,可减少自由脂肪酸、增强抗氧化能力并缓解压力等[36]。3 种农药单独施用后茶叶中咖啡碱没有明显降低,但添加10 mg/L 的单宁酸后吡虫啉显著提高了茶叶咖啡碱的含量。
茶叶中的游离氨基酸主要影响茶汤的鲜味,且具有保健功能。联苯菊酯和吡唑醚菌酯单独处理后,茶叶中游离氨基酸含量较对照显著降低。3 种农药与10 mg/L 单宁酸混用后比单独用药分别提高了15.79%、30.3%和11.76%。这与Li 等[11]关于单宁酸可提高葡萄酒的质量和品质,增强抗氧化能力的研究结果一致。
3 结论
针对目前茶园生产上常用的吡虫啉、联苯菊酯和吡唑醚菌酯3 种农药,验证了外源加施单宁酸对茶叶中上述3 种农药胁迫的缓解作用,并从抗氧化酶活性、非酶物质含量和营养物质3 个方面评价其作用效果。结果发现:单宁酸可明显提高吡虫啉、联苯菊酯或吡唑醚菌酯胁迫下茶叶中抗氧化酶的活性,增强茶苗的抗氧化能力,进而缓解施用农药对茶叶带来的氧化损伤。试验通过丙二醛含量降低,总抗氧化能力、脯氨酸、茶多酚和谷胱甘肽含量升高证明了单宁酸能够通过影响抗氧化非酶物质来缓解农药对茶叶造成的氧化损伤,通过主要营养成分指标证实单宁酸提高了茶叶品质。本研究仅对单宁酸在茶苗抗氧化性能和茶叶品质方面进行了探究,至于单宁酸缓解农药氧化胁迫的途径和代谢通路还有待进一步研究。
