白藜芦醇对人甲状腺乳头状癌细胞IHH4细胞恶性生物学特征及PI3K/Akt信号通路影响*
2021-12-20刘卫国侯俊杰何育威何利芳
刘卫国,张 情,侯俊杰,刘 泉,何育威,何利芳Δ
(1.长江大学附属仙桃市第一人民医院甲乳外科,仙桃 433000;2.黄石市中心医院甲乳外科,黄石 435000)
甲状腺乳头状癌约占所有甲状腺癌的80%,是甲状腺最常见的恶性肿瘤甲状腺[1]。据研究报道,甲状腺乳头状癌的年发病率正显著上升[2-3]。虽然甲状腺乳头状癌恶性程度不高,但由于其发病隐匿,早期不易发现,且与甲状腺良性结节比较相似,不易鉴别,容易导致颈部淋巴结转移,从而错过最佳治疗时间,严重降低了患者的生活质量[4]。目前对于甲状腺乳头状癌的治疗以手术、化疗和放疗等方式为主。此外,积极情绪可以改善甲状腺癌患者的癌因性疲乏,从而影响患者的预后[5]。虽然这些医疗手段对该疾病具有一定的改善作用,但部分患者对化疗产生耐药性影响了患者的预后,所以在甲状腺乳头状癌发生转移之前寻求新的药物尤为重要。白藜芦醇是一种天然的多酚类物质,具有多种药理活性,包括抗菌、抗炎、抗癌、抗氧化应激以及降血脂等[6]。据相关研究报道,白藜芦醇可以在多种癌症中发挥抗癌功效,如乳腺癌、宫颈癌、甲状腺癌等[7]。Yuan 等[8]研究报道白藜芦醇通过AKT/GSK-3beta/Snail信号通路逆转上皮-间质转化,抑制结肠癌细胞的侵袭和转移。Wu等[9]通过体外实验,发现白藜芦醇可抑制THJ-16T 和THJ-21T 细胞增殖,从而在间变性甲状腺癌中发挥疗效。董成龙等[10]通过细胞实验发现,白藜芦醇可以抑制人甲状腺乳头状癌细胞的增殖,并诱导细胞凋亡。但对于白藜芦醇在甲状腺乳头状癌中是如何发挥抗癌作用的,其具体机制尚无定论。因此,本研究探究了白藜芦醇对IHH4细胞增殖、侵袭、凋亡等恶性生物学特征的影响以及其作用机制,以期为甲状腺乳头状癌的临床治疗提供一定参考依据。
1 材料和方法
1.1 主要细胞、药物及试剂
白藜芦醇(货号:501-36-0)购自盖德化工网;人甲状腺乳头状癌细胞IHH4细胞株购自上海传秋生物科技有限公司;LY294002 抑制剂(货号:934389-88-5)和四甲基偶氮唑盐(methylthiazolyltetrazo-lium,MTT;货号:13183-79-4)均购自Sigma-Aldlrich公司;碘化丙啶(propidium iodide,PI;货号:25535-16-4)购自上海源叶生物;DMEM 培养液(货号:D6046)购自Worldrm 生物商城;RPMI-1640 培养基(货号:BC-B-021)和胎牛血清(货号:JLAQ-110)购自郑州九龙生物公司;青霉素(货号:BC-CE-012)购自南京生航生物技术有限公司;链霉素(货号:57-92-1)购自上海颖心实验室;胰酶(货号:8049-47-6)购自ChemicalBook公司;二喹啉甲酸蛋白定量试剂盒(货 号:PRTD1) 购 自Cyanagen Srl 公 司;MatrigelTM 底膜基质(货号:354230)购自上海索宝生物科技有限公司;Bax 抗体(货号sc-7480)、抗体Bcl-2(货号:sc-7382)、PI3K抗体(货号:sc-365290)、Akt 抗体(货号:sc-5298)、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphatedehydrogenase,GADPH;货号:51332)和HRP 标记的山羊抗兔二抗均购自Santa Cruz公司;Caspase-3抗体(货号:9662)均购自CST 公司;T-AOC 试剂盒(货号:E-BC-K225-M)购自Elabscience公司;Transwell小室北京优尼康生物科技有限公司;人工基底膜(货号:354234)购自北京盈丰大通科技有限公司;PBS 溶液(货号:D8537)购自美国Sigma-Aldrich 公司;Annexin V-GFP/PI 双染试剂盒(货号:FY600016-20T)购自弗元生物科技有限公司;
1.2 仪器
Being BPN-RHP CO2培养箱购自集思仪器;EPS-300 电泳仪购自上海巴玖实业有限公司;JS-680D 凝胶成像仪购自杭州得聚仪器设备公司;1703940 半干电转膜仪购自美国伯乐公司;BDF-25V270 低温冰箱购自博科公司;CytoFLEX 流式细胞仪购自美国贝克曼库尔特公司;MH-2 型微型振荡仪购自北京铭成基业科技有限公司。
1.3 细胞培养
将IHH4 细胞培养在RPMI 1640 培养基中,其中添加了10%胎牛血清以及100 U/mL 的青霉素和链霉素。细胞在37 ℃、5%CO2的环境中培养。当细胞融合率达到75%以上时用0.25%胰酶进行消化传代。
1.4 细胞分组
先用RPMI 1640 培养基将白藜芦醇进行稀释,使其浓度变为25 µmol/L、50 µmol/L、100 µmol/L。再将IHH4 细胞进行如下分组:不经白藜芦醇药物处理的作为对照组,经25 µmol/L 药物处理的作为低剂量组,经50µmol/L药物处理的作为中剂量组,100µmol/L 药物处理的作为高剂量组,经50µmol/L LY294002 PI3K/Akt 信号通路抑制剂处理的作为抑制剂组。
1.5 MTT实验
收集对数期的IHH4细胞,接种于96孔板上,使细胞密度为1×104个/mL,培养1 d后,按照实验分组加入各药物处理,分别向各孔加入100µL对应的培养液,每组设置3 个复孔。接种结束后在37 ℃、5%CO2条件下培养6 h、12 h、24 h、48 h,去除上清液,用培养液冲洗3 次以去掉药液。然后加入50 µL(1 mg/mL)的MTT 溶液,培养4 h 后,再加入二甲基亚砜(150µL/孔)使沉淀溶解,然后用微型振荡仪振荡12 min,在490 nm 波长下,通过酶标仪测出每孔吸光度(opticaldensity,OD)值,取3 孔计算平均OD值。将不加任何细胞的一孔作为空白,无药血清作为对照组,从而计算出细胞生长抑制率%,计算公式:增殖抑制率(%)=(1-实验组OD 值/对照组OD值)×100%。
1.6 Transwell实验
用Transwell 法检测IHH4 细胞的侵袭能力。IHH4 细胞在100µL 含血清的DMEM 中培养,将细胞置于含有Transwell 预涂的基质凝胶膜过滤器的上腔内,在24 孔板培养板上插8 μm 孔。培养48 h后,用棉签去除上膜上残留的细胞。侵袭细胞膜的细胞用4%多聚甲醛固定,0.1%结晶紫染色20 min。随机选取5 个视野在100 倍显微镜下观察,侵袭细胞数用Adobe Photoshop CS6 计数,以均数±标准差()表示。
1.7 细胞流式术
采用胰酶将对数生长期的IHH4细胞进行消化以调整其密度,然后将IHH4细胞接种于6孔细胞板中(4×103个/孔)。按照实验分组加入各药物处理,置于37℃、5%CO2培养箱中培养48 h,消化细胞后加入100µL二甲基亚砜、20 μL AnnexinV-FITC及和20µL PI染液,混匀后于37℃下避光反应20 min,在流式细胞仪中检测细胞的凋亡情况。在消化后细胞内加入70%乙醇溶液固定1 h,PBS溶液清洗细胞后加入PI进行染色重悬,置于流式细胞仪中检测细胞周期变化。
1.8 蛋白质印迹法
通过蛋白质印迹法检测Bax、Bcl-2、Caspase-3、PI3K 和Akt 蛋白的表达量。取对数生长期IHH4 细胞,进行消化使其密度为1×105个/mL,然后通过6孔板进行接种。按照实验分组加入各药物处理,置于37 ℃、5% CO2培养箱中培养48 h 后,吸去培养液,用3 mL 预冷PBS 洗涤3 次,然后在SDS 样品缓冲液中煮沸。蛋白质样品经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)电泳分离,半干法转到PVDF 膜,然后用5%脱脂奶粉,在37 ℃摇床中封闭1 h。将膜与Caspase-3、Bax、Bcl-2、PI3K 和Akt(1:1 000)的一抗在4 ℃下过夜。HRP 标记的山羊抗兔IgG(1:10 000)作为二抗,加入二抗在37 °C 环境中培养1 h,显色成像并通过Image-ProPlus 软件对图片条带进行灰度值分析,以GADPH(1:1 000)作为内参蛋白,计算各蛋白的相对水平。
1.9 统计学方法
采用SPSS 18.0 软件对数据进行统计分析,计量资料以均数±标准差()表示,多组间比较采用单因素方差分析检验,组间两两比较采用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 白藜芦醇抑制IHH4细胞的增殖能力
MTT 实验结果表明,随着培养时间的推移,对细胞增殖的抑制率逐渐增大。同一时间点,与对照组相比,低、中、高剂量组和抑制剂组中IHH4 细胞的增殖抑制率均显著升高;且剂量越高,对细胞增殖能力的抑制效果越显著(P<0.05),相比高剂量组,抑制剂组中IHH4 细胞的增殖抑制率无显著改变(P>0.05),见图1,表1。
表1 各组IHH4细胞增殖抑制率结果比较 ,%,n=3
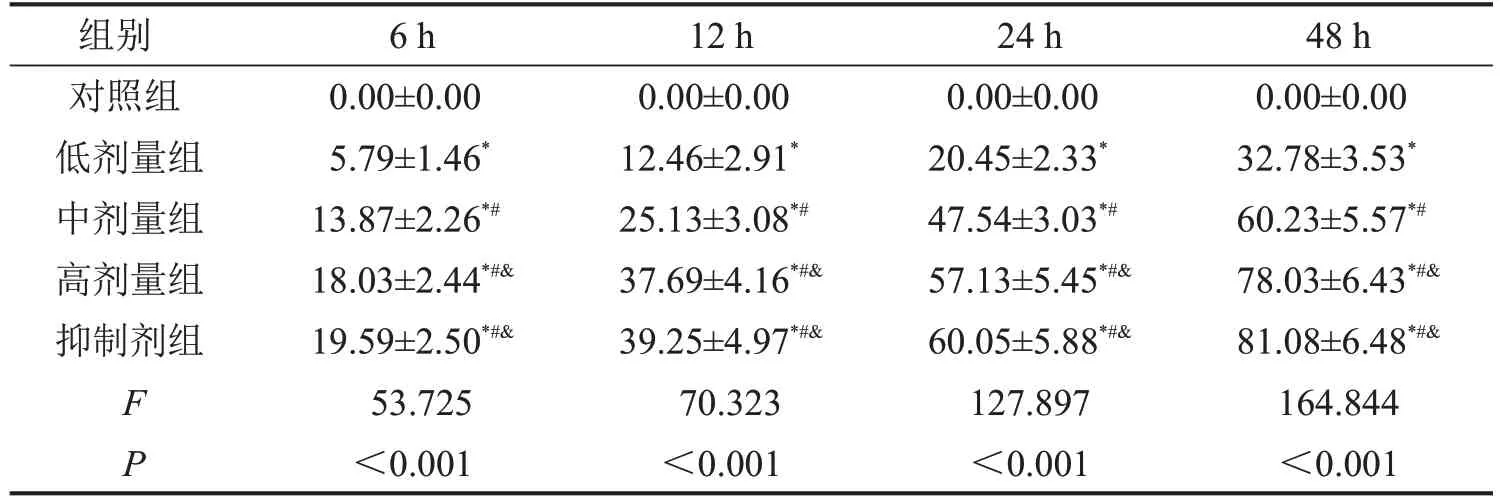
表1 各组IHH4细胞增殖抑制率结果比较 ,%,n=3
与对照组相比,*P<0.05;与低剂量组相比,#P<0.05;与中剂量组相比,&P<0.05。
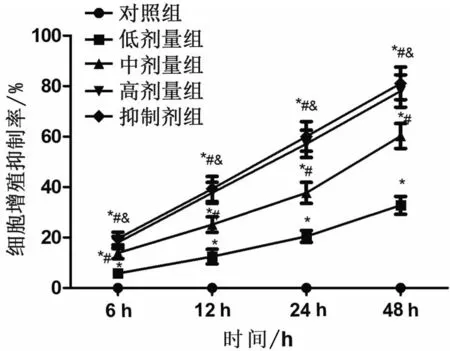
图1 白藜芦醇对IHH4细胞增殖能力的影响
2.2 白藜芦醇抑制IHH4细胞的侵袭
Transwell实验结果显示,对照组穿膜细胞数为(250.45±18.63)个、低剂量组为(180.64±16.15)个,中剂量组为(140.01±12.82)个,高剂量组为(93.43±7.64)个以及抑制剂组为(91.03±5.25)个(F=77.782,P<0.001);与对照组相比,低、中、高剂量组以及抑制剂组的穿膜细胞数均呈现出不同程度的减少,且随白藜芦醇剂量逐渐增高,穿膜细胞数逐渐减少(P<0.05),见图2。
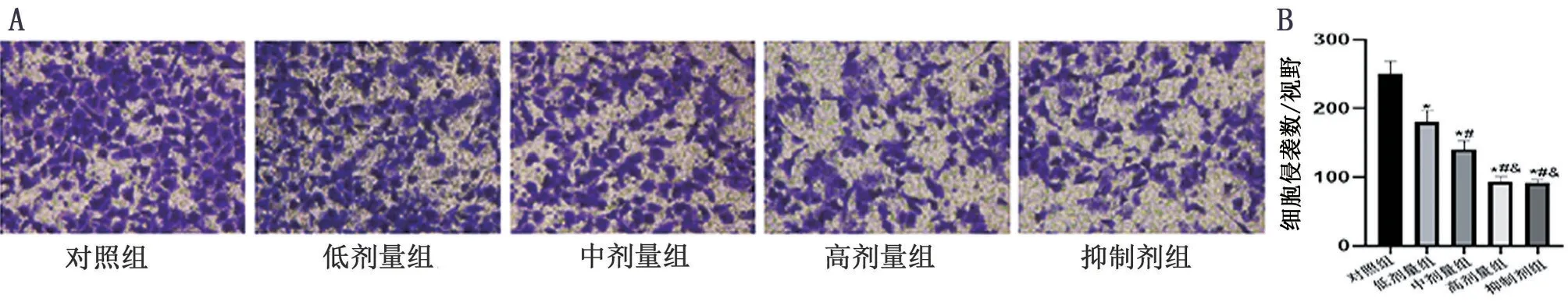
图2 Transwell实验检测各组细胞侵袭数
2.3 白藜芦醇对IHH4细胞凋亡及周期的影响
采用流式细胞术评估白藜芦醇对IHH4细胞的凋亡及周期的影响。结果显示,与对照组相比,低、中、高剂量组和抑制剂组均可有效的促进IHH4 细胞的凋亡,致使细胞周期出现G0/G1 期阻滞,差异具有统计学意义(P<0.05),见表2,图3。
表2 各组IHH4细胞的凋亡及周期情况 ,%,n=3
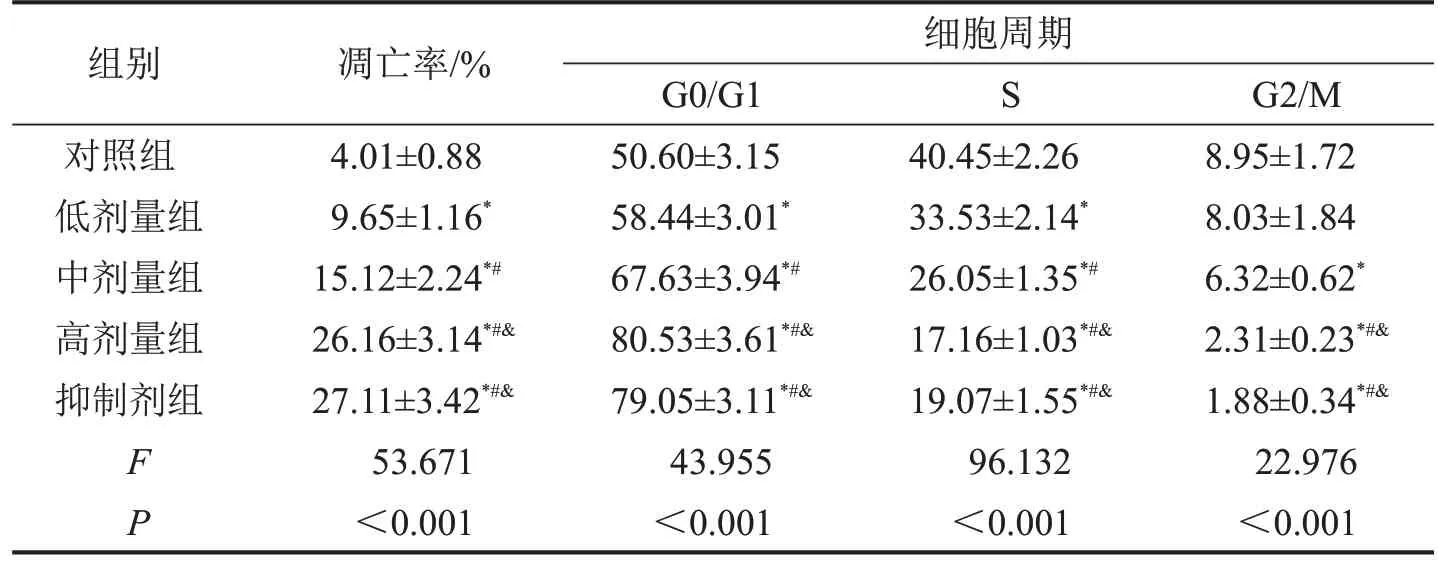
表2 各组IHH4细胞的凋亡及周期情况 ,%,n=3
与对照组相比,*P<0.05;与低剂量组相比,#P<0.05;与中剂量组相比,&P<0.05。

图3 IHH4细胞凋亡染色图
2.4 白藜芦醇对IHH4细胞凋亡相关蛋白表达的影响
蛋白印迹结果显示,与对照组相比,低、中、高剂量组以及抑制剂组中的Bax 和Caspase-3 蛋白水平显著上调(P<0.05),Bcl-2 的蛋白水平显著下调(P<0.05);剂量越高,效果越显著(P<0.05),见图4,表3。

图4 白藜芦醇对IHH4细胞凋亡蛋白水平的影响
表3 各组凋亡蛋白水平比较 ,n=3
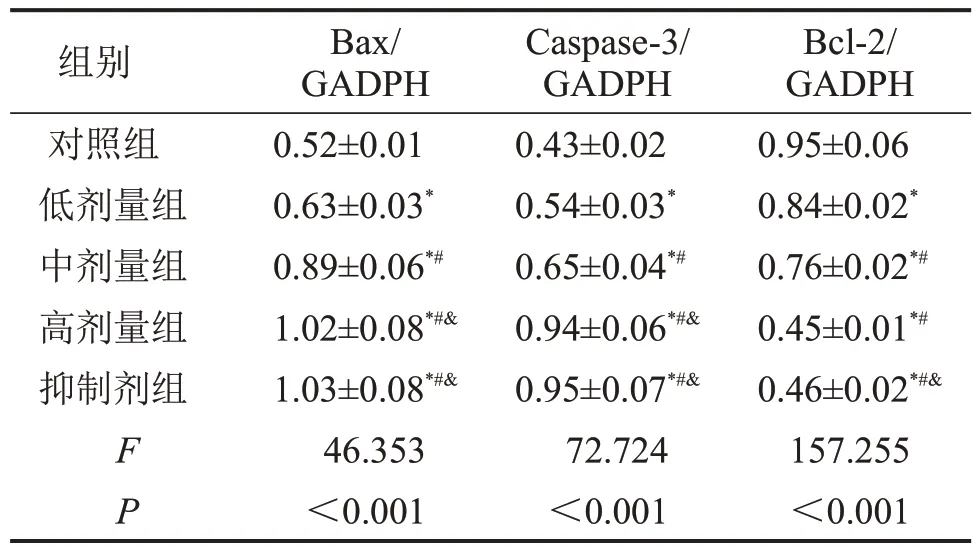
表3 各组凋亡蛋白水平比较 ,n=3
与对照组相比,*P<0.05;与低剂量组相比,#P<0.05;与中剂量组相比,&P<0.05。
2.5 白藜芦醇对IHH4细胞中PI3K/Akt信号通路的影响
蛋白印迹法结果显示,与对照组相比,低、中、高剂量组以及抑制剂组中PI3K 和Akt 蛋白表达均显著下调(P<0.05),剂量越高,效果越显著(P<0.05),见图5,表4。

图5 白藜芦醇对IHH4细胞通路相关蛋白表达的影响
表4 各组通路相关蛋白的表达结果比较 ,n=3
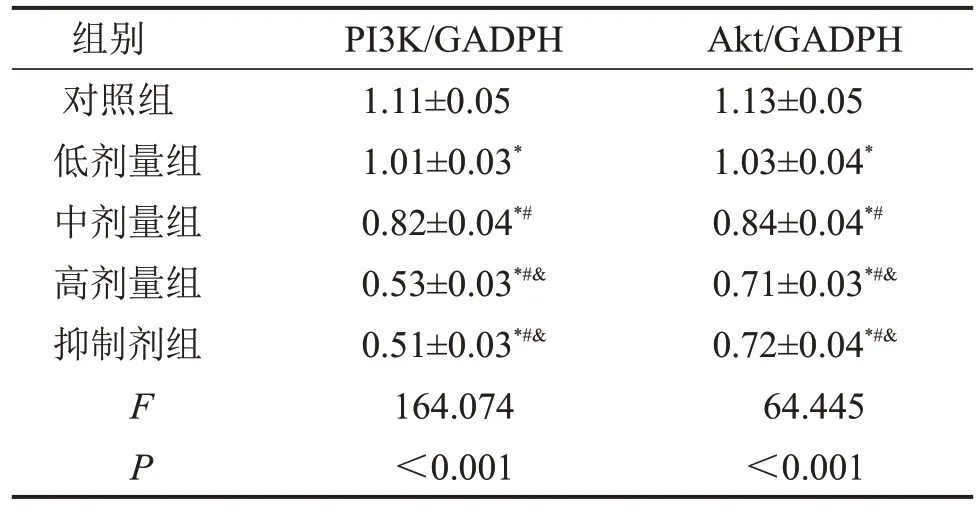
表4 各组通路相关蛋白的表达结果比较 ,n=3
与对照组相比,*P<0.05;与低剂量组相比,#P<0.05;与中剂量组相比,&P<0.05。
3 讨论
甲状腺乳头状癌是最常见的甲状腺恶性肿瘤之一,由于其生长和转移速度较快,容易频繁复发,影响患者的预后[11]。因此,在甲状腺乳头状癌发生转移之前寻求新的药物已成为治疗甲状腺乳头状癌的关键。白藜芦醇作为一种多酚类化合物,具有抗氧化、抗菌、抗炎、抗癌、调节血脂代谢等多种生物活性。鉴于近几年研究发现白藜芦醇在癌症进展的主要阶段中均具有抗癌活性,是目前公认最有潜力的天然抗癌药物之一[12-13]。
癌细胞增殖、侵袭是导致癌细胞转移,肿瘤恶化的特征。凌科技等[14]通过体外实验发现,白藜芦醇可以抑制甲状腺癌细胞的增殖能力,发挥抗癌作用。在本研究中,通过MTT 实验和Transwell 小室实验,发现白藜芦醇可以抑制甲状腺乳头状癌IHH4细胞的增殖和侵袭能力,且随着白藜芦醇剂量的增加而增强。此外,高剂量的白藜芦醇和PI3K/Akt信号通路抑制剂对IHH4细胞的增殖和侵袭能力的抑制程度无显著差异。PI3K/Akt 信号通路调控多种细胞功能,包括细胞生长、分化、增殖、凋亡、能动性、侵袭和细胞内运输,并在肿瘤的进展中起关键作用[15]。当生长因子将PI3K 激活后,激活的PI3K使细胞膜上的4,5-二磷酸磷脂酰肌醇变为3,4,5-三磷酸磷脂酰肌醇,然后,磷酸肌醇依赖的蛋白激酶激活Akt,活化的Akt 使GSK-3、caspase-9 等蛋白磷酸化,从而促进细胞的增殖[16]。当PI3K/Akt 信号通路被激活后,可促进细胞内Snail、Twist、ZEB等核转录因子的表达,并诱导基质金属蛋白酶表达,从而降低细胞内的钙粘附蛋白E 的水平,而当钙粘附蛋白E降低后,细胞黏附能力会下降,细胞的运动和侵袭能力也随之增强[17]。以上结果提示,白藜芦醇可抑制IHH4 细胞的增殖和侵袭能力,可能与PI3K/Akt信号通路受到抑制有关。
凋亡是程序性细胞死亡的一种形式,能有序和有效地去除受损细胞,与很多疾病的发病机制密切相关,包括癌症[18]。已有相关研究表明,白藜芦醇可促进多种癌细胞的凋亡,包括甲状腺癌[19-21]。本研究结果显示,经白藜芦醇和抑制剂处理后甲状腺乳头状癌细胞IHH4 细胞的凋亡率显著升高。Bax,caspase 3,Bcl-2作为经典的凋亡蛋白,其中Bcl-2抑制细胞凋亡,Bax促进细胞凋亡。在细胞内,二者可结合成异质二聚体而失活,而当二者的相对表达量失衡时,可破坏线粒体膜的完整性,最终激活Caspase-3,引起细胞凋亡进程的改变[22]。在凋亡相关蛋白检测实验中,发现IHH4 细胞经白藜芦醇和抑制剂干预后Bax和Caspase-3蛋白水平明显上调,Bcl-2蛋白水平明显下调。有研究显示,当抑制PI3K/Akt信号通路可以抑制甲状腺乳头状癌细胞中Bcl-2蛋白的表达,促进Bax 和Caspase-3 蛋白表达,从而促进甲状腺乳头状癌细胞的凋亡[23]。这些论据说明白藜芦醇能促进甲状腺乳头状癌细胞中Bax 蛋白表达,抑制Bcl-2 蛋白表达,促进凋亡终末效应因子Caspase-3 的表达,诱导细胞凋亡,最终抑制甲状腺乳头状癌细胞的生长。失控性生长是肿瘤恶化的特征,主要是因为细胞周期发生紊乱。本研究经流式细胞术分析,发现白藜芦醇和抑制剂可以有效地促进甲状腺乳头状癌细胞IHH4 细胞的凋亡,导致细胞周期发生G0/G1 期阻滞。研究显示,抑制PI3K/Akt 信号通路可使人甲状腺乳头状癌细胞阻滞于G1 期[24],而细胞从G1 向S 期的转化是细胞增殖的关键限速步骤之一,因此推断,IHH4 细胞发生周期延长或阻滞,使得DNA 合成受阻,抑制细胞的增殖,最终导致细胞凋亡。既往研究表明,白藜芦醇通过抑制PI3K/Akt 信号通路从而抑制肺癌细胞的活力,并促进肺癌细胞凋亡[25]。本实验结果显示,经白藜芦醇和抑制剂处理后细胞中PI3K、Akt 蛋白表达下降,因此推断,白藜芦醇促进甲状腺乳头状癌细胞凋亡可能与下调PI3K/Akt 信号通路有关。关于白藜芦醇在甲状腺乳头状癌中的疗效以及具体机制还有待进一步实验进行探索与证实。
综上所述,白藜芦醇抑制甲状腺乳头状癌细胞的增殖和侵袭,影响细胞周期,诱导癌细胞凋亡,其作用机制可能与抑制PI3K/Akt信号通路有关。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- 基于Klotho/FGF23通路探讨天麻钩藤饮对大鼠静脉桥血管氧化应激及内膜增生的影响*
- 腹壁剖宫产瘢痕子宫内膜异位症恶变为透明细胞癌1例*
- miR-508-3p靶向AFF4/TGFβ1信号通路调控人牙髓细胞分化的机制研究*
- Effect of curcumin on palmitic acid-induced apoptosis and steroid production of ovarian granulosa cells by inhibiting HMGB1-mediated autophagy
- 金丝桃苷对糖尿病肾病大鼠TGF-β1/smad通路及肾上皮间质转化的影响*
- 六月青醇提物凝胶剂对大鼠慢性湿疹的作用研究*
