金丝桃苷对糖尿病肾病大鼠TGF-β1/smad通路及肾上皮间质转化的影响*
2021-12-20王苑菲沈美晓吴祖荣黄亚莲符茂雄
王苑菲,沈美晓,吴祖荣,黄亚莲,琚 枫,符 畅,符茂雄
(海南医学院第二附属医院内分泌与代谢病科,海口 570100)
糖尿病肾病(diabetic nephropathy,DN)是一种常见糖尿病微血管并发症,是终末期肾病的最常见病因,具有肾小球高过滤、肾脏肥大等不良表现,发展到末期可导致肾衰竭,严重危害患者生命健康[1-2],金丝桃苷(Hyperoside,HP)广泛分布于各种植物中,是一种天然黄酮醇苷类化合物,具有抗肿瘤、抗氧化等多种生理作用[3]。Zhang等[4]研究报道,HP能显著改善DN小鼠肾小球硬化从而维持肾功能的正常运转,Zhou等[5]研究显示,HP能显著缓解DN大鼠肾小球过滤功能及肾脏损害并减轻早期糖尿病肾病临床症状,并认为HP具有成为DA新型治疗药物的潜在价值,但关于其对DA 大鼠肾上皮间质转化(Epithelial-mesenchymal transition,EMT)影响的研究较少。因此,继续探究DN 可能发病机制及相关治疗方案仍是近年来的研究热点。肾脏纤维化是DN 的主要病理特征,与肾功能损害密切相关[6],资料显示肾EMT是肾脏纤维化的初始环节之一[7-8],钟涛等[8]研究表明转化生长因子-β1(transforming growth factor-β1,TGF-β1)/smad 通路的激活与DN发展及肾EMT发生密切相关,因此本研究通过建立DN 大鼠模型,探究HP 对DN 大鼠肾EMT 及TGF-β 1/smad通路的影响,为临床治疗DN提供新思路。
1 材料与方法
1.1 实验动物、材料及设备
SPF 级雄性SD 大鼠(体质量200 g~220 g)由南京医科大学提供(实验动物使用许可证号:SYXK(苏)2018-0001);金丝桃苷(货号:482-36-0,纯度≥97.0%)、链脲佐菌素(streptozotocin,STZ)(货号:111607-200301,纯度>98%)均购自Sigma 公司;罗格列酮片(Rosiglitazone,RGZ,批号:190106)购自成都恒瑞制药有限公司;HE 染色试剂盒(货号:G1121)、Masson染色试剂盒(货号:G1340)、全蛋白提取试剂盒(货号:BC3170)、BCA蛋白浓度测定试剂盒(货号:PC0020)均购自北京索莱宝科技有限公司;兔源一抗anti-纤维连接蛋白(Fibronectin)(货号:ab268020)、anti-E-钙黏蛋白(E-cadherin)(货号:ab40772)、anti-α-平滑肌动蛋白(α-smooth muscles actin,α-SMA)(货号:ab5694)、anti-TGF-β1(货号:ab215715)、anti-smad2(货号:ab40855)、anti-smad3(货号:ab40854)、anti-smad7(货号:ab216428)、anti-GAPDH(货号:ab181602),二抗羊抗兔IgG(货号:ab6721)均购自英国Abcam 公司;动物代谢笼(型号:41800)购自意大利Ugo Basile公司;全自动生化分析仪(型号:Catalyst One)购自美国IDEXX;光学显微镜(型号:ContourGT-K)购自美国BRUKER 公司等。
1.2 方法
1.2.1 模型制备及分组给药 将60只SD大鼠随机分为造模组(48只)和对照(NC)组(12只),DN大鼠模型的构建参考文献[9]并稍作改动,所有造模大鼠均用高脂饲料喂养,高脂饲料中含有60%普通饲料、2%胆固醇、8%蛋黄粉、10%炼猪油、20%蔗糖,持续喂养4 周,第4 周最后一天对大鼠进行腹腔注射STZ 30 mg/kg(用0.1 mol/L 的柠檬酸缓冲液配置的1%STZ溶液)。观察到大鼠饮水量、尿量显著增加,出现毛色发黄、脱毛、烦躁等症状时,进行尾静脉采血,于全自动生化分析仪中测定大鼠血糖值,连续3 d测血糖≥16.7 mmol/L,表明糖尿病大鼠模型构建成功;将大鼠置于动物代谢笼中继续喂养,记录大鼠24 h尿量并测定24 h尿蛋白,当尿量≥150%原尿量,尿蛋白量>30 mg/24 h为DN模型构建成功。对照组正常喂养。
将造模组48 只DN 大鼠随机分为模型(M)组、阳性药物罗格列酮(RGZ)组、HP低(HP-L)、中(HPM)、高剂量(HP-H)组,每组12只。建模成功后24 h开始给药,参考文献[10]将HP低、中、高剂量组灌胃剂量分别设置为12.5 mg/kg、25 mg/kg、50 mg/kg;RGZ 组给药剂量按照人体表法计算,系数采用6.25,成年人每日RGZ 用量为4 mg,则大鼠给药剂量设置为0.4 mg/kg,NC组、M组均灌胃等量生理盐水,每天1次,连续灌胃8周。
1.2.2 标本采集 治疗结束后,将大鼠放于动物代谢笼中收集各组大鼠24 h尿液,离心后收集上清液保存待检。腹腔注射10%水合氯醛(0.4 mL/100 g)麻醉处死各组大鼠,腹主动脉采血,低温离心后收集血清至离心管中,低温保存备用。对大鼠进行体表常规消毒后解剖大鼠,分离大鼠肾脏组织行后续病理学观察及相关蛋白的免疫印记法(Western blotting,WB)检测。
1.2.3 FBG 及血清生化指标检测 采用全自动生化分析仪分析尿微量白蛋白(urinealbumin,UAlb)、尿肌酐(urine creatinine,Ucr)及尿素氮(blood urea nitrogen,BUN)、空腹血糖(fasting blood-glucose,FBG)水平。
1.2.4 各组大鼠肾脏组织病理学观察 取1.2.2 中大鼠左侧肾脏组织,从最大面切为两部分,取其中一部分置于多聚甲醛中固定,固定好后经过不同浓度梯度的酒精溶液、二甲苯溶液进行脱水及透明处理,用石蜡进行常规包埋后行切片处理,按照苏木精—伊红(HE)染色试剂盒中的操作说明进行染色处理,将石蜡切片经过二甲苯溶液脱蜡处理,经过不同浓度的酒精溶液进行水化处理,经过苏木素染色、返蓝液返蓝、伊红染色、脱水、透明化等处理后进行封片,于显微镜中观察肾脏组织病理学变化。
1.2.5 Masson染色法观察大鼠肾脏纤维化程度
取“1.2.4”项中另一部分肾脏组织用于Masson染色,制作常病理组织切片,具体操作步骤参考Masson染色试剂盒,常规脱蜡至水,用Weigert铁苏木素染色液染色10 min,酸性乙醇分化液分化15 s,Masson 蓝化液返蓝5 min,蒸馏水冲洗1 min,丽春红品红染液染色10 min,依次用弱酸工作液、磷钼酸溶液清洗,放入苯胺蓝染液中染色2 min,经弱酸工作液冲洗、乙醇脱水、二甲苯透明处理后用中性树胶封固,于光学显微镜中观察并拍照,根据肾脏组织纤维化面积与所选视野总面积之比计算大鼠肾脏组织纤维化面积比。
1.2.6 WB 实验测定各组大鼠EMT、TGF-β1/smad通路相关蛋白表达水平
采用蛋白提取试剂盒提取各组大鼠右侧肾组织总蛋白,BCA 法测定蛋白浓度。取60 μg 蛋白样品进行SDS-PAGE电泳变性,转至PVDF膜,脱脂奶粉封闭,依次添加一抗anti-Fibronectin(1∶400)、anti-E-cadherin(1∶600)、anti-α-SMA(1∶500)、anti-TGF-β1(1∶1 000)、anti-smad2(1∶1 000)、anti-smad3(1∶1 000)、anti-smad7(1∶1 000)、anti-GAPDH(1∶1 000)4 ℃孵育过夜,添加二抗IgG(1∶5 000)室温孵育1 h,显色、曝片,以GAPDH 为内参进行定量分析。
1.3 统计学方法
采用SPSS 25.0 软件进行统计学分析。计量资料以均数±标准差()表示,多组比较采用单因素方差分析,进一步两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 造模组与NC组大鼠FGB及尿蛋白水平比较
与NC组比较,造模组大鼠FBG、尿蛋白水平均显著升高(均P<0.05),提示DN 大鼠模型构建成功,见表1。
表1 造模组与NC组大鼠FGB及24 h尿蛋白水平比较

表1 造模组与NC组大鼠FGB及24 h尿蛋白水平比较
与NC组比较,aP<0.05。
2.1 各组大鼠FGB及生化指标水平比较
与NC 组比较,M 组大鼠FBG、UAlb、Ucr、BUN水平均显著升高(均P<0.05);与M组比较,RGZ组大鼠FBG、UAlb、Ucr、BUN水平均显著降低(均P<0.05),HP-L 组、HP-M 组、HP-H 组大鼠FBG、UAlb、Ucr、BUN水平均显著降低,且呈剂量依赖性(均P<0.05),其中HP-H组优于RGZ组(均P<0.05),见表2。
表2 各组大鼠FGB、UAlb、Ucr、BUN水平比较 n=12,
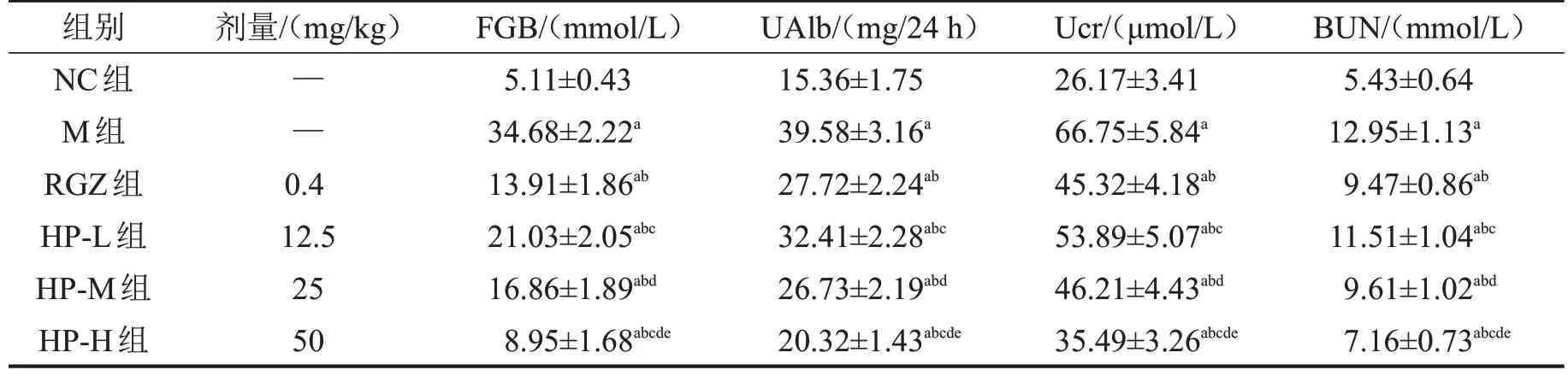
表2 各组大鼠FGB、UAlb、Ucr、BUN水平比较 n=12,
与NC组比较,aP<0.05;与M组比较,bP<0.05;与RGZ组比较,cP<0.05;与HP-L组比较,dP<0.05;与HPM组比较,eP<0.05。
2.2 各组大鼠肾组织病理学观察
NC 组大鼠肾组织及肾小管结构基本正常,无明显损害;与NC 组比较,M 组大鼠肾组织病变严重,出现肾小管间质炎性细胞浸润现象,肾小球体积显著增大且染色偏蓝,肾脏纤维化面积显著较多(均P<0.05);与M组比较,RGZ组大鼠肾组织形态得到明显改善,肾脏纤维化程度显著降低(均P<0.05),HP 各剂量组大鼠肾组织肾脏组织损害及纤维化程度均得到明显改善,且呈剂量依赖性(均P<0.05)。其中HP-H 组优于RGZ 组(均P<0.05),见图1、表3。
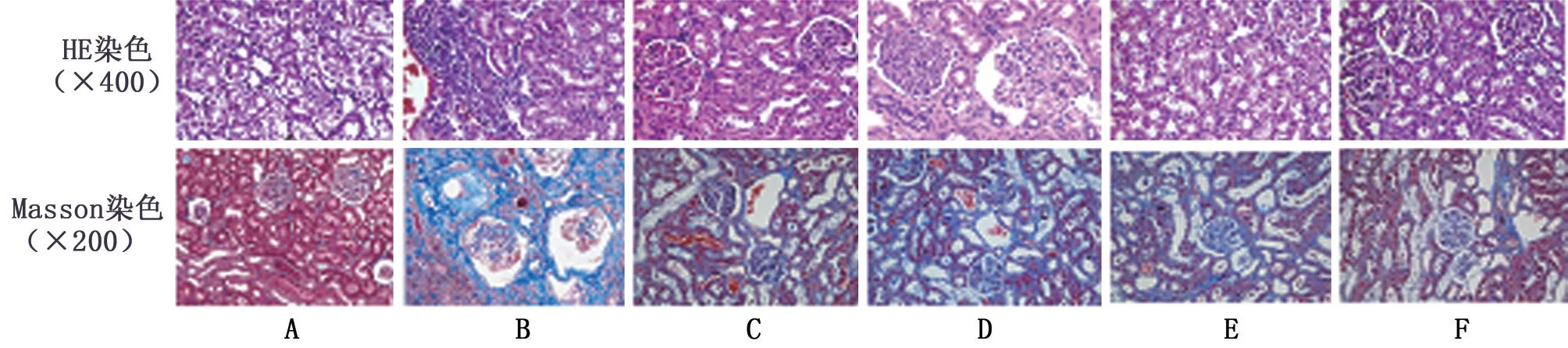
图1 各组大鼠肾组织病理学观察
表3 各组大鼠肾组织纤维化面积比 n=12,
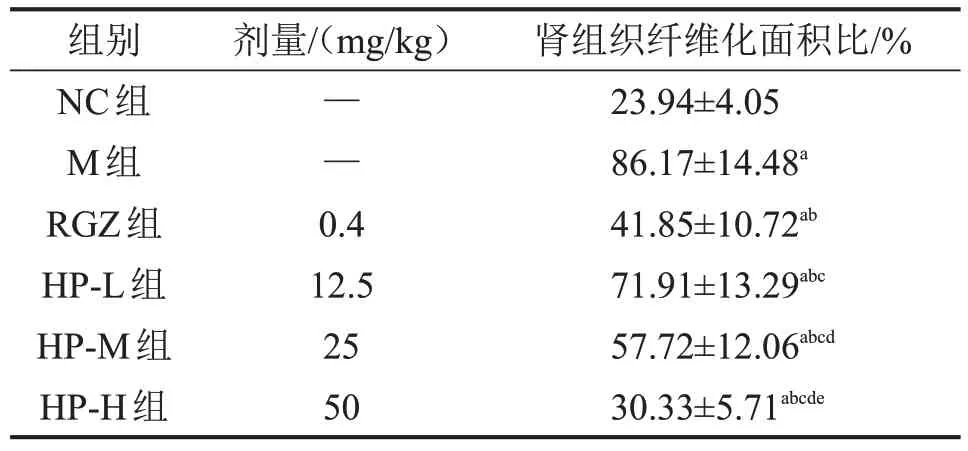
表3 各组大鼠肾组织纤维化面积比 n=12,
与NC 组比较,aP<0.05;与M 组比较,bP<0.05;与RGZ组比较,cP<0.05;与HP-L 组比较,dP<0.05;与HP-M 组比较,eP<0.05。
2.3 各组大鼠肾EMT相关蛋白表达水平比较
与NC组比较,M组大鼠肾组织E-cadherin蛋白水平显著降低,α-SMA、Fibronectin蛋白水平显著增加(均P<0.05);与M组比较,RGZ组大鼠肾组织Ecadherin 蛋白水平显著增加,α-SMA、Fibronectin 蛋白水平显著降低(均P<0.05),HP-L 组、HP-M 组、HP-H 组大鼠肾组织肾组织E-cadherin 蛋白水平显著增加,α-SMA、Fibronectin 蛋白水平显著降低,且呈剂量依赖性(均P<0.05)。其中HP-H 组优于RGZ组(均P<0.05),见表4和图2。
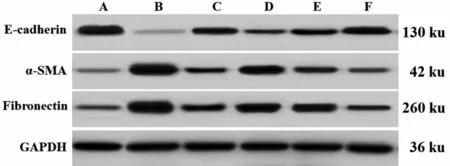
图2 各组大鼠肾组织E-cadherin、α-SMA、Fibronectin 蛋白表达
表4 各组肾组织E-cadherin、α-SMA、Fibronectin 蛋白表达比较 n=12,
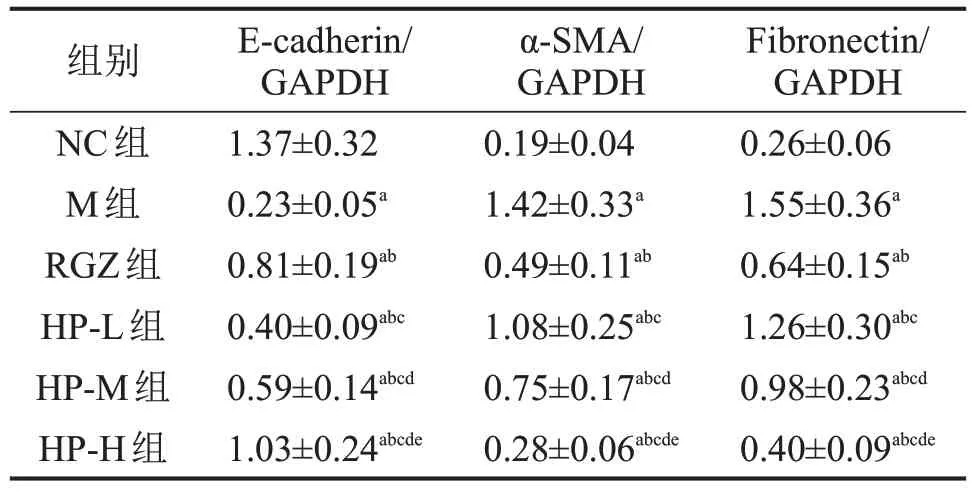
表4 各组肾组织E-cadherin、α-SMA、Fibronectin 蛋白表达比较 n=12,
与NC 组比较,aP<0.05;与M 组比较,bP<0.05;与RGZ组比较,cP<0.05;与HP-L 组比较,dP<0.05;与HP-M 组比较,eP<0.05。
2.4 各组大鼠肾组织TGF-β1/smad 通路相关蛋白表达水平比较
与NC 组比较,M 组大鼠肾组织TGF-β1、smad2、smad3 蛋白水平显著增加,smad7 蛋白水平显著降低(P<0.05);与M组比较,RGZ组大鼠肾组织TGF-β1、smad2、smad3蛋白水平显著降低,smad7蛋白水平显著增加(P<0.05),HP-L 组、HP-M 组、HP-H 组大鼠肾组织肾组织TGF-β1、smad2、smad3蛋白水平显著降低,smad7蛋白水平显著增加,且呈剂量依赖性(P<0.05)。其中HP-H 组优于RGZ 组(P<0.05),见表5和图3。
表5 WB检测肾组织TGF-β1/smad通路相关蛋白表达 n=12,
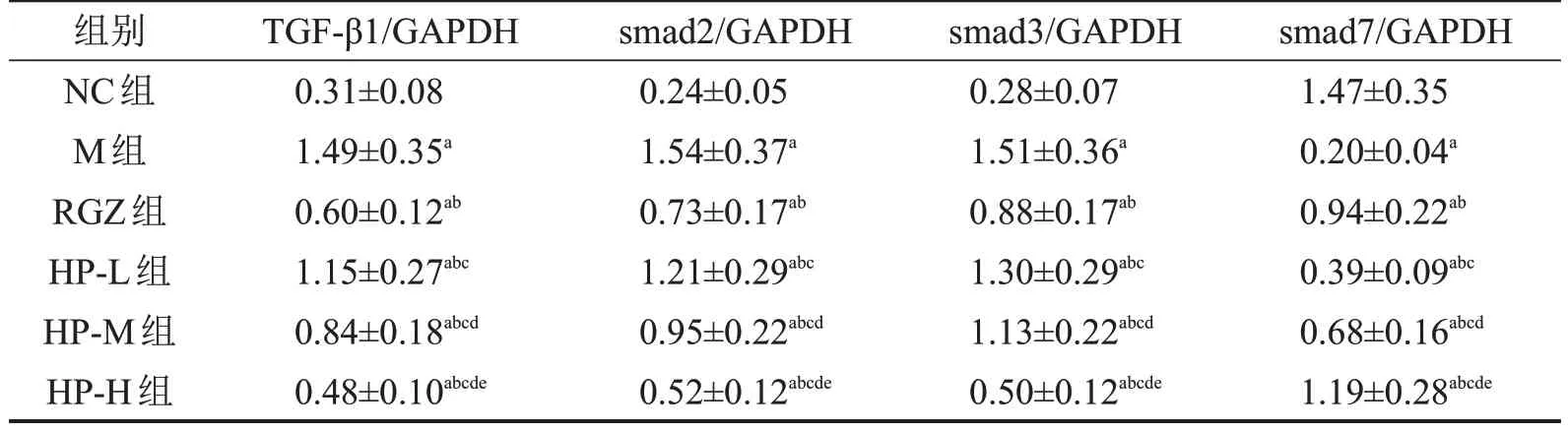
表5 WB检测肾组织TGF-β1/smad通路相关蛋白表达 n=12,
与NC组比较,aP<0.05;与M组比较,bP<0.05;与RGZ组比较,cP<0.05;与HP-L组比较,dP<0.05;与HP-M组比较,eP<0.05。
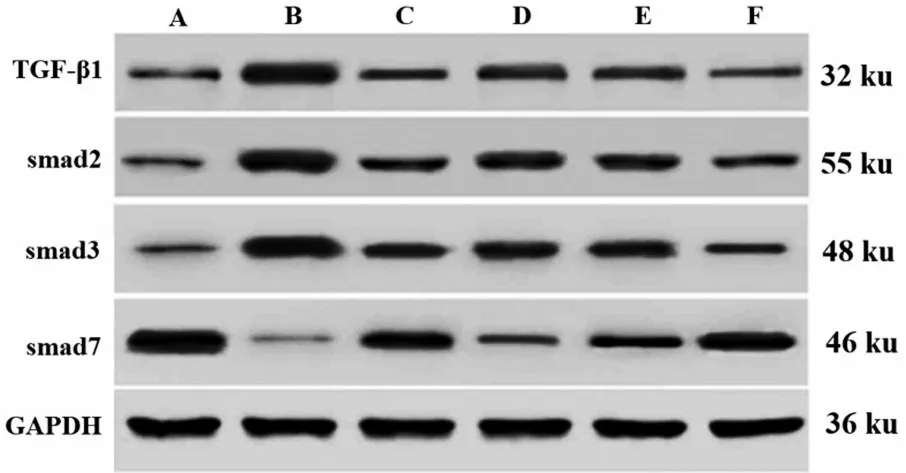
图3 各组大鼠肾组织TGF-β1/smad通路相关蛋白表达
3 讨论
DN 是导致糖尿病死亡的重要原因之一,目前对其发病机制仍未完全明确,与糖代谢紊乱、内质网应激和氧化应激等因素有关,肾病的不断发展会引起肾脏纤维化程度增加、肾水肿等,严重时可威胁患者生命[11]。因此,探究DN 相关治疗策略及可能机制仍是研究中的热点,而建立稳定有效的DN动物模型具有重要意义,杨等[9]通过高脂饲料喂养及STZ注射成功建立DN大鼠,本研究结果显示,与NC 组比较,M 组大鼠FBG、UAlb、Ucr、BUN 水平均显著升高,与DN病情发展类似,肾组织病理学结果显示模型组大鼠肾脏组织受到损害、纤维化程度加深,提示DN大鼠模型制备成功。
RGZ 是临床治疗DN 的常见药物,但其疗效不稳定且存在一定的肝毒性[12]。研究发现,植物中含有的多酚类、黄酮类化合物具有抗炎、降血脂及增强免疫力等多种生物活性,HP广泛存在于各种植物中,为天然黄酮类化合物,因其分布广泛且具有一定的药理作用而深受研究者关注[13-14]。黄凯等[15]研究发现,HP可通过清除自由基、减少炎性因子释放、调节T细胞亚群平衡对小鼠免疫性肝损伤发挥保护作用。Zhang 等[16]研究发现HP 可减少DN 小鼠的UAlb,改善DN 小鼠肾小球系膜基质的扩张及足细胞突起的消失,进而缓解DN 小鼠的肾脏损伤。An等[17]研究发现,HP 可减轻DN 小鼠肾小球基底膜损伤,改善其临床症状,对DN小鼠肾组织有一定的保护作用。本研究结果显示,与M组比较,经HP治疗的大鼠FBG、UAlb、Ucr、BUN 水平均显著降低,肾脏受损程度及肾脏纤维化面积均得到改善,且呈现一定的剂量依赖性,其中HP-H 组较好且优于阳性药物RGZ 组,提示HP 可有效改善DN 大鼠血糖代谢及肾脏功能。
资料显示,进行性肾间质纤维化是DN 的标志性病理特征,而EMT在肾间质纤维化中发挥重要作用,EMT是使极化的上皮细胞经历多种生化变化获得间充质细胞表型的生物学过程,在此过程中,上皮细胞的迁移、侵袭、抗凋亡能力较强,可促进细胞外基质沉积,进而加剧肾间质细胞纤维化,危害肾脏功能[18]。Yang 等[19]研究发现,YY1 高表达可通过上调α-SMA 的表达诱导EMT,进而促进糖尿病小鼠肾纤维化。EMT常以α-SMA、Fibronectin等间充质标记物过表达、E-cadherin 表达缺失等为主要特征[20],本研究结果显示,与NC 组比较,M 组大鼠Ecadherin 蛋白水平显著降低,α-SMA、Fibronectin 蛋白表达水平显著升高,提示肾EMT与肾脏纤维化联系密切,可能参与了DN进程,与M组比较,HP各剂量组EMT相关蛋白表达水平均得到缓解,且呈现一定的剂量依赖性,其中HP-H 组较好且优于阳性药物RGZ 组,提示HP 可能具有一定的抑制DN 大鼠肾EMT的作用。
TGF-β1 可诱导多种上皮细胞发生EMT,具有正向调控EMT的作用,是肾间质纤维化及肾小球硬化的重要细胞因子[21-22],林等[21]研究发现,TGF-β1/smad通路激活可促进肝脏细胞EMT及肝脏纤维化进程,TGF-β1 与其受体结合形成三聚体,进而激活smad2、smad3,而smad7 可抑制TGF-β1 信号的传导,可抑制肾EMT及肾纤维化进程。本研究结果显示,与与M 组比较,HP 各剂量组大鼠肾组织TGF-β 1、smad2、smad3 蛋白水平显著降低,smad7 蛋白水平显著增加,提示HP可能通过抑制TGF-β1/smad通路激活来减轻DN大鼠肾EMT及肾纤维化程度。
综上所述,HP 可减轻DN 大鼠肾EMT 及肾纤维化程度,可能与抑制TGF-β1/smad 通路有关。本研究初步探索HP 对DN 大鼠肾功能的保护作用及其可能机制,但HP作用机制复杂,关于其详细药理作用机制尚不完全明确,有待进一步深入探究。
猜你喜欢
杂志排行
广西医科大学学报的其它文章
- 基于Klotho/FGF23通路探讨天麻钩藤饮对大鼠静脉桥血管氧化应激及内膜增生的影响*
- 腹壁剖宫产瘢痕子宫内膜异位症恶变为透明细胞癌1例*
- miR-508-3p靶向AFF4/TGFβ1信号通路调控人牙髓细胞分化的机制研究*
- Effect of curcumin on palmitic acid-induced apoptosis and steroid production of ovarian granulosa cells by inhibiting HMGB1-mediated autophagy
- 白藜芦醇对人甲状腺乳头状癌细胞IHH4细胞恶性生物学特征及PI3K/Akt信号通路影响*
- 六月青醇提物凝胶剂对大鼠慢性湿疹的作用研究*
