免疫球蛋白轻链型淀粉样变性的细胞遗传学特征及预后
2021-12-17贾双双唐海龙褚玉平高广勋
贾双双,徐 莉,唐海龙,褚玉平,刘 骁,高广勋
(空军军医大学第一附属医院血液内科,西安 710032;*通讯作者,E-mail:gaoguangxun@fmmu.edu.cn)
免疫球蛋白轻链型淀粉样变性(immunoglobulin light chain amyloidosis,AL amyloidosis),简称AL淀粉样变,是一种由免疫球蛋白轻链(LC)错误折叠引起的罕见克隆性浆细胞疾病,其发病机制是LC以淀粉样蛋白原纤维的形式沉积在多个器官的细胞外基质中,并在其中形成有害的蛋白质聚集体,导致细胞死亡和器官功能障碍[1]。近年来,AL淀粉样变的细胞遗传学特征受到越来越多的关注,但鉴于该病的罕见性及骨髓中较低的克隆性浆细胞百分比[2-4],针对产生淀粉样蛋白的浆细胞的细胞遗传学特征尚无系统报道,故在此对其进行综述,以期为AL淀粉样变细胞遗传学的进一步研究及AL淀粉样变患者的精准治疗提供线索。
1 细胞遗传学特征
1.1 染色体畸变及拷贝数畸变
1.1.1 染色体畸变 染色体畸变是AL淀粉样变的一个重要细胞遗传学特征,在绝大多数患者中均可检测到。最常见的染色体畸变是涉及14q32染色体上IgH重链基因座的易位,其中发生频率最高的为t(11;14),而t(4;14)和t(14;16)却很少检出[5-10]。其他常见畸变包括染色体13单体/13q缺失,染色体9、15、11、3三体,11q23扩增,13q14缺失,1q21扩增及19q13扩增等[5,6]。在Warsame等[6]对401例AL淀粉样变患者进行的研究中,t(11;14)发生率为43%,t(14;16)和t(4;14)分别为3%和2%;染色体13单体或13q缺失占30%;染色体9、15、11、3三体分别占20%,14%,10%和10%。较罕见的染色体畸变包括超二倍体、染色体四体、某些MM相关高危畸变[如del 17p、t(14;16)、t(14;20)]及染色体8p21缺失等[5-7]。
目前AL淀粉样变的治疗方案大多衍生于多发性骨髓瘤,但疗效并不完全契合,这与二者不同的细胞遗传学特征具有很大关系,具体分布差异如下[5-7,10,11]:单纯AL淀粉样变患者的t(11;14)发生率明显高于多发性骨髓瘤(multiple myeloma,MM)患者,其中t(11;14)在AL淀粉样变中发生率为39%-53%,但在MM中发生率仅为15%-20%。此外,Kobayashi等[12]的回顾性研究(40例)发现不伴MM的AL淀粉样变患者也比同时患有MM的AL淀粉样变患者的t(11;14)发生率高。超二倍体在AL淀粉样变中发生率(4%-11%)远低于在MM中的发生率(50%);del 17p和t(4;14)在AL淀粉样变中发生率分别为0-2%和0-4%,均低于在MM中发生率(分别为10%和15%)。
1.1.2 拷贝数畸变 既往染色体异常多采用荧光原位杂交(fluorescence in situ hybridization,FISH)技术检测,但相较于全基因组拷贝数阵列分析,FISH对于染色体整体和部分异常现象的区分不够敏锐。Granzow等[13]首次利用全基因组拷贝数阵列分析了118例AL淀粉样变患者的拷贝数变化,检测到:最常见的扩增是染色体1q(36%,包括一个1号染色体三体),其次是9号染色体三体(24%)和染色体臂11q(24%),发生频率较低的是19号染色体三体(15%),15号(14%),5号(14%),18号(13%)和11号(11%)的染色体三体。
最常见的缺失是13号染色体(40%),其中70%的患者表现为单体,而30%的患者仅表现为13号染色体部分缺失。最常见的染色体区域是13q21.32-q21.33(chr13:67 533 438-70 847 141),占88%。该区域仅包含两个基因:原钙黏蛋白9(protocadherin 9,PCDH9)和长链非编码RNA LINC00550(long intergenic non-coding RNA550)。其次是14号染色体(25%),与13号染色体相反,仅23%的患者表现为单体,其余77%为部分缺失。染色体14q部分缺失的最小共有区域是14q24.1-q31.1(chr14:69 416 523-82 198 988),跨越14 Mb,包含122个基因。受缺失影响较小的染色体区域位于染色体16q(14%),6q(10%)和8p(8%)。
1.1.3 聚类分析 Bochtler等[7]应用致癌树模型比较了AL淀粉样变(246例)和MGUS/MM(180例)两组患者的染色体畸变聚类情况,该模型将6个主要的染色体畸变纳入分析,最终将AL淀粉样变分为以下4个亚组:①t(11;14);②伴有未知伴侣的IgH易位(IgH translocation with an unknown partner);③超二倍体(HD)/1q21扩增;④携带13q14缺失/t(4;14)的非超二倍体(NHD)。
在伴有11q23扩增的AL淀粉样变患者组中,可观察到两组细胞遗传学异常特征:t(11;14)阳性携带者和超二倍体核型携带者[7]。与MM相一致[14,15],超二倍体和“主要”的IgH易位t(11;14)具有较强的负相关性,但这种反向关联不适用于伴有未知伴侣的IgH易位即“次要”的IgH易位,后者在超二倍体组和非超二倍体组之间均等分布[7,13]。
尽管AL淀粉样变组和MGUS/MM组的致癌树模型具有很高的重叠性,但在AL淀粉样变组中1q21扩增与超二倍体相关;而在MGUS/MM组中1q21扩增则与携带13q14缺失/t(4;14)的非超二倍体(NHD)相关[7],后者在先前的研究中同样可以观察到[5,16,17]。
1.2 克隆异质性
目前已有很多研究者关注克隆内遗传异质性对于血液系统恶性肿瘤发展中的基因克隆演化及预后的相关影响[18-20]。存在于主要克隆中的细胞遗传学畸变被认为构成了肿瘤发生根源上早期的、可能与起始相关的事件,而仅在亚克隆大小中可检测到的细胞遗传学异常被认为是疾病较晚阶段的、可能与进展相关的事件。
Bochtler等[18]比较了AL淀粉样变(544例)和非AL淀粉样变的浆细胞疾病(519例)两组的克隆和亚克隆组成情况,发现在AL淀粉样变组中,IgH易位大多数情况下作为主要克隆,只有在极少数情况下作为亚克隆,t(11;14)尤为明显。超二倍体也是主要的克隆畸变。这再次表明超二倍体与t(11;14)作为浆细胞发育不良的两个主要遗传分支的概念在AL淀粉样变中同样适用[7,21]。唯一在亚克隆中出现频率比主克隆更高的畸变是17p13缺失,8p21缺失和1q21扩增也是频繁出现的亚克隆畸变。此外,两组中均发现t(11;14)作为主要克隆畸变时与总体较低的亚克隆发生率相关,而超二倍体作为主要克隆畸变时增加了亚克隆发生的可能性。
1.3 基因突变
最近一项针对AL淀粉样变患者(48例)基因突变情况的研究[22]显示,AL淀粉样变患者中位突变负荷为每百万碱基1.2个,与MM[23]相比,该负荷很低,从突变的角度来看,AL淀粉样变的遗传状况相对较稳定。
在接受全外显子测序(whole exome sequencing,WES)的10名AL淀粉样变患者样本中鉴定出1 796个体细胞点突变,其中39.7%位于内含子区域,29.4%位于基因间区,19.2%位于编码DNA序列区域。非同义突变的数量是同义突变的数量的3.3倍,平均频率为每百万个碱基0.8个(范围:0.1-2.1)。突变谱分析表明,C>T/G>A突变是样品中的主要突变,其次是T>C/A>G。在体细胞的非沉默的蛋白编码基因突变中,发现4个显著突变基因(significantly mutated genes,SMGs)影响NF-κB途径:DUSP2,NFKBIA,KRAS和BIRC3,表明NF-κB信号通路在AL淀粉样变发病机制中的重要性。
靶向基因测序(targeted gene sequencing,TGS)结果显示85%的患者至少存在一种突变,每位患者的中位突变频率为3个突变(范围:0-13)。最常见的突变基因是IGLL5,可在8名(n=48)患者中发现,其次是ASCC3在7名患者(n=48)中发现。通过TGS检测及Sanger测序验证鉴定出4个重现性突变:ASB15(c.844C>T),ASCC3(c.1595A>G),HIST1H1E(c.311C>T)和KRAS(c.35G>A),其中前3个突变与总体生存期(OS)较短有关[22]。
总之,相较于MM,AL淀粉样变具有更高的t(11;14)发生率和更低的超二倍体发生率,且亚克隆形成率及基因突变负荷均较低。AL淀粉样变相对稳定的遗传状况也是其早期并不需要临床干预的原因之一,但如何选择恰当的干预时间点仍存在争议。当AL淀粉样变患者细胞遗传学特征发生变化时,或许可以为我们早期提示疾病进展,以便及时干预。
2 细胞遗传学与临床特征的相关性
2.1 细胞遗传学与临床表现相关
AL淀粉样变的临床表现是由轻链的淀粉样蛋白生成特性决定的,而不是由核型不稳定性本身所决定[5,8]。研究发现染色体畸变并不直接导致淀粉样变性,细胞遗传学特征与临床参数的相关性较低[5],仅观察到t(11;14)患者中男性比例较多[24],而超二倍体与高龄相关,但与AL淀粉样变中的受累器官数量类型无关[7,13]。
免疫球蛋白轻链可变区(light chain variable region,IGVL)基因与器官受累关系密切[25]。Lambda基因中,LV6-57患者更易肾脏受累;LV3-01患者很少会出现心脏和肾脏受累;LV2-14患者更倾向于周围神经受累、检测到完整的循环免疫球蛋白和较低的血清游离轻链差值(free light chain difference,dFLC)水平;LV1-44患者更易心脏受累。Kappa基因中,KV1-33患者更易肝脏受累,有较高的循环dFLC水平KV1-05与总生存期(overall survival, OS)较差有关,但与心脏事件无关。
2.2 细胞遗传学与淀粉样变血液学指标的相关性
AL淀粉样变有两个较为显著的标志:缺乏完整的免疫球蛋白、λ轻链限制占主导地位。t(11;14)对前者贡献很高,因其发生频率最高,且与免疫固定电泳中缺乏完整的免疫球蛋白显著相关[5,24],但t(11;14)无法解释λ轻链型的高发。相反,在t(11;14)阳性患者中,κ轻链型患者的t(11;14)比率甚至比λ轻链型患者略高(57%vs41%)[5],且t(11;14)阳性患者较阴性患者的κ/λ值大[24]。t(11;14)与骨髓浆细胞比例的关系在多个研究中结果并不一致[5,6,10],仍需进一步证实。
1q21扩增是唯一与λ轻链限制相关的染色体畸变[5,18],且与完整免疫球蛋白相关[24],这一点与t(11;14)相反。此外,1q21扩增与较高的浆细胞比例和dFLC 180 mg/L临界值相关(1q21扩增的患者中dFLC≥180 mg/L者占较高比例)[5,24]。
其他细胞遗传学异常与血液学相关参数的关系如下:超二倍体患者更易检测到完整免疫球蛋白,且和κ轻链限制及较高的骨髓浆细胞比例相关[7]。而11q23扩增与κ轻链限制及较高的浆细胞比例相关,染色体13单体或13q缺失与高NT-proBNP独立相关,也与较高的浆细胞比例有关[6,10,18]。Del 17p以及三体的存在均与骨髓浆细胞比例增多有关[6,26](见图1)。
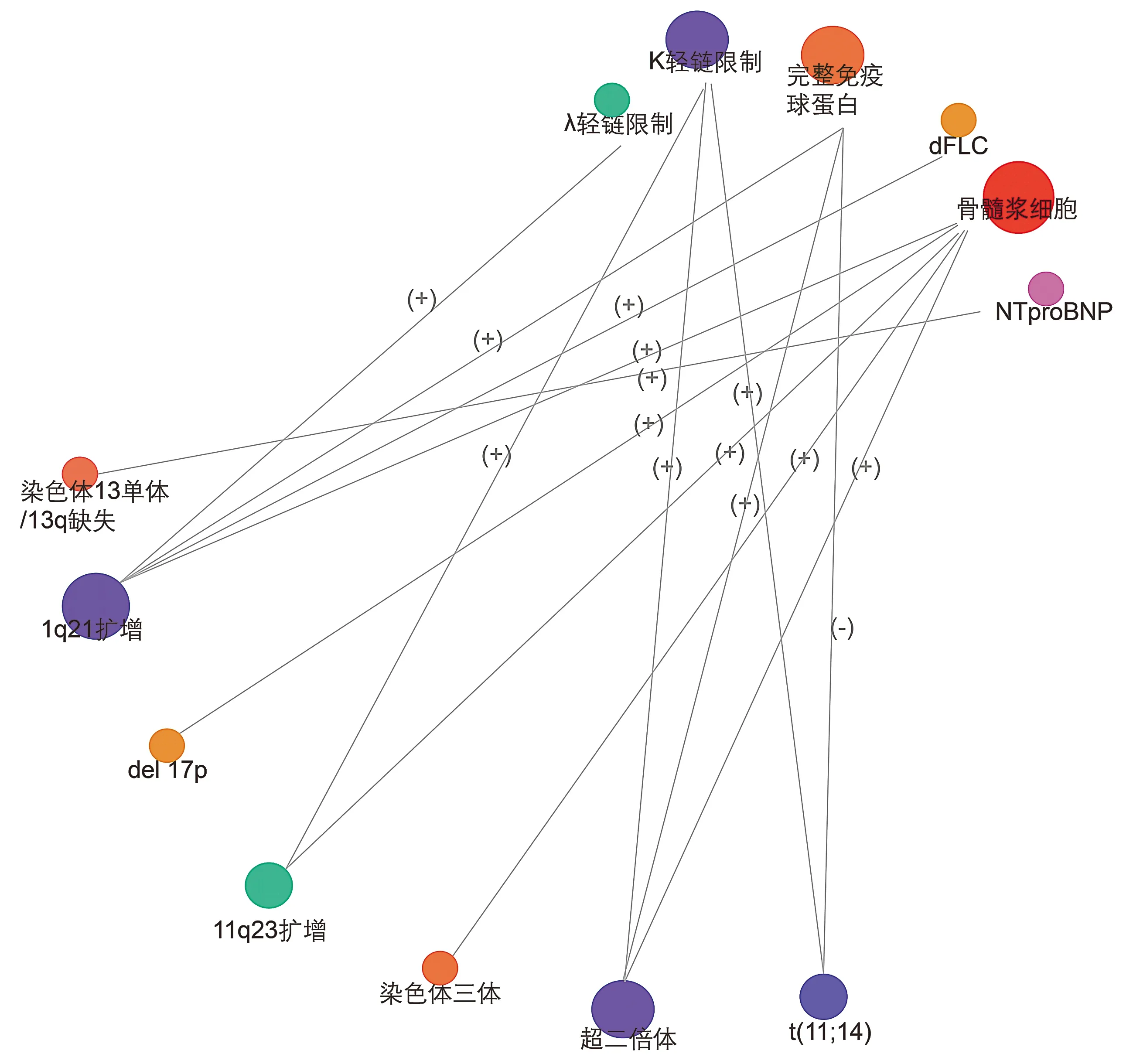
图中仅t(11;14)与完整免疫球蛋白之间的连线关系为(-),表示负相关,余连线均表示正相关图1 细胞遗传学异常与AL淀粉样变血液学相关参数的关系
3 细胞遗传学与临床预后的相关性
3.1 t(11;14)
在未对治疗因素进行分层之前,t(11;14)被认为是AL淀粉样变的不良预后因素[6,10]。随着治疗方案的多样化,t(11;14)体现出对预后独特的影响。
基于硼替佐米或免疫调节剂(immunomodulatory drugs,IMiD)方案治疗时,t(11;14)患者有着较低的≥VGPR率和较差的OS[26]。尤其硼替佐米治疗的患者中,t(11;14)是血液学无事件生存率(hematologic event-free survival,hem EFS)和OS的独立不良预后指标,危险比(hazard ratio,HR)分别为2.94和3.13[27]。但t(11;14)对硼替佐米治疗的患者的不利影响似乎仅在伴有其他预后良好因素亚组(如年龄<65岁,受累器官数量为1-2个,较低dFLC水平,梅奥2004分期为1-2期等)中出现[26];而在临床特征和心脏生物标志物预后不良的患者中,t(11;14)的存在并不会导致经硼替佐米治疗患者预后的进一步恶化。且Warsame等[6]的发现与此相一致,t(11;14)在肿瘤负荷较低(骨髓浆细胞增多<10%)(预后良好因素)的AL淀粉样变患者中为独立不良预后因素。
而基于马法兰或ASCT治疗的患者中,t(11;14)阳性与阴性组之间的≥VGPR率无显著差异[24,26],另一项研究[28]提示,大剂量马法兰治疗后t(11;14)阳性患者的完全缓解(complete response,CR)率高于阴性患者。针对总生存期(overall survival,OS),Muchtar等[26]的研究显示接受基于马法兰或ASCT治疗后t(11;14)阳性与阴性患者OS无显著差异,另外两项对于接受马法兰和地塞米松治疗的AL淀粉样变患者的研究[24,28]均显示经治疗后t(11;14)阳性患者获得更优的EFS和OS。因此,马法兰或ASCT治疗或许可抵消甚至改善t(11;14)阳性患者的生存不利情况。
既往维奈克拉(venetoclax)治疗复发难治MM患者的研究(66例)显示,t(11;14)阳性患者具有更高的缓解率[29]。在AL淀粉样变患者中维奈克拉同样显示出其治疗优势[30,31]。一项针对多中心的复发难治AL淀粉样变患者人群(43例)的研究显示[30],经维奈克拉治疗后,t(11;14)阳性患者具有更高的≥VGPR率(78%vs30%)和更高的PFS(not reachedvs6.7月,HR=0.14,95% CI 0.04-0.53)。因此维奈克拉为复发难治AL淀粉样变患者尤其是t(11;14)阳性患者带来更多的生存机会。
3.2 染色体三体
尽管染色体三体阳性与阴性患者相比,≥VGPR发生率及器官反应率相似,但OS较差[26]。按治疗方案分组后,三体阳性患者基于马法兰治疗时具有更短的OS;基于硼替佐米治疗时OS有缩短趋势,但差异无统计学意义(P=0.08);而基于ASCT或IMiD治疗时OS暂未见显著差异[26]。
一项针对AL淀粉样变长期生存者的研究也间接地验证了染色体三体的不良预后作用[32],与未存活到10年的AL淀粉样变患者相比,在10年的幸存者中染色体三体的发生率更低。此外,Warsame等[6]的研究显示,在肿瘤负荷较高(骨髓浆细胞增多>10%)的亚组中,任何染色体三体均被认为是独立不良预后因素,但染色体三体本身与更高的骨髓浆细胞比例相关[6,26],因此这一分类的意义并不明确,但也证实了染色体三体对预后不利。
3.3 1q21扩增
1q21扩增在MM中被认为与疾病进展相关,此概念在AL淀粉样变中似乎同样适用[5,24]。在接受马法兰-地塞米松治疗的患者(103例)中,1q21扩增是OS和EFS的不利因素[24],即便多变量分析显示Mayo心脏评分是影响EFS的另一个预后因素,在同一级别Mayo分期患者中,1q21扩增仍然是OS的不良预后因素[24]。但1q21扩增在另一项大剂量马法兰续贯自体移植治疗患者(123例)的研究中显示对预后无影响[28],目前尚不能确定是该治疗方案消除了1q21扩增的不利预后作用,还是由于1q21扩增发生率较低造成研究数据不足使得统计效能低下。
3.4 其他细胞遗传学异常
与MM相关的高危畸变如t(4;14)、t(14;16)和del(17p13),在马法兰续贯自体移植治疗的AL淀粉样变患者(123例)中被认为是不利预后因素[28],而在经硼替佐米治疗的患者(101例)中,其预后良好,表明硼替佐米可以克服其不良预后[27]。del 17p阳性患者的OS较短[26,33],该类患者的del 17p浆细胞百分比对预后具有显著影响:del 17p浆细胞>50%和≤50%的患者的中位生存期分别为28个月和52个月(P=0.08)[33]。
关于超二倍体,在大剂量马法兰联合自体干细胞移植治疗的AL患者中,超二倍体阳性与阴性患者的EFS和OS无显著差异[28]。Del13/del13q阳性的患者暂未发现生存劣势[10],且与单独的t(11;14)患者相比,del 13/del 13q和t(11;14)并存患者的OS无显著缩短[26]。1p缺失和14q缺失可能对预后产生不利影响[13],1p缺失的患者EFS较差;在伴随1q扩增的患者中,14q缺失阳性者EFS较差,但该证据较弱(P=0.06)。关于基因突变,ASB15(c.844C>T),ASCC3(c.1595A>G),HIST1H1E(c.311C>T)与OS较短相关[22]。
4 总结
t(11;14)因发生频率高且与缺乏完整免疫球蛋白显著相关,无疑是AL淀粉样变细胞遗传学特征中最为特殊的类型[5]。
从克隆异质性的角度看,t(11;14)与超二倍体同时作为两个主要遗传分支[7,21],绝大多数情况下各自都是作为主要克隆,而非亚克隆。二者相互排斥,这不仅体现在发生率上[7,13],还体现在对亚克隆形成的促进作用上[18]。t(11;14)在AL淀粉样变中的高发生率与超二倍体在MM中的高发生率形成鲜明对比,似乎可以间接说明MM比AL淀粉样变具有更复杂的亚克隆和更多的克隆异质性。或许从这个角度研究,可以对二者治疗差异及AL淀粉样变治疗的选择带来更多启示。
随着新的治疗方法涌现,如伊沙佐米治疗复发/难治性AL淀粉样变[34]、免疫疗法如CD38单克隆抗体Daratumumab[35,36]等在AL淀粉样变中的使用,新药的出现必然会使AL淀粉样变患者的预后因素产生新的变化,现有关于细胞遗传学对预后影响的认识将会得到进一步延伸。而新的技术如全拷贝数阵列分析、全外显子测序等在AL淀粉样变细胞遗传学的应用使得对细胞遗传学的研究更为全面,更有助于推进AL淀粉样变患者的精准化和个体化治疗。
