CRMP2过表达及沉默对Aβ25-35诱导SH-SY5Y细胞损伤的影响
2021-12-17吕俊杰高媛媛
胡 杨,张 宇,吕俊杰,薛 欢,高媛媛
(1山西医科大学药理学教研室,太原 030001;2细胞生理学教育部重点实验室,山西医科大学生理学系;3山西医科大学化学教研室;4山西医科大学微生物与免疫学教研室;*通讯作者,E-mail:891583967@qq.com)
脑衰反应调节蛋白2(collapsin response mediator protein 2,CRMP2)是一种具有多种神经功能的磷蛋白,在海马区和脑皮质表达丰富,调节微管功能并参与细胞骨架的形成,调节神经元极性及迁移,参与突出链接及轴突运输,参与多种电压和配体门控离子通道调控[1,2]。大量研究发现,CRMP2蛋白表达及修饰异常与多种疾病的发生发展密切相关,包括阿尔茨海默病(Alzheimer’s disease,AD)、慢性疼痛、双相情感障碍、缺血缺氧性脑病和癌症等[3]。研究表明,CRMP2与AD起病早期的Tau蛋白异常及神经纤维缠结密切相关[4]。主流的β淀粉样蛋白(amyloid-β,Aβ)级联理论认为,Aβ在脑内过度沉积并诱导级联反应进而引起神经细胞凋亡,对AD的发生发展具有重要作用[5]。Aβ在AD中主要以Aβ1-42和Aβ1-40两种结构存在,其中Aβ1-42的神经毒性较强,人工合成的Aβ25-35与Aβ1-42具有接近的神经毒性[6]。目前,CRMP2蛋白表达及修饰异常对各种因素诱导细胞损伤的影响研究较少。本研究旨在通过慢病毒感染使CRMP2在SH-SY5Y细胞中过表达及沉默,探究CRMP2对Aβ25-35诱导的SH-SY5Y细胞损伤的影响,进一步揭示CRMP2在AD病理机制中的作用,为AD的治疗提供新的靶点及理论基础。
1 材料与方法
1.1 细胞系及主要试剂
SH-SY5Y细胞系购自江苏凯基生物技术股份有限公司。培养基成分:RPMI-1640、10%小牛血清;培养环境:5% CO2、37 ℃恒温孵育箱。RPMI-1640培养液购自美国Gibco公司;小牛血清购自以色列Biological Industries公司;CRMP2抗体,β-actin抗体,Aβ25-35、MTT及DMSO购自美国Sigma-Aldrich公司;LDH细胞毒性检测试剂盒、Hoechst染色试剂盒购自上海碧云天生物技术公司。
1.2 慢病毒感染及分组
为获得CRMP2过表达及沉默SH-SY5Y细胞株,将细胞分为4组进行实验:CRMP2过表达组、空载体组、CRMP2沉默组及扰乱载体组。根据GenBank提供的人源CRMP2基因信息,CRMP2基因序列与pGLV5-EF1a-GFP&Puro载体经酶切链接,获得CRMP2过表达重组慢病毒载体及空白对照载体;以CRMP2为靶基因设计shRNA,shRNA与pGLV3-H1-GFP&Puro载体经酶切链接,获得CRMP2沉默重组慢病毒载体(5′-AGCCAAAGTCTTCAACCTTTA-3′),及扰乱对照载体(5′-TTCTCCGAACGTGTCACGT-3′)。将上述慢病毒载体与病毒包装辅助质粒共转染293T细胞,培养并收集上清液浓缩获得相应慢病毒。将4种慢病毒分别感染SH-SY5Y细胞并用嘌呤霉素筛选获得稳转SH-SY5Y细胞株。采用荧光检测和Western blot检测分别验证转染效果和CRMP2过表达及沉默效果。为后续探究CRMP2过表达及沉默在Aβ25-35诱导的SH-SY5Y细胞损伤中的影响,四组细胞均用终浓度为3 μmol/L的Aβ25-35孵育处理24 h后,进行后续实验。
1.3 荧光检测慢病毒感染效率
将经筛选的细胞置于倒置荧光显微镜下进行明场和荧光观察,统计发绿色荧光细胞数和不发荧光细胞数,计算感染效率。感染效率(%)=绿色荧光细胞数/(绿色荧光细胞数+不发荧光细胞数)。
1.4 Western blot检测CRMP2过表达及沉默效果
按照Western blot实验方法,收集细胞,提取并测定细胞总蛋白。蛋白样品用10%的SDS-PAGE凝胶分离并转移至PVDF膜上,5%脱脂奶粉封闭2 h,抗CRMP2(1 ∶1 000)4 ℃孵育12 h,相应二抗(1 ∶1 000)室温孵育1 h,ECL显影,Quantity One软件进行数据分析。
1.5 MTT实验检测细胞活性
活细胞线粒体中的琥珀酸脱氢酶能使MTT还原为蓝紫色结晶甲臜,而死亡细胞无此功能,活性较低的细胞此功能较弱,故MTT实验可以间接反映细胞活性。四组细胞均设置未经Aβ25-35处理的对照细胞孔即对照孔,无细胞对照孔即空白孔,以及Aβ25-35处理的细胞孔即处理孔。96空板中孵育24 h后,每孔中加入10 μl MTT,37 ℃孵育4 h,吸弃孔内液体,每孔加入100 μl DMSO,摇床上震荡10 min,酶标仪在490 nm处检测吸光度。细胞活性(%)=(处理孔OD值-空白孔OD值)/(对照孔OD值-空白孔OD值)。
1.6 LDH释放实验检测细胞毒性
LDH是存在于细胞浆中的酶,当细胞膜损伤时快速释放到胞外,故LDH释放实验可以间接反映细胞毒性。四组细胞均设置未经Aβ25-35处理的对照细胞孔即对照孔,未经Aβ25-35处理用于后续裂解的细胞孔即最大酶活性对照孔,以及Aβ25-35处理的细胞孔即处理孔。96空板中孵育24 h后,每孔各吸取上清液120 μl,400g离心5 min,取上清液100 μl于新的96孔板相应孔中,按照LDH细胞毒性检测试剂盒说明书进行测定,酶标仪检测波长为490 nm。细胞毒性=(处理孔OD值-对照孔OD值)/(最大酶活性的OD值-对照孔OD值)。
1.7 Hoechst 33258荧光染色实验检测细胞凋亡
洁净盖玻片置于六孔板培养细胞,Aβ25-35孵育处理后,吸弃培养液,加入1 ml固定液,固定20 min后用PBS洗涤。加入1 ml Hoechst 33258染色液,染色5 min后用PBS洗涤。抗荧光淬灭液进行封片,立即进行荧光观察。正常细胞核呈规则的蓝色,而凋亡细胞核呈现致密或碎块状致密的亮蓝色。
1.8 统计学分析
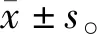
2 结果
2.1 CRMP2在SH-SY5Y细胞中过表达及沉默
荧光检测结果显示,各组细胞均表达较强的荧光(图1),慢病毒感染效率均达95%以上。WB检测结果显示,与扰乱载体组相比,CRMP2沉默组CRMP2蛋白表达显著减少(P<0.01);与空载体组相比,CRMP2过表达组CRMP2蛋白表达显著增加(P<0.01,见图1)。
与扰乱载体组比较,##P<0.01;与空载体组比较,**P<0.01图1 荧光检测和Western blot检测验证转染效果Figure 1 Validation of transfection efficy by fluorescence detection and Western blot
2.2 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞活性的影响
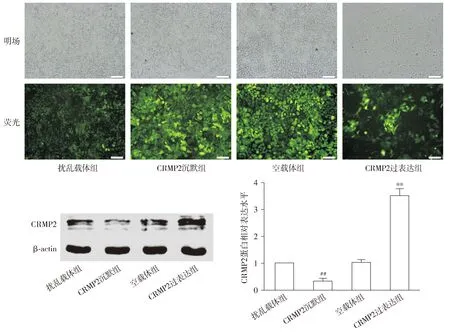
MTT实验结果显示,以扰乱载体组细胞活性为100%,与扰乱载体组相比,CRMP2沉默组细胞活性显著升高(P<0.05);与空载体组相比,CRMP2过表达组细胞活力显著降低(P<0.01,见图2)。
2.3 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞毒性的影响
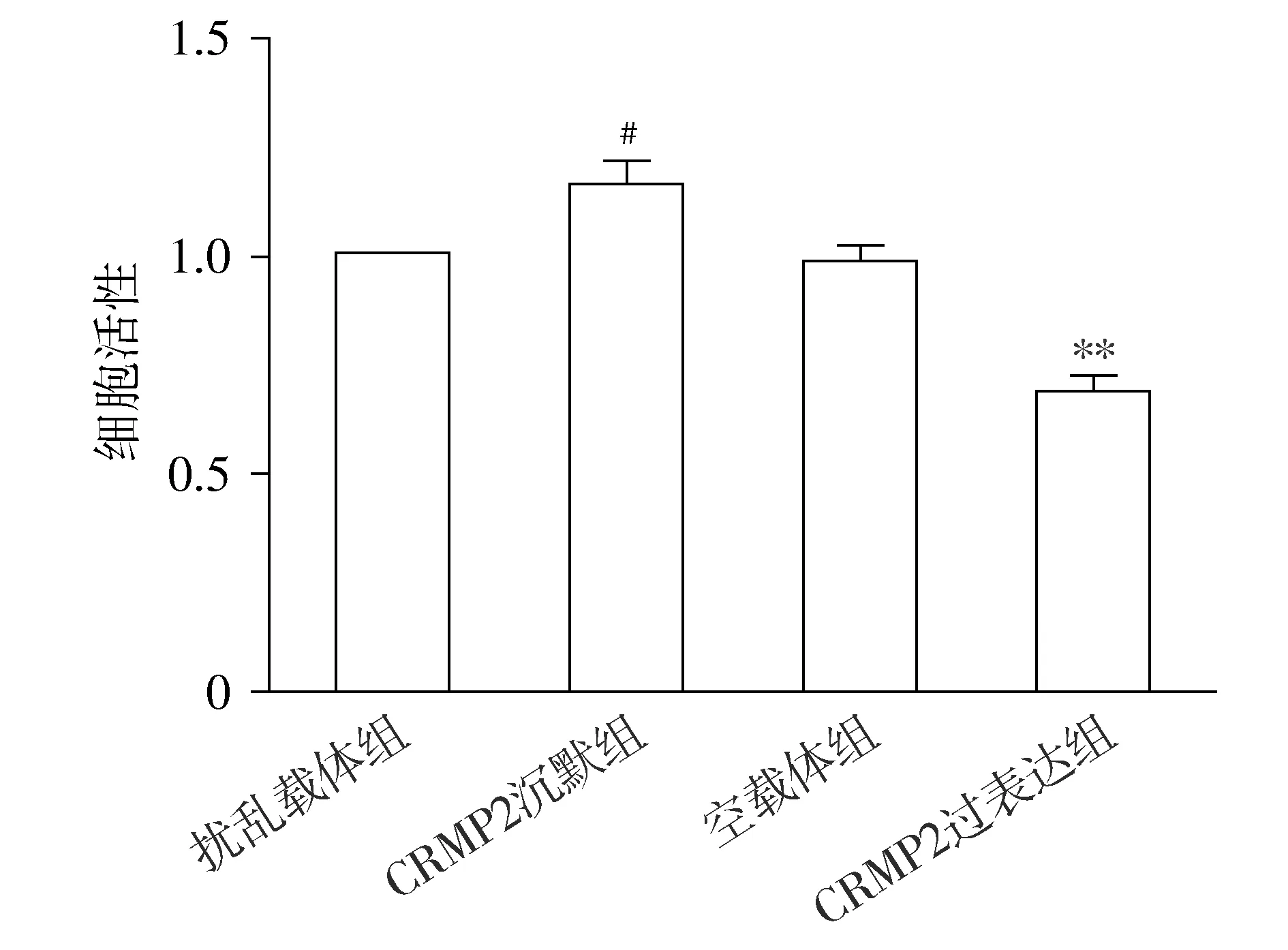
LDH实验结果显示,以扰乱载体组细胞毒性为100%,与扰乱载体组相比,CRMP2沉默组细胞毒性显著降低(P<0.05);与空载体组相比,CRMP2过表达组细胞毒性显著增加(P<0.01,见图3)。
与扰乱载体组比较,#P<0.05;与空载体组比较,**P<0.01图2 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞活性的影响Figure 2 Effects of CRMP2 overexpression and knockdown on SH-SY5Y cell activity after incubation with Aβ25-35
2.4 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞凋亡的影响
Hoechst 33258实验结果显示,与扰乱载体组相比,CRMP2沉默组细胞凋亡率显著降低(P<0.05);与空载体组相比,CRMP2过表达组细胞凋亡率显著升高(P<0.01,见图4)。
与扰乱载体组比较,#P<0.05;与空载体组比较,**P<0.01图3 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞毒性的影响Figure 3 Effects of CRMP2 overexpression and knockdown on SH-SY5Y cell cytotoxicity after incubation with Aβ25-35
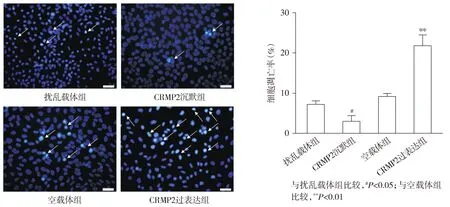
图4 CRMP2过表达及沉默对Aβ25-35孵育后SH-SY5Y细胞凋亡的影响Figure 4 Effects of CRMP2 overexpression and knockdown on SH-SY5Y cell apoptosis after incubation with Aβ25-35
3 讨论
AD是一种起病隐匿的神经退行性疾病,为最常见的痴呆症类型,主要病理特征为脑皮质和海马萎缩,突触减少及神经元缺失,脑内出现老年斑和神经纤维缠结,其发病机制目前尚未完全阐明,且临床尚无理想的治疗药物[7]。CRMP2可与α-微管蛋白和β-微管蛋白结合,促进微管的组装及维持微管稳定性[8]。磷酸化的CRMP2与微管解离,影响轴突蛋白传递功能,导致神经元功能损伤,促进AD的发生发展[9]。
除微管蛋白外,CRMP2还能与肌动蛋白、波形蛋白及多种离子通道等相互作用,调节多种生理功能[10]。研究表明,CRMP2表达降低及CRMP2磷酸化程度增加可促进乳腺癌细胞增殖[11]。本研究通过慢病毒感染SH-SY5Y细胞,构建了CRMP2过表达及沉默SH-SY5Y细胞,探究CRMP2在Aβ25-35诱导的SH-SY5Y细胞损伤中的具体作用。在创伤性脑损伤和脑缺血再灌注损伤的研究表明,CRMP2修饰异常诱导NMDA受体过度激活,导致大量胞外Ca2+进入胞内,引起突触后神经元Ca2+超载,进而引起神经元损伤,且干扰CRMP2与NMDA受体的相互作用可以抑制胞内Ca2+超载,起到神经保护作用[12,13]。CRMP2在神经元损伤和神经保护方面具有重要的调节作用。本研究通过MTT实验,LDH释放实验及Hoechst 33258荧光染色实验表明,在Aβ25-35诱导的SH-SY5Y细胞损伤模型中,CRMP2过表达导致SH-SY5Y细胞活性降低,毒性增强及凋亡增加,CRMP2沉默具有使SH-SY5Y细胞活性增加,毒性降低及凋亡减少的神经保护作用。
CRMP2通过复杂的机制调节多种生理功能并在多种疾病的发生发展中起着重要作用,但其与AD关联的研究较少。有研究表明,CRMP2能被CDK5在Ser-522位点磷酸化,从而增强其与CaV2.2离子通道的相互作用,导致大量胞外Ca2+内流引起Ca2+超载,从而导致细胞损伤[14]。本研究结果表明,CRMP2过表达及沉默在Aβ25-35诱导的细胞损伤中具有重要作用,猜测其机制可能与CRMP2表达增加,导致Aβ25-35诱导的CRMP2磷酸化增加,进而导致下游调节异常有关。本研究提示,通过靶向CRMP2调控其表达或靶向CRMP2的下游通路,可能达到神经保护的目的,以期对包括AD在内的多种神经退行性疾病起到预防或治疗作用。
