白毛藤多糖通过调控miR-431表达对结直肠癌SW620细胞增殖及凋亡的影响
2021-12-17王东宏
王东宏,徐 斌,刘 洁
(新疆医科大学附属中医医院肛肠科,乌鲁木齐 830000)
结直肠癌是威胁人类生命安全的消化道恶性肿瘤之一,其发病率位居全球恶性肿瘤的第4位,目前手术、化疗等是结直肠癌的主要治疗手段,但患者对化疗药物产生耐药性是结直肠癌治疗亟待解决的问题,黄芪多糖、鸦胆子苦醇等多种植物提取物可抑制结直肠癌细胞增殖,但关于其作用机制尚未阐明[1-4]。白毛藤属于茄科植物,白毛藤多糖是其主要活性成分,其对肿瘤细胞生长具有抑制作用,其作用机制可能与促进细胞凋亡有关[5]。但白毛藤多糖对结直肠癌细胞生物学行为的影响尚未可知。miR-431在结直肠癌中表达水平降低,并可通过抑制CUL4B而抑制结直肠癌细胞侵袭[6]。但miR-431是否可作用白毛藤多糖治疗结直肠癌的潜在靶点尚未可知。因此,本研究旨在探讨白毛藤多糖对结直肠癌SW620细胞增殖、凋亡的影响及其对miR-431的调控作用。
1 材料与方法
1.1 材料与试剂
白毛藤购自毫州市君源堂药材站;结直肠癌细胞SW620购自上海弗元生物科技有限公司;DMEM培养基、FBS购自美国Gibco;胰蛋白酶购自上海玉博生物科技有限公司;Lipofectamine2000、凋亡检测试剂盒购自北京索莱宝科技有限公司;MTT试剂购自上海晶抗生物工程有限公司;miR-NC、miR-431 mimics、anti-miR-NC、anti-miR-431购自广州市锐博生物科技有限公司;Trizol试剂购自北京全式金生物技术有限公司;逆转录、荧光定量PCR试剂购自美国Thermo Fisher;兔抗人Ki-67(货号:9129T)、Bcl-2(货号:4223S)、Bax(货号:2774S)抗体购自美国CST;二抗(货号:ab150077)购自美国Abcam公司。
1.2 方法
1.2.1 白毛藤多糖制备 白毛藤多糖制备[7]:称取100 g白毛藤粉末,加入95%乙醇浸泡3 h,连续处理2次后采用95%乙醇回流提取2次,1 h/次,收集两次提取液后减压浓缩,经3 000 r/min离心8 min后吸取上清,采用95%乙醇醇沉6次,相同条件下离心后吸取上清,加入等倍体积的三氯乙酸处理后离心取上清,采用氢氧化钠调pH值(pH=7),减压浓缩后加入无水乙醇,多糖析出,采用95%乙醇、丙酮、无水乙醚洗涤后收集沉淀,分别经过抽滤、加水溶解、干燥后获得白毛藤多糖,配置母液浓度为10 g/L,按照实验需求分别稀释至0.4,0.8,1.6 g/L。
1.2.2 实验分组 为探究白毛藤多糖对结直肠癌细胞生物学行为的影响,本研究将SW620细胞培养于含10%FBS、100 U/ml青霉素与100 μg/ml链霉素的DMEM培养基中,分别加入不同浓度(0.4,0.8,1.6 g/L)的白毛藤多糖处理细胞24 h,分别记为白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组。同时将正常培养的SW620细胞记为对照组。
为探究miR-431在结直肠癌发生及发展过程中的作用机制,本研究将miR-NC、miR-431 mimics分别转染入SW620细胞,转染过程按照Lipofecta-mine2000试剂说明书进行操作,分别记为miR-NC组和miR-431组。
同时为探讨miR-431是否可作为白毛藤多糖治疗结直肠癌的潜在靶点,本研究分为:白毛藤多糖+anti-miR-NC组()和白毛藤多糖+anti-miR-431组,分别用anti-miR-NC和anti-miR-431转染SW620细胞后加入含浓度为1.6 g/L白毛藤多糖的培养液培养24 h。
1.2.3 MTT检测细胞增殖 收集“1.2.2”各组SW620细胞(1×105个/ml)接种于96孔板(100 μl/孔),继续培养24 h后每孔分别加入20 μl MTT试剂,将其置于培养箱内继续培养4 h后经3 000 r/min转速离心6 min,弃上清,每孔加入150 μl DMSO,室温孵育10 min后应用酶标仪检测各孔在波长490 nm处的吸光度值(OD值)并计算细胞增殖抑制率[(对照组OD-实验组OD)/(对照组OD-空白组OD)×100%]。
1.2.4 流式细胞术检测细胞凋亡率 收集“1.2.2”各组SW620细胞加入0.25%胰酶消化后收集细胞,加入预冷PBS洗涤后弃上清,将500 μl Binding Buffer加入细胞沉淀中,按照凋亡检测试剂盒说明书及应用流式细胞仪检测细胞凋亡率。
1.2.5 qRT-PCR检测细胞中miR-431的表达水平 采用Trizol法提取“1.2.2”各组SW620细胞总RNA。按照逆转录试剂盒将2 μg RNA反转录为cDNA。cDNA加入DPEC水稀释20倍后进行RT-qPCR反应,扩增体系:SYBR Green Master Mix 10 μl/孔,正反向引物0.8 μl/孔,cDNA 1 μl/孔,ddH2O补足体系至20 μl;反应条件:95 ℃预变性5 min循环1次,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s,共循环40次。miR-431以U6为内参,采用ABI 7500实时荧光定量PCR仪检测miR-431相对表达量。
1.2.6 Western blot检测Ki-67、Bcl-2、Bax蛋白表达 收集“1.2.2”各组SW620细胞加入500 μl RIPA蛋白裂解液提取细胞总蛋白,按照BCA试剂盒检测蛋白浓度,并将上样缓冲液加入蛋白样品中,充分混匀后置于沸水中煮10 min蛋白变性,采用SDS-PAGE电泳分离蛋白,转膜、封闭2 h后加入Ki-67(1 ∶1 000)、Bcl-2(1 ∶1 000)、Bax(1 ∶1 000)一抗与内参GAPDH抗体(1 ∶3 000)稀释液,将其置于4 ℃冰箱内孵育过夜,采用TBST洗涤后加入二抗稀释液(1 ∶5 000),将其置于室温条件下孵育1 h,采用TBST洗涤后滴加ECL,应用自动凝胶成像系统分析各蛋白条带灰度值。
1.3 统计学处理
2 结果
2.1 白毛藤多糖对结直肠癌SW620细胞增殖的影响
与对照组比较,白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组细胞增殖抑制率升高(P<0.05),Ki-67蛋白水平降低(P<0.05),且白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组细胞增殖抑制率、Ki-67蛋白水平比较差异有统计学意义(P<0.05,见表1、图1)。
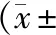
表1 白毛藤多糖对结直肠癌SW620细胞增殖的影响s,n=9)Table 1 Effect of solanum lyratum polysaccharide on the proliferation of colorectal cancer SW620
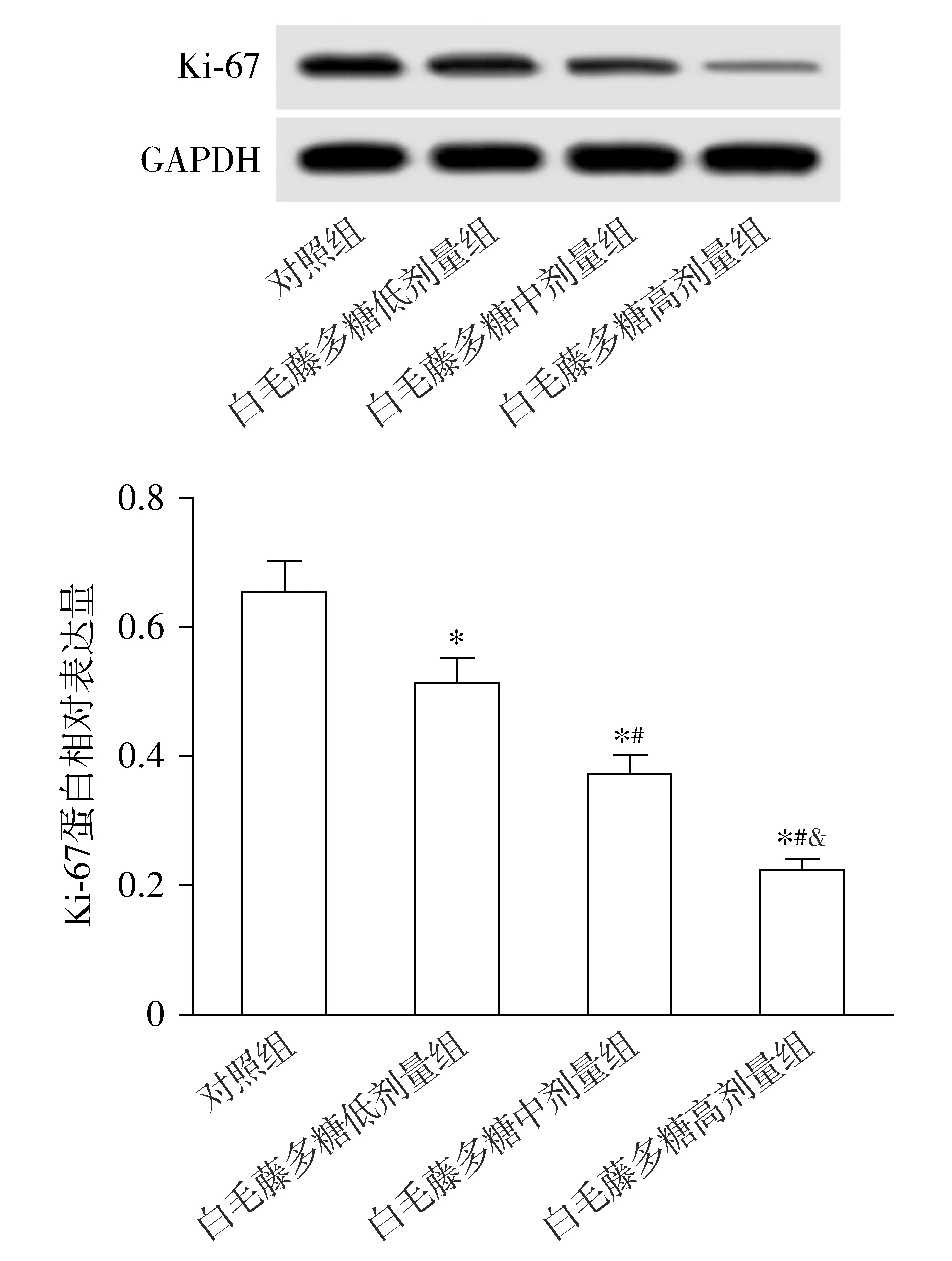
与对照组比较,*P<0.05;与白毛藤多糖低剂量组比较,#P<0.05;与白毛藤多糖低中量组比较,&P<0.05图1 白毛藤多糖对结直肠癌SW620细胞Ki-67蛋白表达的影响Figure 1 Effect of solanum lyratum polysaccharide on the expression of Ki-67 protein in colorectal cancer SW620 cells
2.2 白毛藤多糖对结直肠癌SW620细胞凋亡的影响
与对照组比较,白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组细胞凋亡率升高(P<0.05),Bcl-2蛋白水平降低(P<0.05),Bax蛋白水平升高(P<0.05),且白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组上述指标比较差异有统计学意义(P<0.05,见图2)。
2.3 白毛藤多糖对结直肠癌SW620细胞中miR-431表达的影响
与对照组比较,白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组miR-431的表达水平升高(P<0.05),且白毛藤多糖低剂量组、白毛藤多糖中剂量组、白毛藤多糖高剂量组间miR-431的表达水平比较差异有统计学意义(P<0.05,见图3)。

与对照组比较,*P<0.05;与白毛藤多糖低剂量组比较,#P<0.05;与白毛藤多糖低中量组比较,&P<0.05图2 白毛藤多糖对结直肠癌SW620细胞凋亡的影响Figure 2 The effect of solanum lyratum polysaccharide on cell apoptosis of colorectal cancer SW620 cells
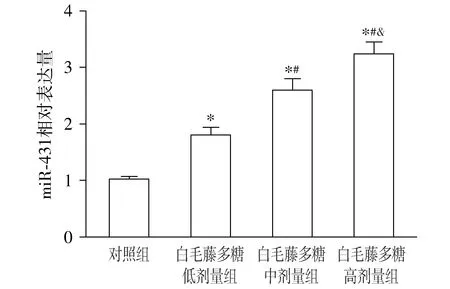
与对照组比较,*P<0.05;与白毛藤多糖低剂量组比较,#P<0.05;与白毛藤多糖低中量组比较,&P<0.05图3 白毛藤多糖对结直肠癌SW620细胞中miR-431表达的影响Figure 3 Effect of solanum lyratum polysaccharide on the expression of miR-431 in colorectal cancer SW620 cells
2.4 miR-431过表达对结直肠癌SW620细胞增殖和凋亡的影响
与miR-NC组比较,miR-431组细胞增殖抑制率与细胞凋亡率升高(P<0.05),Ki-67、Bcl-2蛋白水平降低(P<0.05),Bax蛋白水平升高(P<0.05,见图4、表2)。
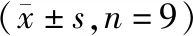
表2 miR-431过表达对结直肠癌SW620细胞增殖和凋亡的影响Table 2 Effect of miR-431 overexpression on the proliferation and apoptosis of colorectal cancer SW620
2.5 干扰miR-431表达联合白毛藤多糖(1.6 g/L)对结直肠癌SW620细胞增殖和凋亡的影响
与白毛藤多糖+anti-miR-NC组比较,白毛藤多糖+anti-miR-431组细胞增殖抑制率和细胞凋亡率降低(P<0.05),Ki-67、Bcl-2蛋白水平升高(P<0.05),Bax蛋白水平降低(P<0.05,见表3、图5)。
与miR-NC组比较,*P<0.05图4 miR-431过表达对结直肠癌SW620细胞增殖和凋亡的影响Figure 4 Effect of miR-431 overexpression on proliferation and apoptosis of colorectal cancer SW620 cells
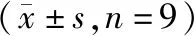
表3 干扰miR-431表达联合白毛藤多糖对结直肠癌SW620细胞增殖和凋亡的影响Table 3 Effects of interference of miR-431 expression combined with solanum lyratum polysaccharide on proliferation and apoptosis of colorectal cancer SW620
3 讨论
植物提取物的活性成分包括多糖、黄酮等,具有抗肿瘤等作用,其作用机制与多途径、多靶点密切相关,芍药苷通过抑制FoxM1抑制结直肠癌细胞生长并诱导细胞周期停滞[8]。丹参酮ⅡA通过激活JNK-Mff信号通路促进线粒体裂变,从而降低结直肠癌细胞生长[9]。醉茄素A通过ROS依赖的线粒体功能障碍诱导结直肠癌细胞凋亡[10]。但白毛藤多糖对结直肠癌的治疗效果及其可能作用机制尚未可知。
白毛藤多糖可抑制宫颈癌细胞增殖及诱导细胞周期阻滞[11]。白毛藤多糖可促进乳腺癌细胞凋亡,其作用机制与激活Fas及抑制Bcl-2基因表达有关[12]。本研究结果显示,不同剂量的白毛藤多糖处理后结直肠癌细胞增殖抑制率升高,且随着药物剂量的增加而明显升高。研究表明Ki-67表达异常与细胞周期密切相关,抑制其表达可诱导细胞周期阻滞,抑制细胞增殖[13,14]。本研究结果显示,不同剂量的白毛藤多糖可明显降低结直肠癌细胞中Ki-67的表达水平,且随着药物浓度的增加而明显降低,提示白毛藤多糖可抑制结直肠癌细胞增殖,且呈剂量依赖性。Bcl-2表达上调可抑制Bax表达从而抑制细胞凋亡,Bax表达上调可激活线粒体途径而激活caspase级联反应从而诱导细胞凋亡[15]。本研究结果显示,不同剂量的白毛藤多糖可明显提高结直肠癌细胞凋亡率,并抑制Bcl-2的表达及促进Bax的表达,且随着药物浓度的增加而明显变化,提示白毛藤多糖可促进结直肠癌细胞凋亡,且呈剂量依赖性。但白毛藤多糖调控结直肠癌细胞增殖及凋亡的作用机制尚未阐明。
与白毛藤多糖+anti-miR-NC组比较,*P<0.05图5 干扰miR-431表达联合白毛藤多糖对结直肠癌SW620细胞增殖和凋亡的影响Figure 5 Effects of interference of miR-431 expression combined with solanum lyratum polysaccharide on proliferation and apoptosis of colorectal cancer SW620 cells
本研究检测结果显示,不同剂量的白毛藤多糖可明显提高结直肠癌细胞中miR-431的表达水平,且随着药物剂量的增加而明显升高,提示白毛藤多糖可能通过上调miR-431的表达从而发挥作用。miR-431通过下调DDX5抑制肺癌的增殖和转移[16]。miR-431通过靶向CDK14抑制胰腺癌细胞增殖并诱导细胞凋亡[17]。circ-0001742通过miR-431-5p/ATF3轴促进舌鳞状细胞癌的进展[18]。本研究结果显示,miR-431过表达可明显提高结直肠癌细胞增殖抑制率与细胞凋亡率,提示miR-431过表达可抑制结直肠癌细胞增殖及促进细胞凋亡。同时本研究将干扰miR-431表达联合白毛藤多糖处理结直肠癌细胞,结果显示,细胞增殖抑制率与细胞凋亡率降低,提示干扰miR-431表达可明显降低白毛藤多糖对结直肠癌细胞增殖及凋亡的作用。
综上所述,白毛藤多糖可通过上调miR-431的表达而抑制结直肠癌细胞增殖及促进细胞凋亡,miR-431可能作为白毛藤多糖治疗结直肠癌的靶点之一,可为进一步揭示白毛藤多糖治疗结直肠癌的分子机制奠定实验基础,还可为结直肠癌的治疗提供新方向。
