骨髓间充质干细胞通过抑制破骨细胞相关因子改善膝关节骨性关节炎
2021-12-17李克文扎西达娃张斌斌季健坤赵宏涛杨森林
冯 唱,李克文,扎西达娃,张斌斌,季健坤,赵宏涛,陆 川,杨森林
(青海大学附属医院关节外科,西宁 810000;*通讯作者,E-mail:QDFYkwl@126.com)
膝关节骨性关节炎(knee osteoarthritis,KOA)是膝关节软骨的变性、破坏及关节周围骨质增生为特征的慢性关节病,高达10%的60岁以上的人患有KOA,由于关节软骨自我修复能力有限和人口老龄化,KOA在许多国家的发病率呈上升趋势[1]。其特征是由于细胞外基质的丧失、广泛的纤维化和裂隙的形成而导致的关节软骨退变,最终导致软骨表面的完全丧失[2]。虽然一些药物如非甾体抗炎药(NSAIDs)和细胞外基质成分透明质酸可以通过改变软骨下骨和滑膜来缓解KOA的症状,但由于KOA的复杂病理和慢性性质,目前还没有有效的治疗方法,且许多KOA患者在疾病后期需要关节置换治疗,但假体的寿命是有限的[3]。因此寻找积极的KOA治疗方法非常必要。骨髓间充质干细胞(bone marrow-derived mesenchymal stem cells,BMSCs)是一种来源于骨髓的间充质干细胞,作为具有多向分化潜能的干细胞,BMSCs可以分化为不同类型的组织,包括软骨和骨骼,此外,BMSCs还可以进行自我更新并产生免疫调节反应[4,5]。因此,BMSCs在软骨损伤和关节疾病的治疗中得到了积极的应用。尽管BMSCs已经用于治疗关节炎,但BMSCs治疗KOA的具体机制尚不清楚,有研究者怀疑BMSCs通过分泌一系列免疫因子和细胞因子发挥作用,进而发挥免疫调节和抗炎作用[6]。此外,在低氧环境培养MSCs期间,细胞表现出一套独特的分化、增殖和衰老特性[7]。基于此,本研究拟通过建立KOA动物模型,将BMSCs在缺氧条件下共培养,研究BMSCs预处理对KOA的治疗作用并初步探讨其机制。
1 材料与方法
1.1 实验动物
SPF级SD大鼠40只,体质量160-180 g,购自四川大学华西医院,使用许可证号:SYXK(川)2018-119,饲养于恒温20-25 ℃、恒湿(50%±5%)环境中,自然采光,自由饮水。大鼠适应性饲养1周后,其中32只随机分为4组:空白组、模型组、甲氨蝶呤组和骨髓间充质干细胞组(BMSCs组),每组8只,剩余8只大鼠用于骨髓间充质干细胞的分离。
1.2 主要试剂及仪器
L-DMEM培养基、胰蛋白酶购自美国Gibco;木瓜蛋白酶(S10011;CAS:9001-73-4)购自上海源叶生物科技有限公司;苏木素染液(批号:ZH193907)购自武汉赛维尔生物技术有限公司;伊红染液(批号:C200403)购自珠海贝索生物技术有限公司;核因子κB受体活化因子配基(RANKL,货号:ZC-36698)、骨保护素(OPG,货号:ZC-36651)、CXC趋化因子配体10(CXCL10,货号:ZC-M6646)ELISA试剂盒购自上海茁彩生物科技有限公司;RNA Trizol Reagent(批号vs18061730)购自合肥博美生物科技有限责任公司;TB Green TM Premix Ex TaqTM Ⅱ(Tli RNaseH Plus)(货号RR820A)购自北京宝日医生物技术有限公司;抗RANKL(货号:ab239607)、OPG(货号:ab73400)、TRAF6(货号:ab33915)、CXCL10(货号:ab214668)、CXCR3(货号:ab71864)抗体购自英国Abcam;BCA蛋白浓度测定试剂盒(货号:P0009)购自上海碧云天生物技术有限公司;BMJ-A型包埋机(常州郊区中威电子仪器厂);BA210Digital数码三目摄像显微镜(麦克奥迪实业集团);SpectraMAX Plus384酶标仪(美谷分子仪器有限公司);PIKORed 96实时荧光定量(RT-PCR)仪(美国ThermoFisher仪器有限公司)。
1.3 骨髓间充质干细胞的分离和鉴定
取剩余10只大鼠,1%戊巴比妥钠(35 mg/kg)腹腔注射麻醉,75%乙醇全身浸泡消毒10 min,在无菌条件下分离股骨和胫骨,用添加青/链霉素的L-DMEM培养基冲出骨髓,然后制成单细胞悬液,1 000 r/min离心5 min后弃去上清液,重悬以1×109/L的细胞浓度接种于25 cm2培养瓶中,置37 ℃、CO2饱和湿度培养箱中培养,每3 d更换1次新鲜培养基,待细胞密度长至70%-80%融合时,用0.25%胰酶消化,1 ∶2的比例进行传代培养,1% O2浓度条件低氧培养。培养后采用倒置相差显微镜观察细胞形态变化及生长状况并拍照。采用流式细胞仪检测细胞表面标记(CD29、CD34、CD105、CD45)鉴定MSCs,具体步骤:收集培养后的细胞于1 000 r/min,4 ℃离心5 min,各管依次加入单克隆抗体CD29、CD34、CD105、CD45(稀释度均1 ∶200),避光冰上孵育45 min,用500 μl PBS(含1%BSA)重悬细胞,流式细胞仪进行检测分析。
1.4 膝关节骨性关节炎大鼠模型构建
除空白组外,其余三组均采用木瓜蛋白酶关节腔注射建立膝关节骨性关节炎大鼠模型[8]。用0.9%氯化钠溶液配4%(W/V)木瓜蛋白酶溶液,用1%戊巴比妥钠(35 mg/kg)腹腔注射麻醉大鼠,然后双膝关节备皮、消毒、屈曲约45°,从髌骨下缘前内侧的膝眼向髁间窝方向进针,明显有落空感后,针尖抵达股骨内侧髁再回撤2 mm,并注射木瓜蛋白酶,分别向双侧膝关节腔注入4%木瓜蛋白酶0.2 ml。每隔3 d注射1次,连续注射3次(即第1天、第4天、第7天注射)。注射后1周,观察各组大鼠膝关节外观,并在各组各取1只大鼠处死后,取关节软骨行组织病理切片,验证造模是否成功。
1.5 治疗方法
造模成功后第2天,空白组和模型组大鼠膝关节腔注射生理盐水0.3 ml,每周1次,共4次;甲氨蝶呤组大鼠腹腔注射0.5 mg/kg甲氨蝶呤,每周1次,共4次;骨髓间充质干细胞组大鼠膝关节腔内一次性注射骨髓间充质干细胞0.3 ml(细胞浓度为1×108/L),同时每周1次膝关节腔内注射生理盐水0.3 ml,共4次。治疗结束后,进行大鼠关节指数(AI)评分[9]:0分,无肿胀或红斑;1分,轻度肿胀或红斑;2分,中度肿胀;3分,重度肿胀;4分,关节僵硬或畸形,评分之和作为最终的AI评分。然后处死大鼠,采集软骨和血清样本进行进一步分析。
1.6 指标检测
1.6.1 HE染色观察软骨组织病理学变化 分离膝关节软骨组织,经10%多聚甲醛固定,将固定的软骨组织,经脱钙、水合、透明、石蜡包埋后切片,切片厚度5 μm,采用HE染色,梯度酒精脱水,中性树胶封固,镜检观察膝关节软骨组织病理学变化。
1.6.2 酶联免疫吸附(ELISA)法检测血清RANKL、OPG、CXCL10含量 采用ELISA法检测各组大鼠血清RANKL、OPG、CXCL10含量,根据ELISA试剂盒说明步骤严格操作。
1.6.3 实时荧光定量PCR(qRT-PCR)检测软骨组织RANKL、OPG、TRAF6、CXCL10、CXCR3 mRNA表达 采用RNA提取试剂盒提取软骨组织总RNA。将总RNA加入逆转录反应体系(10 μl),根据制造商说明书用特异性RT引物逆转录为cDNA。进行qRT-PCR分析,以β-actin作为内参,引物序列见表1。qRT-PCR反应条件:95 ℃初始变性10 min,随后95 ℃变性10 s,60 ℃退火10 s,72 ℃延伸10 s,45个循环,记录Ct值,采用2-ΔΔCt分析相对表达水平。

表1 RANKL、OPG、TRAF6、CXCL10、CXCR3基因引物序列Table 1 Primer sequences of RANKL, OPG, TRAF6, CXCL10 and CXCR3 genes
1.6.4 蛋白印迹法(Western blot)检测软骨组织RANKL、OPG、TRAF6、CXCL10、CXCR3蛋白表达 取软骨组织,RIPA裂解缓冲液提取总蛋白,BCA蛋白定量试剂盒测定蛋白浓度,样品煮沸变性后于-20 ℃保存备用。使用等量蛋白质上样,经10% SDS-PAGE分离后,置于聚偏氟乙烯膜上,在5%脱脂牛奶中封闭1 h后,与RANKL、OPG、TRAF6、CXCL10、CXCR3(稀释度均1 ∶500)一抗结合,于4 ℃孵育过夜,然后选择合适的二抗在室温孵育1 h,ECL暗室显色。以β-actin表达作为内参,用Image-Pro Plus6.0软件分析各条带的光密度值,并用样品光密度值与β-actin光密度值的比值进行分析。
1.7 统计分析
2 结果
2.1 骨髓间充质干细胞的鉴定
细胞形态观察显示细胞排列紧密,逐渐融合成片,且细胞形态均一,呈梭形生长,生长旺盛(见图1)。流式细胞仪检测结果显示,培养后的BMSCs均表达CD29、CD34、CD45、CD105(见图1)。表明BMSCs具有较强的分裂增殖能力。
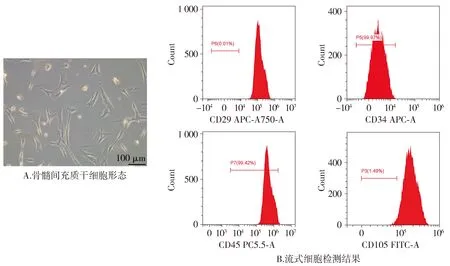
图1 骨髓间充质干细胞的鉴定Figure 1 Identification of bone marrow mesenchymal stem cells
2.2 骨髓间充质干细胞对KOA大鼠关节指数的影响
与空白组比较,模型组大鼠AI评分明显升高(P<0.01);与模型组比较,甲氨蝶呤组和骨髓间充质干细胞组均能明显降低大鼠AI评分(P<0.05,见图2)。

与空白组比较,**P<0.01;与模型组比较,#P<0.05图2 各组大鼠AI评分比较Figure 2 Comparison of AI scores of rats in each group
2.3 骨髓间充质干细胞对KOA大鼠组织病理学的影响
空白组关节软骨结构完整,未见明显软骨缺损、软骨细胞坏死及纤维增生等病理改变。模型组关节软骨侵蚀,软骨面不平整,表层缺失,表面纤维组织增生和新生毛细血管形成,软骨细胞数量显著增多,软骨细胞成簇,排列不规律,大量软骨细胞坏死。甲氨蝶呤组关节软骨侵蚀,软骨面不平整,表层缺失,表面大量纤维组织增生,且见较多胶原纤维,软骨细胞数量增多,排列紊乱,部分软骨细胞坏死。骨髓间充质干细胞组关节软骨损伤,软骨面不平整,软骨基质着色变淡,软骨细胞数量显著增多,排列紊乱,软骨细胞成簇,较多新生软骨细胞,嗜酸性增强(见图3)。
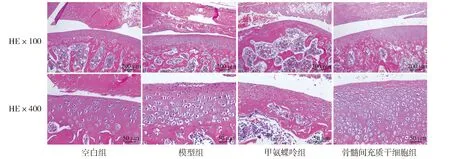
图3 骨髓间充质干细胞对KOA大鼠组织病理学的影响Figure 3 Effect of bone marrow mesenchymal stem cells on histopathology of knee osteoarthritis rats
2.4 骨髓间充质干细胞对KOA大鼠RANKL、OPG和CXCL10水平的影响
与空白组比较,模型组大鼠血清RANKL、OPG、CXCL10含量均明显增加(P<0.01);与模型组比较,甲氨蝶呤组OPG、CXCL10含量明显降低,骨髓间充质干细胞组RANKL、OPG、CXCL10含量明显降低(P<0.05,见表2)。

表2 各组大鼠血清RANKL、OPG、CXCL10含量 (pg/ml)Table 2 Serum RANKL, OPG and CXCL10 levels of rats in each group (pg/ml)
2.5 骨髓间充质干细胞对KOA大鼠RANKL/OPG/TRAF6信号的影响
与空白组比较,模型组大鼠软骨组织RANKL、OPG、TRAF6、CXCL10、CXCR3 mRNA和蛋白表达明显升高(P<0.01);与模型组比较,骨髓间充质干细胞组RANKL、OPG、TRAF6、CXCL10、CXCR3 mRNA和蛋白表达明显降低(P<0.05,见图4)。

与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01图4 各组大鼠软骨组织RANKL/OPG/TRAF6相关因子表达Figure 4 Expression of RANKL/OPG/TRAF6 related factors in cartilage tissues of rats in each group
3 讨论
KOA是一种导致疼痛、软骨变形和关节炎症的退行性关节疾病,其临床特征为关节剧烈疼痛,也是导致残疾的主要原因之一[10]。研究表明BMSCs有潜力作为再生细胞治疗关节炎[11]。然而BMSCs治疗KOA的具体机制尚仍有待进一步研究。甲氨蝶呤已被报道是关节炎的首选药物,在关节炎中具有确切的治疗疗效,由此,本研究选用甲氨蝶呤作为阳性药物对照,拟建立KOA动物模型,将BMSCs在缺氧条件下共培养,研究BMSCs预处理对KOA的治疗作用并初步探讨其机制。
近年来,研究显示间充质干细胞在减缓骨关节炎中具有重要作用,间充质干细胞直接在关节内注射是临床应用最简单的方法[12]。在骨关节炎的山羊模型中注射自体BMSCs显示骨关节炎内侧半月板的明显再生[13]。在胶原蛋白酶诱导的骨关节炎模型中早期注射自体脂肪衍生的间充质干细胞可以抑制滑膜增厚和软骨破坏[14]。而自体MSCs单次关节内植入6个月可显著缓解骨关节炎患者临床相关疼痛[15]。此外,研究显示关节内注射骨髓来源的间充质干细胞可获得更好的临床结果[16]。这些结果提示间充质干细胞具有减缓骨关节炎的作用。另研究发现,体内移植缺氧预处理的hBM-MSCs可促进无菌小鼠软骨细胞的增殖并产生软骨样组织[17]。含1% O2的精氨酸-天冬氨酸-海藻酸钠水凝胶中培养的细胞可促进成骨和血管生成反应,2%的O2可提高干细胞的增殖和成骨分化水平,提示低氧预处理是促进骨愈合的有效治疗方法[18,19]。在免疫缺陷小鼠中,hBM-MSCs在1%的O2中预处理后植入到由羟基磷灰石和磷酸三钙组成的支架上,可促进可溶性和不溶性胶原的合成,从而产生稳定的细胞外基质,进而促进骨再生[20]。在本研究中,我们发现KOA模型大鼠AI评分较空白组明显升高,且关节软骨侵蚀,软骨细胞数量显著增多,大量软骨细胞坏死;甲氨蝶呤和BMSCs低氧预处理可明显降低大鼠AI评分,且BMSCs低氧预处理可明显改善KOA软骨组织病理学变化,结果表明BMSCs低氧预处理对KOA软骨组织病变具有延缓作用。
此外,骨重建受局部和全身破骨细胞分化和激活的刺激,由核因子κB激活剂受体(RANK)、核因子κB受体激活剂配体(RANKL)、骨保护素(OPG)组成的分子系统对于调节破骨细胞功能的不同特征至关重要,包括增殖、分化、融合、激活和凋亡[21]。RANKL被认为通过一系列的酶级联反应启动破骨细胞前体的唯一受体RANK,从而启动破骨细胞的分化和活化[22]。OPG可充当RANKL的诱饵受体,通过与RANKL结合来抑制骨吸收,并阻止它与其受体RANKL相互作用[23]。研究表明大剂量的RANKL和巨噬细胞集落刺激因子(M-CSF)培养的MSCs可以通过分泌OPG来抑制破骨细胞的分化和活性,RANKL可以改变MSCs的功能,从而抑制破骨细胞的形成[24]。然而,BMSCs低氧预处理对KOA大鼠破骨细胞功能的直接作用尚不确定,在本研究,我们发现BMSCs低氧预处理明显抑制了模型大鼠RANKL、OPG、CXCL10含量。提示BMSCs低氧预处理可能抑制破骨细胞形成。TRAF6是一种重要的接头分子,参与RANKL/RANK、TLR、IL-1βR等经典途径的下游,是激活NF-κB途径促进促炎细胞因子和破骨细胞相关因子释放的关键因子[25]。此外,低氧可影响牙周韧带细胞RANKL和OPG表达,是牙槽骨吸收的重要致病事件[26]。本研究进一步发现BMSCs低氧预处理可明显降低KOA大鼠RANKL、OPG、TRAF6、CXCL10、CXCR3 mRNA和蛋白表达。提示BMSCs低氧预处理可能调控RANKL/OPG/TRAF6信号通路,在关节软骨的维持中发挥重要作用。
综上所述,骨髓间充质干细胞低氧预处理可能通过RANKL/OPG/TRAF6信号通路来减缓膝关节骨性关节炎的进展,进一步完善低氧预处理BMSCs的研究可能会促进BMSCs在骨关节炎潜在的临床应用。
