LncRNA PCAT1靶向miR-329-3p调控舌鳞状细胞癌细胞增殖、迁移侵袭和谷氨酰胺分解的机制研究
2021-12-13玮宗佩君许婷婷
刘 玮宗佩君许婷婷*
(1.潍坊护理职业学院病理教研室,山东 潍坊 262500;2.山东省潍坊市益都中心医院病理科,山东 潍坊 262500)
舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)是口腔最常见的恶性肿瘤之一,占口腔肿瘤的90%以上。它对人类的生命和健康构成了严重的威胁。尽管在治疗方面取得了许多进展,包括根治性手术、放疗和新辅助化疗,但TSCC仍与不良预后相关。由于局部侵袭性强、淋巴结转移率高,患者5年生存率仅为50%左右[1]。因此,探讨肿瘤的作用机制、寻找更有效的治疗策略非常重要。长链非编码RNA(long non-coding RNA,LncRNA)是一种近期发现的在肿瘤中具有重要调控作用因子[2]。前列腺癌相关转录物1(prostate cancer-associated transcript 1,PCAT1)是其中之一,这是近2年新发现的一种LncRNA。顾名思义,PCAT1是首先在前列腺癌中发现的,其在喉癌、子宫内膜癌中均发挥促进癌症恶化作用[3-5]。但PCAT1在舌鳞状细胞癌中的表达及其可能作用机制尚未可知,本研究旨在探究PCAT1在TSCC中的功能机制。
1 材料和方法
1.1 实验材料
1.1.1 细胞
人正常口腔角质细胞NHOK、人舌鳞状细胞癌细胞UM1、CAL-27、SCC25均购自美国模式培养物保存所。
1.1.2 材料
35例TSCC组织及匹配的癌旁组织来自本医院2018年2月~2020年6月期间接受TSCC手术切除的患者。患者或其家属均签署知情同意书。
1.2 主要试剂与仪器
人谷氨酸盐(glutamate)ELISA检测试剂盒购自上海卡努生物科技有限公司;α-酮戊二酸(αketoglutarate,α-KG)检测试剂盒购自Abcam;细胞计数试剂盒(cell counting kit,CCK-8)购自日本同仁化学研究中心;实时荧光定量反转录聚合酶链反应试剂盒(Real-time fluorescence quantitative reverse transcription polymerase chain reaction,qRT-PCR)购自日本TaKaRa;双荧光素酶报告基因检测试剂盒购自上海碧云天生物研究所;实验中的质粒、DNA和引物均由深圳默赛尔生物医学发展公司设计合成。
1.3 方法
1.3.1 细胞培养
NHOK、UM1、CAL-27、SCC25细胞的培养所使用的培养液均为DMEM培养基(含有15%胎牛血清+1%青链霉素混合液)。培养条件为:37℃、5%CO2、饱和湿度的恒温培养箱中常规培养、传代。
1.3.2 分组
将收集的TSCC组织标记为癌组织组,癌旁组织标记为癌旁组织组;将正常培养的NHOK、UM1、CAL-27、SCC25细胞分别标记为NHOK组、UM1组、CAL-27组、SCC25组;用3倍质粒或DNA量的脂质体将质粒或DNA转染至UM1细胞,具体为香江脂质体和质粒或DNA混合,再将混合液与UM1细胞共培养8 h,添加培养液继续培养至48 h,再用qRTPCR检测转染的效率。各组细胞所转染的质粒或DNA为pcDNA组(转染pcDNA)、pcDNA-PCAT1组(转染pcDNA-PCAT1)、miR-NC组(转染miR-NC)、miR-329-3p组(转染miR-329-3p mimics)、pcDNAPCAT1+miR-NC组(共转染pcDNA-PCAT1和miRNC)、pcDNA-PCAT1+miR-329-3p组(共 转 染pcDNA-PCAT1和miR-329-3p mimics)。
1.3.3 qRT-PCR检测PCAT1、miR-329-3p表达
将需要检测的细胞提取总RNA,并反转录为cDNA,作为模板放置在-20℃保存备用。用qRTPCR试剂盒检测模板中PCAT1、miR-329-3p表达。结果以GAPDH、U6为内参,2-ΔΔCT法计算PCAT1、miR-329-3p的相对表达水平。PCAT1,上游引物5’-TGAGAAGAGAAATCTATTGGAACC-3’,下游引物5’-GGTTTGTCTCCGCTGCTTTa-3’;GAPDH,上游引物5’-ATGGGGAAGGTGAAGGTCG-3’,下游引物5’-GGGGTCATTGATGGCAACAATa-3’;miR-329-3p上游引物5’-GGGAACACACCTGGTTAAC-3’,下游引物5’-CAGTGCGTGTCGTGGAGT-3’;U6上游引物5’-GCTTCGGCAGCACATATACTAAAAT-3’,下游引物5’-CGCTTCACGAATTTGCGTGTCAT-3’。
1.3.4 CCK-8实验检测细胞增殖率
将需要检测的细胞调整至每毫升105个,取其中100 μL置于24孔板,按照CCK-8试剂盒要求操作添加反应液,在490 nm波长下检测细胞吸光值(A)。细胞增殖率为A实验组/A对照组×100%。
1.3.5 Transwell实验检测细胞迁移侵袭
将需要检测的细胞先用不含血清培养液培养12 h,调整至每毫升5×104个。取100 μL细胞浸润小室上表面的膜,再去600 μL含血清的培养液置于下室,将小室移至37℃培养箱中培养12 h。结束后去除残余的细胞,将膜进行固定和染色,并将膜的上表面朝上封片。用显微镜进行镜检,观察细胞的数量,计数,取平均数。
1.3.6 ELISA实验检测谷氨酸盐、α-KG水平
收集需要检测的细胞上清液,按人谷氨酸盐(glutamate)ELISA检测试剂盒、α-酮戊二酸(α-KG)检测试剂盒要求操作,测定其中谷氨酸盐、α-KG的水平。结果以相对应的对照组水平为单位1,计算检测组细胞上清中谷氨酸盐、α-KG的水平。
1.3.7 生物信息学预测
使用生物信息学在线预测网站starbase(http://starbase.sysu.edu.cn)分析PCAT1与miR-329-3p之间是否存在结合位点。
1.3.8 双荧光素酶报告实验验证PCAT1靶向miR-329-3p
根据预测到的PCAT1结合位点用化学合成野生型PCAT1基因片段(含有结合位点)和突变型PCAT1基因片段(不含结合位点),并将其克隆至荧光载体psiCHECK2构建荧光素酶报告基因,并提取质粒。用脂质体将其与miR-NC、miR-329-3p共转染至UM1。用双荧光素酶报告实验试剂盒检测细胞中萤火虫、海肾的荧光活性,结果以萤火虫荧光活性与海肾荧光活性之比表示PCAT1与miR-329-3p之间结合。
1.4 统计学方法
2 结果
2.1 PCAT1、miR-329-3p在TSCC中的表达
与癌旁组织组相比,癌组织组PCAT1表达明显上调,miR-329-3p表达明显下调(P<0.05);与NHOK组相比,UM1、CAL-27、SCC25细胞中PCAT1表达均上调,miR-329-3p表达均下调(P<0.05),其中UM1细胞中PCAT1的表达水平相对较高,因而选用UM1细胞进行后续研究(表1、表2)。
表1 TSCC组织中PCAT1、miR-329-3p的表达(±s,n=35)Table 1 Expression of PCAT1 and miR-329-3p in TSCC

表1 TSCC组织中PCAT1、miR-329-3p的表达(±s,n=35)Table 1 Expression of PCAT1 and miR-329-3p in TSCC
注:与癌旁组织组相比,*P<0.05。Note.Compared with the adjacent tissue group,*P<0.05.
?
表2 TSCC细胞中PCAT1、miR-329-3p的表达(±s,n=9)Table 2 Expression of PCAT1 and miR-329-3p in TSCC cells
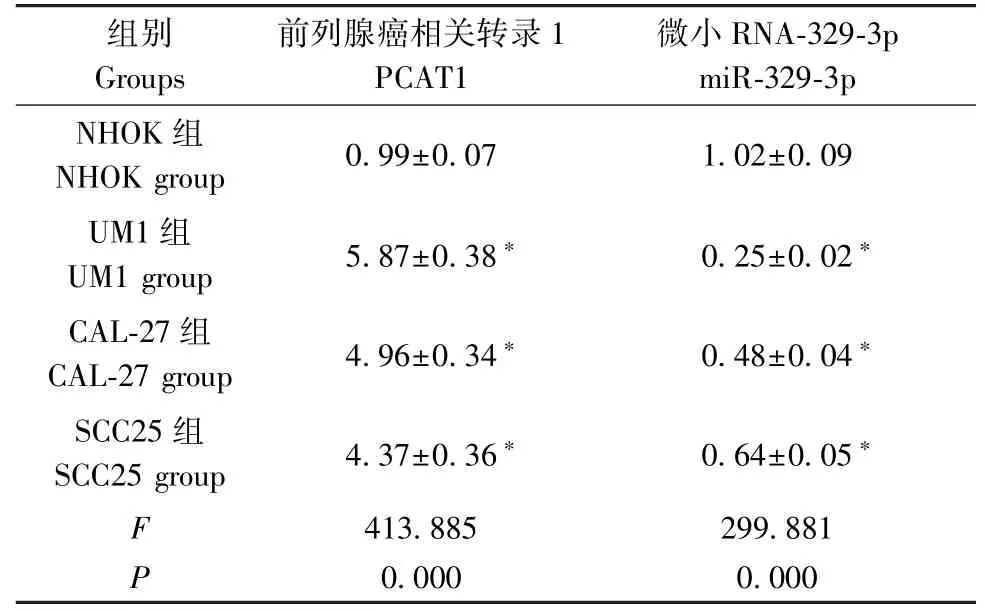
表2 TSCC细胞中PCAT1、miR-329-3p的表达(±s,n=9)Table 2 Expression of PCAT1 and miR-329-3p in TSCC cells
注:与NHOK组相比,*P<0.05。Note.Compared with the NHOK group,*P<0.05.
?
2.2 PCAT1对TSCC细胞增殖、迁移侵袭和谷氨酰胺分解的影响
与pcDNA组相比,pcDNA-PCAT1组PCAT1表达明显上升,细胞增殖率、细胞侵袭数和细胞侵袭数均发生上调,谷氨酸盐水平和α-KG水平也发生明显升高(P<0.05,表3)。
表3 过表达PCAT1的TSCC细胞增殖、迁移侵袭和谷氨酰胺分解情况(±s,n=9)Table 3 Proliferation,migration,invasion and glutamine decomposition of TSCC cells overexpressing PCAT1

表3 过表达PCAT1的TSCC细胞增殖、迁移侵袭和谷氨酰胺分解情况(±s,n=9)Table 3 Proliferation,migration,invasion and glutamine decomposition of TSCC cells overexpressing PCAT1
注:与pcDNA组相比,*P<0.05。Note.Compared with pcDNA group,*P<0.05.
?
2.3 PCAT1靶向miR-329-3p
通过生物信息学在线预测网站starbase(http://starbase.sysu.edu.cn)预测到PCAT1与miR-329-3p之间存在互补的结合位点(图1)。与miR-NC组相比,miR-329-3p组WT-PCAT1细胞的荧光活性明显降低,miR-329-3p组UM1细胞PCAT1表达显著降低(P<0.05)(表4、图2)。
表4 双荧光素酶报告基因实验结果及miR-329-3p的表达(±s,n=9)Table 4 Experimental results of dual luciferase reporter gene and expression of miR-329-3p

表4 双荧光素酶报告基因实验结果及miR-329-3p的表达(±s,n=9)Table 4 Experimental results of dual luciferase reporter gene and expression of miR-329-3p
注:与miR-NC组相比,*P<0.05。Note.Compared with miR-NC group,*P<0.05.
?

图1 PCAT1与miR-329-3p之间的互补核苷酸序列Figure 1 Complementary nucleotide sequence between PCAT1 and miR-329-3p

图2 荧光素酶报告实验检测荧光活性Figure 2 Luciferase reporter assay was used to detect the fluorescence activity
2.4 miR-329-3p对TSCC细胞增殖、迁移侵袭和谷氨酰胺分解的影响
与miR-NC组相比,miR-329-3p组TSCC细胞miR-329-3p表达显著升高,细胞增殖率、细胞迁移数和细胞侵袭数均显著降低,谷氨酸盐水平和α-KG水平均明显降低(P<0.05,表5)。
表5 过表达miR-329-3p对TSCC细胞增殖、迁移侵袭和谷氨酰胺分解的影响(±s,n=9)Table 5 Effects of overexpression of miR-329-3p on TSCC cell proliferation,migration,invasion and glutamine breakdown

表5 过表达miR-329-3p对TSCC细胞增殖、迁移侵袭和谷氨酰胺分解的影响(±s,n=9)Table 5 Effects of overexpression of miR-329-3p on TSCC cell proliferation,migration,invasion and glutamine breakdown
注:与miR-NC组相比,*P<0.05。Note.Compared with miR-NC group,*P<0.05.
?
2.5 miR-329-3p对PCAT1在TSCC细胞调控作用的回复
与pcDNA-PCAT1+miR-NC组比,pcDNA-PCAT1+miR-329-3p组PCAT1表达显著降低,细胞增殖率。迁移细胞数和侵袭细胞数均明显降低,谷氨酸盐水平和α-KG水平也显著下调(P<0.05,表6)。
表6 miR-329-3p对PCAT1在TSCC细胞增殖、迁移侵袭和谷氨酰胺分解作用的影响(±s,n=9)Table 6 Effects of miR-329-3p on the proliferation,migration,invasion and glutamine breakdown of PCAT1 in TSCC cells

表6 miR-329-3p对PCAT1在TSCC细胞增殖、迁移侵袭和谷氨酰胺分解作用的影响(±s,n=9)Table 6 Effects of miR-329-3p on the proliferation,migration,invasion and glutamine breakdown of PCAT1 in TSCC cells
注:与pcDNA-PCAT1+miR-NC组相比,*P<0.05。Note.Compared with pcDNA-PCAT1+miR-NC group,*P<0.05.
?
3 讨论
PCAT1在人类的多种癌症中均表现出促进癌症恶化的作用[6-7],但是其在TSCC中是否也具有相同的促进癌症恶化作用有待探究。Huang等[8]在研究中报道,PCAT1在食道鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)组织和细胞中的表达明显升高,下调PCAT1抑制ESCC细胞的增殖。PCAT1通过调节PHLPP/FKBP51/IKKα复合物激活AKT/NF-κB信号传导而促进去势抵抗性前列腺癌的发生及发展[9]。PCAT1通过Wnt/β-catenin信号通路调节肝外胆管癌的进展[10]。本研究发现PCAT1在TSCC组织和癌细胞中的表达均显著上调,并且过表达PCAT1促进癌细胞的增殖、迁移侵袭和谷氨酰胺分解,提示PCAT1在TCSS中发挥促进癌症恶化的作用。谷氨酰胺是一种具有胺官能团的非必需氨基酸,是血液中循环最丰富的氨基酸。赖谷氨酰胺分解一直被认为是癌细胞代谢的一个标志。与正常分化的细胞不同,癌细胞已经重新编程了新陈代谢,以满足其能量需求。许多代谢途径癌在细胞的能量获取中占据重要地位,如葡萄糖转运,包括谷氨酰胺分解和磷酸戊糖途径[11-12]。谷氨酰胺分解产物谷氨酸盐、α-酮戊二酸(α-KG)是谷氨酰胺代谢的关键产物,本研究发现过表达PCAT1能够上调谷氨酸盐、α-KG的含量。
本研究还发现,PCAT1能够吸附miR-329-3p,推测这可能与PCAT1在TSCC中的功能有联系。据报道,大量miRNA在TSCC中表达失调[13-14],但是仍有新发现的miRNA在TSCC中的功能尚未清楚。Chang等[15]报道,miR-329-3p在胃癌组织中的表达水平明显下调,并且与患者的淋巴转移、分期和总生存期呈负相关,表明miR-329-3p的下调与胃癌患者的预后不良有关。Li等[16]发现,miR-329-3p在宫颈癌组织和细胞系中的表达水平均降低,miR-329-3p低表达与宫颈癌患者的组织学分级、分期和淋巴结转移呈负相关。miR-329-3p的上调能够抑制宫颈癌细胞增殖、迁移和侵袭。并且MAPK1为miR-329-3p的直接靶基因,揭示了miR-329-3p通过直接靶向MAPK1发挥肿瘤抑制作用,推测其可作为治疗宫颈癌患者的新型治疗靶标。miR-329-3p/ADP核糖基化因子1(ARF1)通路可作为肿瘤蛋白P73反义RNA 1(TP73-AS1)的下游吸附因子,参与TP73-AS1在宫颈癌中的致癌作用[17]。此研究发现,miR-329-3p在TSCC组织和癌细胞中的表达异常下调,进一步研究发现过表达miR-329-3p能够抑制癌细胞的增殖、迁移侵袭和谷氨酰胺分解,这说明miR-329-3p在TSCC中具有抑制癌症发生恶化的作用。过表达miR-329-3p还能够减弱PCAT1对TSCC癌细胞恶化的促进作用。本研究发现过表达miR-329-3p则可以抑制谷氨酸盐、α-KG,提示PCAT1、miR-329-3p能够通过谷氨酰胺分解调节TSCC的进展。
综上所述,PCAT1在TSCC中高表达,miR-329-3p在TSCC中低表达,PCAT1可通过靶向调控miR-329-3p的表达而促进TSCC细胞增殖、迁移和侵袭,其可能作为TSCC治疗的潜在靶标,还可为进一步阐释TSCC的发病机制奠定实验基础。
