FGF21/β-klotho/FGFR1通路在2型糖尿病局灶性脑缺血模型大鼠脑损伤中的作用机制研究
2021-12-13阳李其富黎昌炫陈瑞鹏
何 阳李其富黎昌炫陈瑞鹏
(海南医学院第一附属医院 神经内科,海口 570000)
糖尿病是一种慢性代谢紊乱性疾病,以2型糖尿病(type 2 diabetes mellitus,T2DM)较为常见,随着近来人们饮食结构及生活方式的改变,发病率呈增加且年轻化趋势,其中糖尿病各种并发症是其致死、致残的重要原因,危害严重[1-2]。近来研究显示,糖尿病是脑梗死的独立危险因素,T2DM患者较非糖尿病患者发生脑缺血再灌注损伤的风险高2~6倍,且糖尿病合并脑梗死发病率逐年升高,严重影响患者预后及生存质量[3]。尽管近来研究糖尿病加重脑梗死的机制较多,但其具体机制尚未完全阐明[4]。成纤维细胞生长因子21(fibroblast growth factor 21,FGF21)是一种新的代谢调节因子,在大脑新陈代谢、保护和认知方面发挥重要作用[5],β-klotho是一种膜蛋白,可增强FGF21与其受体FGFR1结合的亲和性,辅助其完成相应特异功能,在神经系统血管内皮功能、血糖及体重等调节中发挥重要作用[6-7]。因此本研究拟探究FGF21/βklotho/FGFR1通路在T2DM局灶性脑缺血模型大鼠脑损伤中的作用机制,以期为T2DM加重局灶性脑缺血性疾病的机制研究提供新的思路。
1 材料和方法
1.1 实验动物
健康雄性清洁级10周龄SD大鼠60只,体重280~310 g,购买及饲养均在北京维通利华实验动物技术有限公司上海分公司[SCXK(沪)2017-0011][SYXK(沪)2017-0014]。本研究经过本院动物伦理委员会批准通过(IACUC-L2018-0005)。实验遵循3R原则,给予人道主义关怀。
1.2 主要试剂与仪器
PrimeScriptTMRT reagent Kit(Perfect Real Time)(货号:RR037A)、TB Green® Premix Ex TaqTMII(Tli RNaseH Plus)(货号:RR820A)均购自TaKaRa公司;引物由上海吉玛生物科技有限公司合成;FGFR1抑制剂PD173074(货号:HY-10321)、FGFR1激动剂PF05231023(货号:HY-113697)购自MCE公司;原位末端标记法(TUNEL)细胞凋亡检测试剂盒(货号:C1091)购自上海碧云天公司;兔源一抗anti-FGF21(货号:ab64857)、anti-β-klotho(货号:ab181373)、anti-FGFR1(货号:ab173305)、anti-血小板内皮细胞粘附分子(platelet endothelial cell adhesion molecules,CD31)(货号:ab24590)、anti-内皮素-1(endothelin-1,ET-1)(货号:ab242440)、anti-血管内皮生长因子(vascular endothelial growth factor,VEGF)抗体(货号:ab32152)、anti-GAPDH(货号:ab9485),二抗羊抗兔IgG(货号:ab6721)均购自英国Abcam公司;FC型酶标仪、ABI 7500 RTqPCR仪购自美国Thermofisher公司;尼康55i荧光显微镜购自日本Nikon公司等。
1.3 实验方法
1.3.1 模型制备
SD大鼠常规适应性饲养1周后,根据表1造模方法进行造模处理。

表1 造模类型及方法Table 1 Model types and methods
1.3.2 实验分组
根据表2所述,将大鼠随机分为5组,每组12只。若造模过程中动物死亡,及时补充造模。MCAO术后24 h对各组大鼠进行神经功能缺损评分,之后从每组大鼠中随机选取6只处死,迅速取缺血侧脑组织及其周围脑组织置于液氮中保存备用,剩余6只进行石蜡包埋固定制成石蜡切片保存备用。

表2 大鼠的分组及给药Table 2 Grouping and administration of rats
1.3.3 TUNEL法检测大鼠脑组织神经细胞凋亡
石蜡切片常规脱蜡至水,胰蛋白酶K 37℃孵育25 min,漂洗晾干后采用TUNEL试剂盒进行染色后于显微镜下观察,随机选取5个高倍镜(×400)视野下阳性细胞,并计算其所占比例,即凋亡率=(阳性细胞/计数细胞)×100%。
1.3.4 实时荧光定量PCR(Real-time quantitative PCR,RT-qPCR)检 测 缺 血 侧 脑 组 织FGF21、βklotho、FGFR1 mRNA表达
采用TRIzol提取脑组织样品总RNA,用紫外分光光度计检测总RNA浓度及纯度。反转录得到cDNA,置于-20℃保存备用。采用RT-qPCR扩增FGF21、β-klotho、FGFR1 mRNA片段。反应体系:TB Green Premix Ex Taq II(2×)10 μL,ROX Reference Dye II(50×)0.4 μL,cDNA(50 ng/μL)2 μL,上下游引物(10 μmol/L)各0.8 μL,ddH2O 6.0 μL。反应条件:95℃30 s;95℃5 s,61℃31 s,40个循环。FGF21、β-klotho、FGFR1及内参GAPDH的引物序列见表3。采用2-ΔΔCT法对脑组织FGF21、β-klotho、FGFR1 mRNA相对表达水平进行定量分析。

表3 RT-qPCR引物序列Table 3 Primer sequence of RT-qPCR
1.3.5 免疫印迹(Western blot)检测脑组织FGF21、β-klotho、FGFR1、CD31、ET-1、VEGF蛋白表达
采用蛋白抽提试剂盒提取大鼠缺血侧脑组织及周围组织总蛋白,BCA试剂盒检测蛋白浓度,置于-80℃保存备用。取50 μg蛋白样品,进行SDSPAGE电泳分离,PVDF膜转膜,室温封闭,添加稀释一抗anti-FGF21(稀释比1∶1000)、anti-β-klotho(稀释比1∶1000)、anti-FGFR1(稀释比1∶5000)、anti-CD31(稀释比1∶2000)、anti-ET-1(稀释比1∶1000)、anti-VEGF(稀释比1∶1000)、anti-GAPDH(稀释比1∶5000)4℃孵育过夜,TBST缓冲液洗膜,用适量含2%脱脂奶粉的PBS稀释辣根过氧化物酶标记的二抗IgG(1∶5000)室温孵育1.5 h,洗膜后用免疫印记化学发光试剂(ECL)显色,数字化多功能图像增强化学发光系统曝片,观察结果并分析各蛋白灰度值。
1.4 统计学方法
采用SPSS 25.0软件进行统计学分析,以平均数±标准差(±s)表示,两组比较采用t检验,多组数据比较采用单因素方差分析,任意两两比较采用SNK-q检验。以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠神经功能缺损评分比较
与Control组比较,MCAO组、T2DM+MCAO组大鼠神经功能缺损评分均显著增加(P<0.05);与T2DM+MCAO组比较,PD173074组大鼠神经功能缺损评分显著增加,PF05231023组大鼠神经功能缺损评分显著降低(P<0.05),见表4。
表4 各组大鼠神经功能缺损评分比较(±s,n=12)Table 4 Comparison of neurological deficit scores of rats in each group

表4 各组大鼠神经功能缺损评分比较(±s,n=12)Table 4 Comparison of neurological deficit scores of rats in each group
注:与Control组相比,*P<0.05;与MCAO组相比,#P<0.05;与T2DM+MCAO组相比,△P<0.05。Note.Compared with Control group,*P<0.05.Compared with MCAO group,#P<0.05.Compared with T2DM+MCAO group,△P<0.05.
?
2.2 各组大鼠缺血侧脑组织海马神经元细胞凋亡情况比较
Control组大鼠脑组织海马偶见神经元凋亡,与Control组比较,MCAO组、T2DM+MCAO组大鼠缺血侧脑组织海马神经元细胞凋亡率均显著增加(P<0.05);与T2DM+MCAO组比较,PD173074组大鼠缺血侧脑组织海马神经元细胞凋亡率显著增加,PF05231023组大鼠缺血侧脑组织海马神经元细胞凋亡率显著降低(P<0.05),见表5。
表5 各组大鼠缺血侧脑组织海马神经元细胞凋亡率比较(±s,n=6)Table 5 Comparison of apoptotic rate of hippocampal neurons in ischemic brain tissue of each group
注:与Control组相比,*P<0.05;与MCAO组相比,#P<0.05;与T2DM+MCAO组相比,△P<0.05。Note.Compared with Control group,*P<0.05.Compared with MCAO group,#P<0.05.Compared with T2DM+MCAO group,△P<0.05.
?
2.3 各组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1 mRNA表达水平比较
与Control组比较,MCAO组、T2DM+MCAO组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1 mRNA表达水平均显著增加(P<0.05);与T2DM+MCAO组比较,PD173074组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1 mRNA表 达 水 平 显 著 降 低(P<0.05),PF05231023组大鼠缺血侧脑组织FGF21、βklotho、FGFR1 mRNA表达水平显著增加(P<0.05),见图1。

图1 各组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1 mRNA表达水平比较(n=6)Note.Compared with Control group,*P<0.05.Compared with MCAO group,# P<0.05.Compared with T2DM+MCAO group,△P<0.05.Figure 1 Comparison of mRNA expression levels of FGF21,β-klotho and FGFR1 in ischemic brain tissue of rats in each group
2.4 各组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1蛋白表达水平比较
与Control组比较,MCAO组、T2DM+MCAO组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1蛋白表达水平均显著增加(P<0.05);与T2DM+MCAO组比较,PD173074组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1蛋白表达水平显著降低(P<0.05),PF05231023组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1蛋白表达水平显著增加(P<0.05),见图2。

图2 各组大鼠缺血侧脑组织FGF21、β-klotho、FGFR1蛋白表达水平比较(n=6)Note.A,Protein band map of FGF21,β-klotho and FGFR1.B,Relative expression levels of FGF21,β-klotho and FGFR1 proteins.Compared with Control group,*P<0.05.Compared with MCAO group,#P<0.05.Compared with T2DM+MCAO group,△P<0.05.Figure 2 Comparison of protein expression levels of FGF21,β-klotho and FGFR1 in ischemic brain tissue of rats in each group
2.5 各组大鼠缺血脑组织周围ET-1、CD31、VEGF蛋白表达水平比较
PF05231023组大鼠缺血脑组织周围ET-1、CD31、VEGF蛋白表达水平显著降低(P<0.05),见图3。
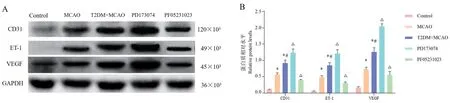
图3 各组大鼠缺血脑组织周围ET-1、CD31、VEGF蛋白表达水平比较(n=6)Note.A,Protein band map of ET-1,CD31 and VEGF.B,Relative protein expression levels of ET-1,CD31 and VEGF.Compared with Control group,*P<0.05.Compared with MCAO group,#P<0.05.Compared with T2DM+MCAO group,△P<0.05.Figure 3 Comparison of ET-1,CD31 and VEGF protein expression levels around ischemic brain tissue of rats in each group
与Control组比较,MCAO组、T2DM+MCAO组大鼠缺血脑组织周围ET-1、CD31、VEGF蛋白表达水平均显著增加(P<0.05);与T2DM+MCAO组比较,PD173074组大鼠缺血脑组织周围ET-1、CD31、VEGF蛋白表达水平显著增加(P<0.05),
3 讨论
糖尿病是脑血管疾病的一个重要危险因素,持续高糖可导致血管内皮细胞损伤、破裂,极易造成血管阻塞,诱发血栓及脑梗死[12]。脑缺血急性期,随缺血时间延长,神经元凋亡细胞数显著增加,神经元坏死与凋亡并存,坏死主要位于缺血中心区,凋亡则主要出现在缺血半暗带[13]。本研究结果发现,与MCAO组比较,T2DM+MCAO组大鼠神经功能缺损评分显著增加,缺血脑组织中海马神经元细胞凋亡率显著增加,结果与何婧等[14]发现相一致,提示T2DM可进一步加重脑缺血损伤。研究证实,血管再生可增加脑缺血后脑组织血流灌注、改善神经功能[15]。CD31又称血小板内皮细胞黏附分子-1(platelet endothelial cell adhesion molecule-1,PECAM-1),是一种存在于血管内皮和血小板中可直观有效反映新生血管数目和侧支循环建立情况的糖蛋白,在脑缺血梗死周围显著增加[16-17]。ET-1是一种具有强缩血管作用的小分子多肽[18]。VEGF是由大脑中的许多神经血管细胞产生和分泌,被认为是缺血后血管生成的中枢介质[19],其表达升高与血管内皮损伤有关。本研究结果显示,与Control组比较,与MCAO组、T2DM+MCAO组大鼠缺血组织周围CD31、ET-1和VEGF蛋白表达显著增加,提示局灶性脑缺血模型大鼠存在脑血管内皮损伤,而T2DM可加重脑血管内皮损伤,但关于其具体机制尚未完全阐明。
FGF家族分为7个亚族,共有22个成员,其中FGF21主要表达于肝组织,是新发现的一种脂质调节蛋白。由于FGF21与肝素的亲和力较低,可以通过简单的扩散穿透血脑屏障,对大脑具有潜在的保护作用。FGF21已被证实在大脑新陈代谢、保护和认知方面发挥重要作用[20]。FGF21通过细胞-表面受体复合体发挥代谢调节作用,该复合体由FGFR和单一跨膜蛋白β-klotho组成。
研究报道,FGF21可减轻淀粉样蛋白和兴奋性氨基酸诱导的阿尔茨海默病大鼠模型中的神经元损伤和认知缺陷[21]。创伤性脑损伤后,FGF21还可通过FGFR1/β-klotho上调PPARγ来保护血脑屏障[22]。本研究结果发现,与T2DM+MCAO组比较,FGFR1抑 制 剂PD173074可 显 著 降 低FGF21、β-klotho、FGFR1 mRNA及蛋白表达水平,增加T2DM脑缺血模型大鼠神经功能缺损,促进海马神经元细胞凋亡,增加血管内皮损伤标志蛋白CD31、ET-1表达,而FGFR1激活剂PF05231023可显著增加FGF21、β-klotho、FGFR1 mRNA及蛋白表达水平,减轻T2DM脑缺血模型大鼠神经功能缺损,降低海马神经元细胞凋亡,减少血管内皮损伤标志蛋白CD31、ET-1和VEGF表 达。Ye等[23]研 究发 现,FGF21激活FGFR1/β-klotho通路可明显改善新生儿缺氧缺血性脑损伤。本研究结果结合前人发现,推测FGF21/β-klotho/FGFR1信号通路的激活可能在T2DM局灶性脑缺血进程中发挥重要保护作用。
综上所述,FGF21/β-klotho/FGFR1通路可能是T2DM加重脑缺血损伤的重要传递信号通路,促进该通路激活在T2DM局灶性脑缺血模型大鼠中发挥重要保护作用。但神经凋亡机制复杂,脑缺血引起血管内皮损伤及神经凋亡过程是否还涉及其他信号通路共同参与及其与FGF21/β-klotho/FGFR1通路的上下游作用关系,有待进一步深入探究。
