Atrolnc-1在制动诱导小鼠后肢肌萎缩中的作用研究*
2021-12-10史华彩佘燕玲周珊瑶
史华彩, 陈 睿, 佘燕玲, 周珊瑶, 雷 斯, 郭 隽
(广东省第二人民医院, 广东省传统医学与运动伤害康复研究所, 广州 510317)
肢体制动是一种常用的治疗手段,在临床上常用夹板、石膏等限制患肢活动,防止骨折或其他创伤发生继发性损伤,有利于康复,但长时间或者不合理的制动会引起患肢肌肉周围神经传导减慢、局部血供减少、关节活动度下降等,从而导致肌肉萎缩。另外,肌肉萎缩也会影响患肢功能恢复、肌力、耐力,严重者会影响患者的日常生活,降低生活质量,加重家庭甚至社会经济负担[1, 2]。因此寻找预防及治疗骨骼肌萎缩的靶点具有重要的临床意义。
长链非编码RNA (long noncoding RNAs,lncRNAs)是一类从不完全注释基因上转录出来的,长度大于200个核苷酸,几乎无编码能力的RNA[3,4],参与了骨骼肌纤维的形成和稳态等过程[5,6]。Atrolnc-1是一种与肌萎缩相关的lncRNA,由Lijing Sun等在慢性肾病小鼠模型中发现,并认为Atrolnc-1与A20 binding inhibitor of NF-κB-1(ABIN-1)相互作用,激活NF-κB,促进MuRF-1表达增强[7]。
本研究主要探讨Atrolnc-1在制动诱导小鼠后肢肌萎缩中的作用,为其用于临床治疗长期卧床、石膏固定、缺少运动等引起的肌萎缩提供实验依据。
1 材料与方法
1.1 实验动物及分组
6周龄雄性C57BL/6小鼠20只,SPF级,体量18~22 g,购买于中山大学实验动物中心,并饲养于广州永诺生物科技有限公司。所有动物适应性喂养一周后,随机分为对照组(Control)和制动组(Immobilization),每组10只。本研究对动物的处理方法符合中华人民共和国科学技术部颁发的《关于善待实验动物的指导性意见》。
1.2 实验仪器和试剂
电子秤,上海菁海仪器有限公司;全自动样品快速研磨仪,上海净信实业发展有限公司;全自动化学发光成像分析系统扫描成像,上海天能科技有限公司;荧光定量PCR仪,美国ABI公司;电泳转印系统,北京凯元信瑞仪器有限公司。
苏木素和伊红,广州市凯秀贸易有限公司;VDAC抗体,美国CST公司;Atrogin-1(muscle atrophy F-box,Atrogin-1)抗体、MuRF-1(muscle ring finger protein-1,MuRF-1)抗体,英国Abcam公司;p-NF-κB抗体、Tubulin抗体、辣根过氧化物酶标记山羊抗兔,美国Abclonal公司;细胞核蛋白与细胞浆蛋白抽提试剂盒,上海碧云天生物技术有限公司;增强化学发光法(ECL)试剂盒,德国Millipore公司。
1.3 动物制动模型的建立
对照组:常规饲养,不作任何实验处理。制动组:采用10 mg/ml戊巴比妥钠0.2 ml腹腔注射麻醉后,将小鼠右侧后肢装入自制塑料制动器,调节使之固定,密切注意观察动物肢体的末梢血液循环及制动器固定情况,若发现有水肿或制动器松脱,立即中止该动物的实验。制动组小鼠的饲养及环境条件同对照组。制动2周后[8],将2组小鼠麻醉取材后处死,用于形态学观察、实时荧光定量PCR(quantitative real-time PCR,QRT-PCR)及蛋白免疫印迹(Western blot,WB)检测。
1.4 取材
麻醉小鼠,于动物实验操作台上仰卧位固定其四肢。取右后肢下段背侧,切开皮肤,分离腓肠肌并切断,完整取下,剔除筋膜,用PBS冲洗残留的血液,并用灭菌纱布吸干,称取湿重。将组织切成2份,一部分迅速投入液氮后保存在-80℃冰箱,另一部分置于10%中性福尔马林固定液中固定。
1.5 苏木素-伊红(HE) 染色
取10%中性福尔马林固定液中固定的样本进行组织修剪、常规脱水,石蜡包埋。将包埋好的蜡块固定于切片机上,切成5 μm大小的薄片。用二甲苯脱蜡,再经由高浓度到低浓度乙醇,最后入蒸馏水。用苏木素染色5 min,再用1%盐酸乙醇分化3 s。流水冲洗30 s后入蒸馏水片刻,再入70%和90%酒精中脱水各10 min。用0.5%伊红染细胞浆3 min,苏木素染核。滴上中性树脂,盖上盖玻片封固。最后在光学显微镜下进行形态学观察。
1.6 肌纤维横截面积测定
经HE染色后,每个样本取5张切片,于200倍放大倍数镜下,各采集10张图像,所得图像用Image J软件分析肌纤维横截面积,并计算均数和标准差。
1.7 QRT-PCR检测Atrogin-1、Atrolnc-1的表达水平
用Trizol提取腓肠肌总RNA,核酸蛋白定量仪检测RNA的浓度。取总RNA 2 μl,按照Takara试剂盒说明反转录为cDNA,随后进行荧光定量PCR。PCR反应条件为:95℃预变性30 s,95℃变性5 s,60℃退火30 s,40个循环。检测Atrogin-1、Atrolnc-1的表达,记录Ct值,以18 s为内参,计算2-△△Ct。上下游引物序列见表1。
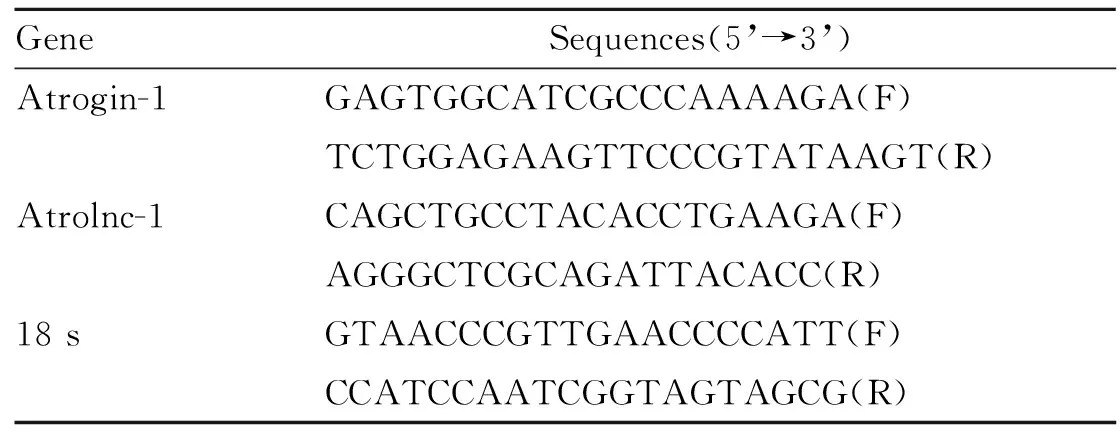
Tab. 1 Sequences of PCR primers
1.8 蛋白提取定量
从-80℃冰箱取出组织置于无菌培养皿中,用眼科剪将肌肉剪碎至肉糜状,分成两份:一份加入裂解液于冰上裂解0.5 h,随后用电动匀浆器进一步匀浆,使其完全裂解,12 000 r/min,4℃,15 min离心,上清液转至Eppendorf管中,得到总蛋白;另一份行核质分离,按照细胞核蛋白与细胞浆蛋白抽提试剂盒的步骤操作,最后得到细胞核蛋白和细胞浆蛋白。用BCA法蛋白定量,余下样品加入相应体积的6×SDS Loading Buffer,100℃煮沸5 min。
1.9 Western blot检测p-NF-κB、Atrogin-1、MuRF-1蛋白表达水平
采用十二烷基磺酸钠-聚丙烯酰氨凝胶(SDS-PAGF)进行电泳,每个上样孔中加入40 μg蛋白样本。开始电泳时,电压为80V,待样品进入分离胶后,增加电压至120 V,电泳至溴酚蓝抵达分离胶底部。拆胶,转移到聚偏二氟乙烯(PVDF)膜上,用200 mA恒流转膜90 min,取膜,浸入5%脱脂牛奶封闭液中,室温摇床封闭1 h,然后加入p-NF-κB抗体(1∶1 000),Atrogin-1抗体(1∶1 000),MuRF-1抗体(1∶1 000),Tubulin抗体(1∶5 000) ,VDAC抗体(1∶1 000),于4℃孵育过夜。用TBST液洗膜3次,每次5 min。加入辣根过氧化物酶标记山羊抗兔(1∶5 000),室温摇床孵育1 h,洗膜。用ECL化学发光液显色,全自动化学发光成像分析系统扫描成像。Image J分析蛋白条带灰度值,以Tubulin、VDAC作为内参[9],目的蛋白条带灰度值与相应内参蛋白条带灰度值之比表示相对蛋白表达水平。
1.10 统计学处理
2 结果
2.1 制动对小鼠腓肠肌的影响
两组小鼠的体重无明显差异(P>0.05)。与对照组比较,制动组小鼠腓肠肌湿重减少,但差异无统计学意义(P>0.05);腓肠肌的湿重/体重千分比明显降低,差异有统计学意义(P<0.05),提示小鼠制动后,腓肠肌出现萎缩(表2)。
Tab. 2 Comparison of body weight and gastrocnemius wet weight in each n=10)
2.2 腓肠肌形态学改变及肌纤维横截面积测定
两组腓肠肌经HE染色后,光学显微镜下观察形态学改变。结果显示:对照组肌细胞呈圆形或椭圆形,边缘规则,形态清晰,肌丝排列整齐有序,未见炎症细胞、充血等。制动组见骨骼肌纤维边缘不规则,大量肌纤维缩小或溶解,结构不清,肌纤维横纹排列紊乱,间质见炎症细胞浸润,部分血管扩张充血(图1A)。
肌纤维横截面积测定结果显示,对照组的肌纤维横截面积为(3881±379.3)μm2,制动组的肌纤维横截面积为(2725±181.7)μm2,制动后肌纤维横截面积明显缩小,差异有统计学意义(P<0.01),提示小鼠腓肠肌萎缩(图1B)。

Fig. 1 Morphological changes of gastrocnemius and the cross-sectional area of muscle fiber (n=10)A: Morphological changes of gastrocnemius between control group and immobilization group(HE staining,original magnification ×200,scale bar=200 μm); B: The cross-sectional area of muscle fiber between control group and immobilization group(μm2)**P<0.01 vs control group
2.3 制动后Atrogin-1 mRNA及蛋白的变化情况
结果显示,QRT-PCR检测Atrogin-1 mRNA表达明显上升,差异有统计学意义(P<0.01,图2A)。WB检测Atrogin-1蛋白表达也升高(P<0.01)。提示小鼠制动2周后,腓肠肌萎缩(图2B、表3)。
Tab. 3 The level of Atrogin-1 protein in each n=3)

Fig. 2 The mRNA and protein levels of Atrogin-1 after immobilization(n=10)A: The level of Atrogin-1 mRNA; B: The level of Atrogin-1 protein**P<0.01 vs control group
2.4 制动后Atrolnc-1、p-NF-κB蛋白、MuRF-1蛋白的变化情况
结果显示,制动2周后,Atrolnc-1的表达明显升高,差异有统计学意义(P<0.01,图3A);胞浆p-NF-κB蛋白表达降低(P<0.01),但胞核p-NF-κB蛋白表达升高(P<0.01)(图3B、C,表4),同时MuRF-1表达也升高(P<0.01)(图3D,表4)。提示制动诱导腓肠肌萎缩,其机制可能是Atrolnc-1激活NF-κB,促进NF-κB磷酸化并入核,从而上调MuRF-1的表达。
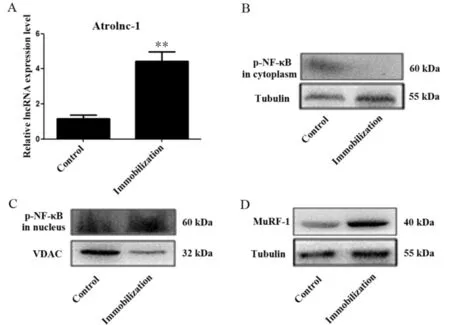
Fig. 3 The expressions of Atrolnc-1 and the protein level of p-NF-κB and MuRF-1 after immobilization(n=10)A: The level of Atrolnc-1; B: The level of p-NF-κB protein in cytoplasm; C: The level of p-NF-κB protein in nucleus; D: The level of MuRF-1 protein**P<0.01 vs control group
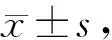
Tab. 4 The levels of p-NF-κB and MuRF-1 protein in each group(%, n=3)
3 讨论
制动诱导的肌萎缩常发生在骨折、长期卧床、缺少运动、神经麻痹等条件下[10-12]。Atrogin-1和MuRF-1为肌肉萎缩的标志性基因,在许多动物模型(制动、去神经、禁食等)中,其表达均上调[8, 13, 14]。我们前期发现,二氯化钴模拟缺氧可诱导肌萎缩,Atrogin-1的表达量也升高[15]。本研究发现,小鼠后肢制动2周后,腓肠肌的湿重/体重千分比明显降低,光学显微镜下可见大量肌纤维溶解,测量肌纤维横截面积减小,Atrogin-1和MuRF-1表达均升高,提示制动诱导肌萎缩。
近年来,随着高通量测序及基因芯片技术的发展,研究人员发现了一些与骨骼肌发育相关的lncRNA,可通过不同的调控机制靶向关键因子,参与调控骨骼肌发育的各个环节,包括骨骼肌细胞的增殖、分化、融合和萎缩等[7, 16-20]。最近文献报道,Atrolnc-1的过度表达导致慢性肾病小鼠肌纤维萎缩。在本研究中,QRT-PCR检测到制动后小鼠腓肠肌Atrolnc-1表达升高,提示Atrolnc-1可能参与调控制动诱导的肌萎缩。
文献报道,过表达Atrolnc-1 48h后,C2C12细胞核中NF-κB(p65)明显增加[7]。本研究中,制动诱导小鼠腓肠肌萎缩后,Atrolnc-1表达升高,胞浆p-NF-κB蛋白表达降低,但胞核p-NF-κB蛋白表达升高。这些结果提示在制动诱导肌萎缩的模型中,Atrolnc-1的表达升高可能激活了NF-κB,并促进其入核。据刘亚南报道,在心肌梗死大鼠模型中,间歇运动降低TNF-a水平,升高HSP70的表达,抑制NF-κB磷酸化水平的同时MuRF-1表达降低,从而保护心肌[21]。最近有文献报道,将CRISPR/dCas9介导的协同激活介质转录激活系统用于过表达ABIN-1的C2C12细胞系,发现ABIN-1过表达抑制MuRF-1表达[7]。因此,入核的NF-κB可以促进MuRF-1的转录。MuRF-1属于泛素蛋白连接酶,与骨骼肌蛋白质的分解代谢密切相关[22]。本研究也检测到胞核p-NF-κB蛋白表达升高的同时,MuRF-1表达也上调。因此,我们推测制动诱导肌萎缩的机制可能是Atrolnc-1激活NF-κB,促进NF-κB磷酸化并入核,使MuRF-1的表达增强,并引起肌肉蛋白的降解,从而导致肌萎缩。
综上所述,Atrolnc-1可在一定程度上促进制动诱导的肌萎缩,可能通过促进NF-κB磷酸化并入核,增加MuRF-1的表达来实现。因此,Atrolnc-1可能是肢体制动或其他疾病引起肌萎缩的潜在治疗靶点,为肌萎缩的治疗和康复提供了一个新的方向。
