大蒜阿霍烯抗胃癌的作用及分子机制*
2021-12-10朱明了楼恩哲赵凯婷何施燕陈佳玉
朱明了, 郑 珍, 楼恩哲, 赵凯婷, 何施燕, 陈佳玉
(绍兴文理学院医学院, 浙江 绍兴 312000)
胃癌是世界上最常见的恶性肿瘤之一。在我国,胃癌的发病率和死亡率均居于癌症的第二位[1]。每年,全球有723 000名患者死于胃癌[2],晚期胃癌患者的5年生存率低[3]。由于缺乏早期胃癌特异性诊断指标,且胃癌早期临床症状不明显,胃癌患者确诊时往往已到了肿瘤进展晚期[1],而现有治疗方案和药物因其具复发率高、副作用大、治疗成本高等缺点,无法实现对胃癌患者真正意义上的治疗,因此,寻找对胃癌有治疗作用、毒副作用低的药物一直是胃癌防治研究的重点和难点。
大蒜是一种重要的药食兼用植物,具有抗心血管疾病、抗肿瘤、杀菌等功效[4-6],价格低廉,无毒副作用。大蒜阿霍烯为大蒜的成份之一,有研究资料已证明它可抑制多种肿瘤如食管癌、结肠癌、乳腺癌等细胞的增殖,并可诱导细胞凋亡[7-10],但该成分对胃癌细胞MGC-803的作用尚未见报道。据报道,胃癌细胞可通过PI3K-AKT-mTOR、RAS-RAF-MEK-ERK通路发生凋亡[11,12],为研究大蒜阿霍烯抗胃癌的分子机制提供了思路。本文拟通过研究大蒜阿霍烯对胃癌细胞MGC-803的增殖、凋亡和周期的影响,证实大蒜阿霍烯对胃癌的治疗作用,并揭示其作用的相关分子机制。
1 材料与方法
1.1 实验材料
CCK-8染色液(同仁,日本);FITC/PI apoptosis assays kit(BD,美国);细胞线粒体膜电位JC-1检测试剂盒(天晶公司,上海);RPMI 1640培养液、 0.25% Trypsin、和Fetal Bovine serum(FBS)(Gibco,美国);TRIzol® Reagent、SuperScript® III First-Strand(Invitrogen,美国);Hoechst 33342(Solarbio,上海);乳酸脱氢酶细胞毒性检测试剂盒、(29∶1)聚丙烯酰胺(Acrylamide)、十二烷基磺酸钠(SDS)、四甲基二乙胺(TEMED)、pH 8.8 Tris-HCL溶液、pH 6.8 Tris-HCL溶液、RIPA裂解液、BCA蛋白浓度测定试剂盒、超敏ECL化学发光显色液(碧云天,上海);其他的试剂均为国产分析纯。实验所用细胞来源于上海中科院细胞所;BALB/C小鼠购自浙大实验动物中心。大蒜阿霍烯购自上海源叶生物科技有限公司。
1.2 细胞增殖实验
用含10% FBS的RPMI 1640完全细胞培养液在37℃ 5% CO2条件下培养胃癌细胞株MGC-803。待其处于对数生长阶段时,0.25%胰酶消化细胞, 1 000 r/min离心5 min, 回收细胞,用PBS洗涤细胞2次,弃上清,用含有10% FBS的RPMI 1640细胞培养液重悬细胞,并调整细胞密度为1×104cells/ml,将其加到96孔培养板中,100 μl/well,于37℃ 5% CO2培养,待细胞贴壁后,于培养液中加入大蒜阿霍烯,使其终浓度分别为0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L和125 μmol/L,设三复孔,继续培养24 h、48 h和72 h时,用CCK8染色试剂盒染色后,通过酶标仪(490 nm)检测细胞增殖活性。
1.3 JC-1染色法分析细胞膜电位
取上述细胞密度为1×104cells/ml的MGC-803,置于96孔板中,100 μl/well,设两复孔,5% CO237℃条件下培养至细胞融合度达到80%。弃上清,分别加入含有0 μmol/L、25 μmol/L大蒜阿霍烯的细胞完全培养液100 μl, 37℃ 5% CO2条件下培养24 h。弃上清,用PBS洗涤细胞2次,每孔加入50 μl细胞生长培养液和50 μl JC-1染色工作液,混匀。37℃ 5% CO2条件下孵育20 min。用冰上预冷的JC-1染色缓冲液洗涤细胞2次,每孔加入100 μl细胞培养液,置于荧光倒置显微镜下观察。
1.4 Hoechst染色观察细胞核型
取融合度为80%的MGC-803细胞六孔板,加入含有0 μmol/L、25 μmol/L、125 μmol/L大蒜阿霍烯的细胞完全培养液2 ml,继续培养24 h。弃上清,PBS洗涤细胞3次。每孔加入1 ml 10 ng/ml Hoechst 33342,37℃避光孵育10 min,弃上清,PBS洗涤细胞3次,置于荧光倒置显微镜下观察细胞核型的变化。
1.5 流式细胞仪检测细胞凋亡和细胞周期
取融合度为80%的MGC-803细胞,分别加入含有0 μmol/L、25 μmol/L、125 μmol/L大蒜阿霍烯的细胞完全培养液,37℃ 5% CO2条件下培养24 h。胰酶消化细胞后用4℃预冷的PBS洗涤细胞2次,每次于4℃条件下300 g离心5 min,回收细胞。取1×105的细胞,FITC和PI双染并洗涤后,1 h内用流式细胞仪检测细胞凋亡率,具体操作见试剂说明书。取1×105的细胞,冰浴预冷的70%乙醇4℃条件固定2 h,4℃ 1 000 r/min离心5 min,弃上清。用预冷的PBS洗涤细胞2次,弃上清。加入100 μl 含有RNase A 的PI染液,避光孵育20 min。经流式细胞仪检测,分析细胞周期变化。
1.6 LDH释放法分析细胞毒性
将1×104cells/ml的MGC-803细胞接种6孔板,2 ml/well,37℃ 5% CO2条件下培养至细胞融合度达到80%,加入大蒜阿霍烯,使其最终浓度为 0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L、125 μmol/L,继续培养24 h,设3复孔。按照LDH检测试剂盒说明书进行样本检测。
1.7 RT-qPCR分析基因转录水平的改变
用含有0 μmol/L和25 μmol/L大蒜阿霍烯作用于80%融合度的MGC-803细胞24 h,按照Trizol试剂说明书提取细胞总RNA,经Nanodrop定量。取5 μg总RNA,用SuperScript® III First-Strand Synthesis System 逆转录合成cDNA,在12.5 μl Power SYBR® Green PCR Master Mix(2×)反应体系中检测、上下游引物各2 μl(10 μmol/L)、模版1 μl,加ddH2O补至25 μl,混匀。置于荧光定量PCR仪中进行扩增,PCR反应参数为95℃ 10 min,95℃ 15 s,60℃ 60 s,共40个循环。以β-actin为内参,采用2-△△CT法分析大蒜阿霍烯作用后基因转录水平的变化。
1.8 Western blot检测细胞内蛋白表达
用0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L、125 μmol/L的大蒜阿霍烯分别作用于80%融合的MGC-803细胞24 h,收集细胞,加入含有1 mmol/L PMSF的RIPA裂解液500 μl,作用5 s,4℃ 12 000 r/min离心5 min。取上清,BCA法进行蛋白定量。取20 μg蛋白样本进行Western blot,Image Quant LAS 4 000 mini超灵敏化学发光成像仪分析细胞内蛋白表达水平的变化。
1.9 小鼠抑瘤实验
取PBS洗涤3次后的处于对数生长期的MGC-803细胞,调整其细胞浓度为2×107cells/L,腹股沟皮下接种100只4周龄雄性BALB/C鼠,0.1 ml/只。接种两天后,将动物分组,每组20只,分别经皮下注射浓度为0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L、125 μmol/L的大蒜阿霍烯,0.1 ml/次,隔天注射一次,并于首次注射肿瘤细胞的第20日每组杀10只,取瘤组织,称重。记录剩余小鼠的存活期。
2 结果
2.1 大蒜阿霍烯对细胞增殖活性的影响
浓度为0 μmol/L、1 μmol/L、5 μmol/L、25 μmol/L、125 μmol/L的大蒜阿霍烯作用于MGC-803细胞0 h、24 h、48 h、72 h,MTS法检测细胞的增殖活性。结果如图1,大蒜阿霍烯能显著抑制胃癌MGC-803细胞增殖活性(P<0.01),其作用效果与药物作用时间和浓度相关。
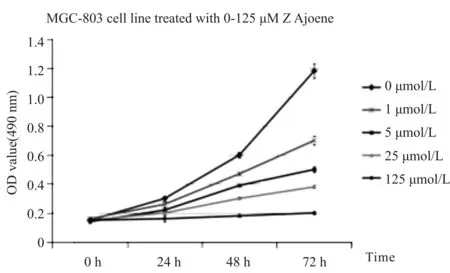
Fig. 1 Theeffects of Z Ajoene on proliferation activity of MGC-803 cells(n=3)
2.2 大蒜阿霍烯对MGC-803细胞线粒体膜电位的影响
胃癌细胞MGC-803经25 μmol/L的大蒜阿霍烯作用24 h,JC-1染色,结果如图2,MGC-803细胞线粒体膜电位下降。

Fig. 2 The effects of Z Ajoene on cell mitochondrial membrane potential of MGC-803 cells by JC-1 staining(×10)(n=3)
2.3 大蒜阿霍烯对细胞核型的影响
不同浓度大蒜阿霍烯作用MGC-803细胞24 h,经Hoechst 33342染色,结果发现大量细胞发生核浓缩、染色质凝集,并形成了凋亡小体(图3)。
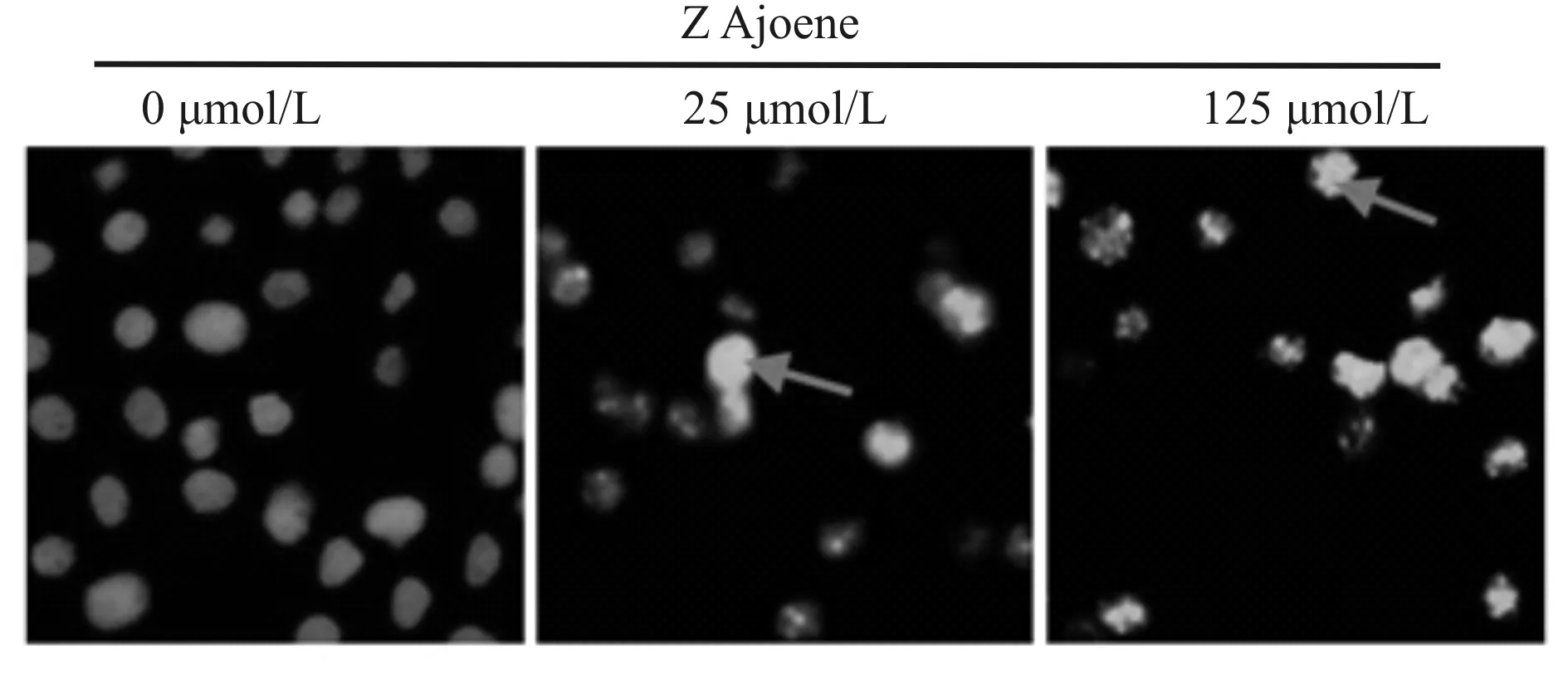
Fig. 3 The effects of Z Ajoene on nucleus of MGC-803 cells by 33342 staining(n=3)
2.4 大蒜阿霍烯对细胞凋亡与细胞周期的影响
如图4A所示,MGC-803细胞经25 μmol/L和125 μmol/L大蒜阿霍烯作用24 h后,早期细胞凋亡比例分别为31.4%和44.1%,较未用药的对照组(0.1%)明显增加。如图4B所示,经25 μmol/L大蒜阿霍烯处理后,MGC-803细胞处于G2期的细胞所占比例(8.2%)较未用药处理组(19.05%)明显降低,且处于sub-G1期的细胞所占比例(11.63%)较未用药处理组(0.53%)明显增加。说明大蒜阿霍烯可将MGC-803细胞阻滞于G1期,并能够促进细胞凋亡。
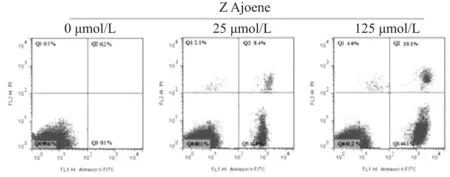
Fig. 4A The apoptosis results detected by flow cytometry(n=3)
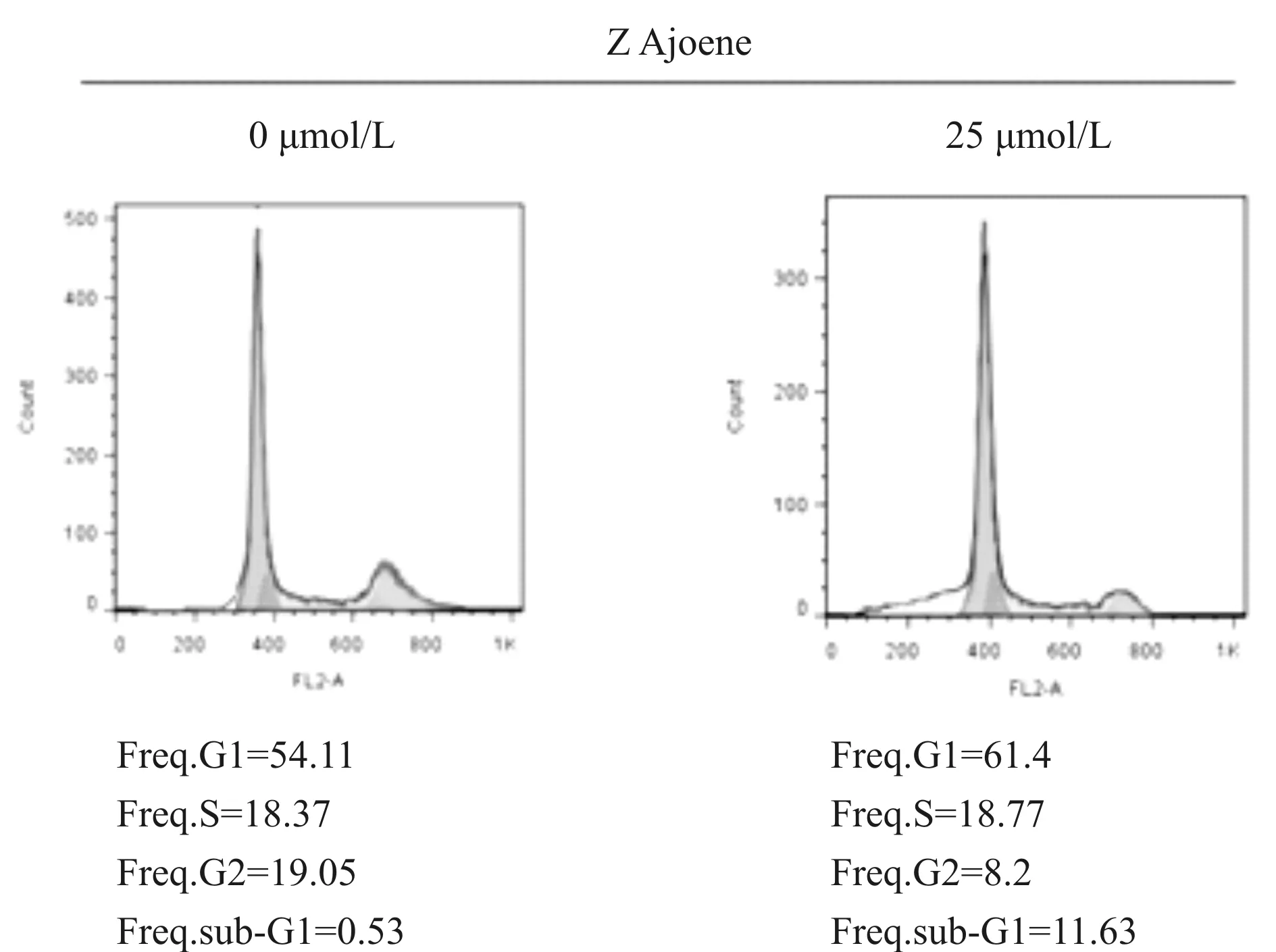
Fig. 4B The cell cycle results detected by flow cytometry(n=3)
2.5 大蒜阿霍烯对细胞培养液内LDH活性的影响
如图5所示,MGC-803细胞经不同浓度的大蒜阿霍烯作用24 h后,细胞培养液内LDH的活性均较未用药组明显升高,且与药物作用的浓度相关,差异有显著意义(P<0.01),大蒜阿霍烯具有一定细胞毒作用。

Fig. 5 The effects of Z Ajoene on LDH release of MGC-803 cells(n=3)
2.6 大蒜阿霍烯对某些基因表达的影响
MGC-803细胞经25 μmol/L大蒜阿霍烯作用24 h后, Western blot和RT-qPCR检测结果显示(图6A和6B),基因P53、Caspase-3、BAX的转录和表达水平均较未用药组显著上调(P<0.01),而RAS、ERK1、BCL-2、AKT、mTOR和PI3K基因的转录和表达水平均明显受抑(P<0.01),其药物作用效果与用药浓度有关。实验结果表明25 μmol/L大蒜阿霍烯可上调P53、Caspase-3、BAX的转录和表达水平,而下调RAS、ERK1、BCL-2、AKT、mTOR和PI3K基因的转录和表达水平。
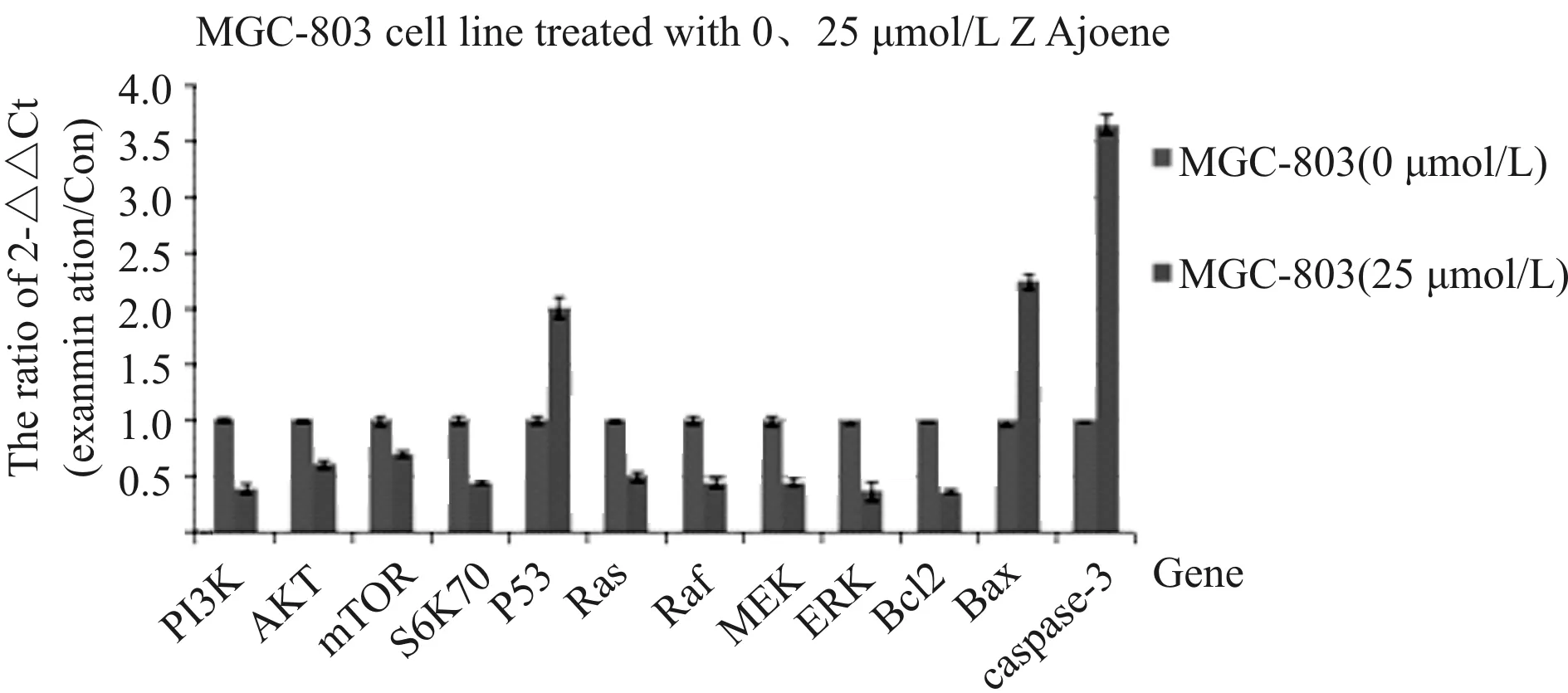
Fig. 6A The RT-qPCR results(n=3)

Fig. 6B The Western blot results(n=3)
2.7 大蒜阿霍烯对肿瘤生长及小鼠存活期的影响
荷有MGC-803细胞瘤的BALB/C小鼠经0 mg/kg、1 mg/kg、5 mg/kg、25 mg/kg和125 mg/kg的大蒜阿霍烯给药20 d,取瘤组织,称重。结果见表1,大蒜阿霍烯可抑制胃癌的生长,且抑制效果与大蒜阿霍烯作用浓度有关。同时大蒜阿霍烯可明显延长荷瘤小鼠的存活期(P<0.01),尤其25 mg/kg大蒜阿霍烯给药组延长更为明显。
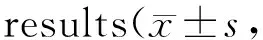
Tab. 1 The tumor suppression test n=10)
3 讨论
目前许多研究表明,PI3K/AKT/mTOR、RAS/RAF/MEK/ERK信号通路在胰腺癌、卵巢癌、子宫内膜癌等多种肿瘤的发生、发展、治疗及转归中起到重要作用[13-15]。资料证实,当细胞受到外界某些药物刺激时,位于细胞膜上的酪氨酸蛋白激酶受体可被激活,并可通过PI3K的激活,使3,4-二磷酸脂酰肌醇(PIP2)转化为3,4,5-三磷酸脂酰肌醇(PIP3),PIP3作为第二信使,将信号传递到细胞内。AKT为PIP3的下游关键蛋白,可以调控多个与细胞凋亡有关的家族,在细胞凋亡中发挥重要作用。活化的AKT (p-AKT)可使其下游蛋白mTOR磷酸化,p-mTOR可以通过影响pS6K等核转录因子的磷酸化而促进细胞内蛋白质的合成及细胞生长,并通过使细胞周期抑制剂失活调节细胞增殖[16]。p-AKT也可以促进MDM2蛋白的磷酸化而使P53发生降解,从而促进细胞的增殖[17]。P53可直接或间接地促进BAX活化[18],活化后的BAX可促进线粒体CytC的释放[19],进而引起Caspase-3活化,对细胞凋亡发挥枢纽作用[20]。而BCL-2的作用则相反,它可通过稳定线粒体内外膜或与凋亡蛋白酶激活因子1(Apaf-1)结合,使线粒体外膜透化(MOMP)引起细胞色素C向胞质释放,结合并激活胞质内的衔接蛋白Apaf-1,促发细胞凋亡,而引起细胞死亡[19]。同时,激活的酪氨酸蛋白激酶受体,将使RAS激酶磷酸化,磷酸化的RAS(p-RAS)可以激活RAS/RAF/MEK/ERK信号通路,从而促进细胞的增殖[21]。
在本实验中,经不同浓度大蒜阿霍烯作用后的MGC-803细胞,其细胞增殖活性和线粒体膜电位均显著下降,细胞凋亡率明显增加。细胞周期检测结果亦证实,25μM的大蒜阿霍烯可以将MGC-803细胞阻滞在G2期之前,从而抑制MGC-803细胞的增殖。Western blot和RT-qPCR结果证实P53、Caspase-3、RAS、ERK、BCL-2、AKT、mTOR、PI3K基因的转录、表达水平均较未用药组明显降低,而P53、Caspase-3、BAX等基因的转录、表达水平均明显升高。上述蛋白为PI3K/AKT/mTOR和RAS/RAF/MEK/ERK信号通路中的重要蛋白,因此大蒜阿霍烯可能是通过调节PI3K/AKT/mTOR和RAS/RAF/MEK/ERK信号通路蛋白的表达而抑制MGC-803细胞的增殖,诱导细胞的凋亡。体内实验亦证实,大蒜阿霍烯可抑制胃癌生长,并可延长荷瘤小鼠生存期。
综上所述,大蒜阿霍烯可通过调节PI3K/AKT/mTOR、RAS/RAF/MEK/ERK信号通路而抑制胃癌细胞增殖,诱导细胞凋亡。为大蒜阿霍烯抗胃癌的进一步研究打下了基础。
