结肠癌患者血清miR-221-3p、miR-376c-3p表达及其与预后的关系
2021-11-25王晓燕肖超肖佑潘燎肖戈
王晓燕,肖超,肖佑,潘燎,肖戈
结肠癌是我国常见恶性肿瘤,随着人们生活水平的不断提高,结肠癌已跃居城市恶性肿瘤发病率第2位(33.17/10万)、死亡率第4位(15.98/10万)[1]。我国结直肠癌患者早期诊断及治疗率偏低,积极推动规范的结直肠癌早诊早治是进一步改善我国结直肠癌患者预后的关键[2]。结肠镜是目前筛查、诊断结直肠癌的主要手段,但结肠镜属于有创检查,不便于在人群体检中广泛应用。癌胚抗原和多种糖类抗原等传统的肿瘤标志物特异度较低,不利于单独作为结直肠癌的诊断依据[3]。因而,寻找一种早期诊断并能够提示结肠癌患者预后的生物学标志物显得尤为重要。微小RNA (microRNA,miRNA) 是近年来关注到的小分子非编码单链RNA,通过与靶基因转录的互补位点相结合,抑制靶基因的表达,从而参与肿瘤细胞的增殖、凋亡等过程;此外,miRNA在肿瘤中发挥重要的生物学功能。近年来发现,miR-221-3p、miR-376c-3p在宫颈癌、肝癌、胃癌及乳腺癌等多种恶性肿瘤中表达异常升高[4-7],通过促进肿瘤血管新生及肿瘤细胞增殖,促进肿瘤的发生发展,有望作为肿瘤早期诊断及预后评估的生物学指标。本研究通过分析结肠癌患者血清中miR-221-3p及miR-376c-3p表达,分析两者在结肠癌中的临床意义,报道如下。
1 资料与方法
1.1 临床资料 选取2016年5月—2018年5月湖南中医药大学第二附属医院肛肠科诊治结肠癌患者104例(结肠癌组)和非肿瘤结肠病患者56例(良性疾病组),以门诊行健康查体50例为健康对照组。结肠癌组男68例,女36例,年龄38~76(59.2±7.0)岁。良性疾病组男37例,女19例,年龄41~77(59.5±6.8)岁。健康对照组男35例,女15例,年龄40~78(60.5±6.3)岁。3组受试者性别、年龄比较差异无统计学意义(P>0.05),具有可比性。本研究经医院伦理委员会审核批准通过(伦批号:2018-HN-0032),受试者及家属知情同意并签署知情同意书。
1.2 结肠癌组病例选择标准 (1)纳入标准:①初次发现;②结肠癌诊断符合“中国结直肠癌诊疗规范”标准[8];③术前无肿瘤治疗史。(2)排除标准:①临床病理及随访资料不完整;②有其他恶性肿瘤史;③合并结直肠的急慢性感染性疾病。
1.3 观测指标与方法
1.3.1 血清miR-221-3p、miR-376c-3p基因表达检测:取各组受试者晨起空腹肘静脉血约5 ml,静置30 min,离心取上层血清进行检测。应用总RNA提取试剂盒(北京索莱宝公司)检测血清总RNA水平,以Narodrop1000检测RNA浓度后,按逆转录试剂盒说明书(北京索莱宝公司)进行逆转录。将产物cDNA进行荧光定量PCR反应。miR-221-3p、miR-376c-3p及内参U6引物序列见表1。总体系20 μl,包括模板1 μl,引物2 μl,Master Mix 10 μl,ddH2O 7 μl。反应程序:95℃ 3 min、95℃ 20 s、60℃ 15 s,共40个循环。结果以2-ΔΔCt值法表示。以miR-221-3p、miR-376c-3p表达量的平均数5.43、6.17为界,分为高表达亚组和低表达亚组。
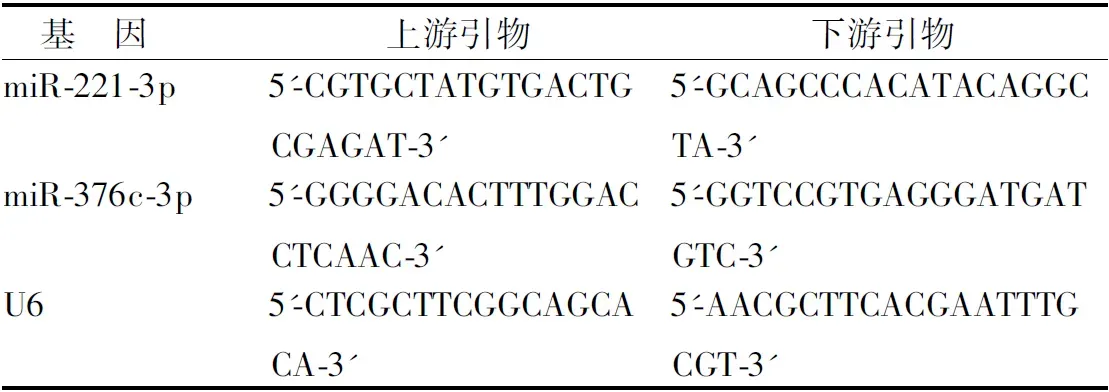
表1 miR-221-3p、miR-376c-3p基因检测引物序列
1.3.2 随访情况:结肠癌患者自出院后开始随访,每个月进行一次电话随访,随访时间36个月,随访截止至2021年5月31日,随访终点为患者死亡或随访时间结束。随访患者生存等情况。

2 结 果
2.1 3组血清miR-221-3p、miR-376c-3p表达比较 血清miR-221-3p、miR-376c-3p水平比较,结肠癌组>良性疾病组>健康对照组,差异均有统计学意义(P<0.01),见表2。

表2 3组血清miR-221-3p、miR-376c-3p表达比较
2.2 结肠癌患者血清miR-221-3p、miR-376c-3p表达的相关性 Pearson线性相关分析结果显示,血清miR-221-3p与miR-376c-3p表达呈正相关(r=0.567,P=0.000)。
2.3 血清miR-221-3p、miR-376c-3p表达在不同临床/病理特征中比较 结肠癌Duke分期C~D期、肿瘤低分化及有淋巴结转移患者血清miR-221-3p、miR-376c-3p表达均高于Duke分期A~B期、肿瘤高中分化及无淋巴结转移患者(P均<0.01),而在患者性别、年龄及肿瘤大小中比较差异无统计学意义(P均>0.05),见表3。

表3 结肠癌患者血清miR-221-3p、miR-376c-3p表达在不同临床/病理特征中比较
2.4 血清miR-221-3p、miR-376c-3p表达对结肠癌预后的影响 104例结肠癌患者随访3~36(21.1±4.3)月,死亡61例,3年生存率为41.3%(43/104)。Kaplan-Meier生存分析结果显示,血清miR-221-3p高表达亚组患者3年总体生存率为21.1%(11/52),明显低于低表达亚组的61.5%(32/52),差异有统计学意义(χ2=7.134,P=0.000);血清miR-376c-3p高表达亚组患者3年总体生存率为23.5%(12/51),低于低表达亚组的58.5%(31/53),差异有统计学意义(χ2=5.736,P=0.002),见图1。
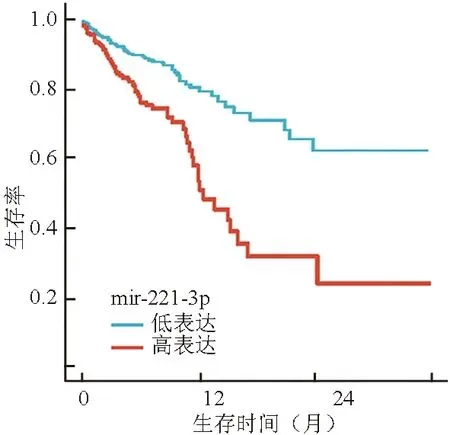
图1 不同血清miR-221-3p、miR-376c-3p表达结肠癌患者生存曲线
2.5 血清miR-221-3p、miR-376c-3p表达对结肠癌患者预后分析 以结肠癌患者生存预后为因变量(1=死亡,0=存活,t=生存时间),纳入miR-221-3p(赋值1=高表达,0=低表达)、miR-376c-3p(赋值1=高表达,0=低表达)为自变量,COX分析结果显示,血清miR-221-3p、miR-376c-3p高表达是影响结肠癌预后的危险因素,见表4。

表4 影响结肠癌患者预后的危险因素分析
3 讨 论
目前结肠癌是常见的消化系统恶性肿瘤,近年来其发病率有逐渐升高的趋势[9]。随着分子生物学的进步,研发出新的靶向治疗药物,如酪氨酸激酶抑制剂等,一定程度上可改善结肠癌患者的生存预后[10]。肿瘤分期、肿瘤分化及淋巴转移均是影响结肠癌预后的危险因素。但结肠癌是一种异质性较高的肿瘤,临床上发现,相同肿瘤Duke分期的结肠癌患者对治疗的敏感性不一致,部分患者存在治疗抵抗,并快速发生肿瘤进展转移[11]。深入研究结肠癌的发病机制,寻找影响肿瘤细胞恶性生物学行为的关键基因,对于结肠癌患者的预后判断及个体化治疗选择,具有重要意义。
miRNAs是长度介于20~25个核苷酸的无蛋白编码功能的调节分子,通过参与构成RNA诱导的沉默复合物发挥调控靶基因表达的功能。以往被认为是细胞内的“转录垃圾”,随着近年来研究的深入,发现miRNAs不仅参与人类正常的生长发育、衰老等过程,还在心血管疾病、肿瘤及炎性反应等人类多种疾病中发挥重要调节功能[12-15]。近年来研究表明,多种肿瘤中存在大量miRNAs如miR-221-3p、miR-376c-3p等的表达异常,并能够通过调控下游癌基因或抑癌基因的表达,影响肿瘤的进展[16-18]。miR-221-3p编码基因位于Xp11.3,研究表明,miR-221-3p在宫颈癌、肝癌等多种恶性肿瘤表达上调[4-5,19],作为促癌基因发挥肿瘤促进的功能。本研究中,结肠癌患者血清中miR-221-3p过表达。目前结肠癌中尚无研究报道miR-221-3p表达上调的机制。但miRNA的活性及功能往往受到上游长链非编码RNA(LncRNA)的调控,因此,推测miR-221-3p的高表达可能与LncRNA的表达异常有关。Chen等[20]报道,LncGAS5能够作为内源性竞争RNA,作为分子支架结合并抑制miR-221-3p的表达,肿瘤中LncGAS5的表达降低导致miR-221-3p显著升高,激活下游Wnt信号通路,促进肿瘤细胞增殖、迁移和侵袭。此外,本研究发现,血清miR-221-3p高表达与结肠癌Duke分期(C~D)、低分化程度及淋巴结转移有关,提示高表达miR-221-3p促进结肠癌进展。miR-221-3p生物学功能的发挥主要是通过调控下游基因的表达实现的。如肿瘤细胞高表达miR-221-3p通过外泌体释放到肿瘤微环境中,通过抑制血小板反应蛋白-2的表达,促进肿瘤血管新生,导致肿瘤发生转移[4]。此外,尚有学者证实[21],miR-221-3p参与调控多种癌基因表达,肿瘤发生时miR-221-3p表达水平上调,导致下游靶基因SOCS3下调,从而通过JAK/STAT信号通路促进肝癌细胞增殖、迁移和侵袭,抑制细胞凋亡,促进肿瘤的恶性进展。鉴于miR-221-3p高表达与不良的临床病理参数有关,miR-221-3p高表达可能影响患者生存预后。生存曲线分析发现,miR-221-3p高表达的结肠癌患者生存预后较差,多因素COX分析结果进一步证实,血清miR-221-3p高表达是患者不良生存预后的独立危险因素。因此,结肠癌患者血清miR-221-3p高表达参与肿瘤恶性进展,是判断结肠癌患者不良预后的标志物。
miR-376c-3p的编码基因位于14q32.31。以往报道表明,miR-376c-3p在不同的人类恶性肿瘤中发挥不同的生物学功能,具有肿瘤的特异性,如miR-376c-3p在乳腺癌、口腔鳞癌中表达上调,通过调控RAN2A的表达,促进肿瘤细胞的干性维持,促进肿瘤细胞的增殖和侵袭[7,22]。本研究中,结肠癌患者血清中miR-376c-3p高表达。其表达上调的机制尚不清楚,有学者发现,肿瘤中miR-376c-3p的表达受到环状RNA PIP5K1A的表达调控,环状RNAPIP5K1A能够与 miR-376c-3p结合,提高miR-376c-3p的稳定性,两者协同促进下游癌基因锌指蛋白146的表达,促进肿瘤进展[23]。本研究发现,miR-376c-3p高表达与不良的临床病理特征包括肿瘤Duke分期(C~D)、低分化程度及淋巴结转移有关,提示miR-376c-3p表达促进结肠癌的恶性进展。有学者在胃癌研究中发现,SYF2作为一种G1/S期转换的抑制性调节因子,具有抑制细胞增殖的作用,miR-376c-3p通过靶向抑制mRNA剪接因子SYF2的表达,促进肿瘤细胞的进展[6]。此外,miR-376c-3p通过靶向HOXB7促进肿瘤细胞的裂变、增殖、迁移和侵袭,并抑制肿瘤细胞的凋亡,进而导致恶性肿瘤的进展[22]。本研究进一步分析结肠癌中miR-376c-3p表达的临床预后价值,结果发现miR-376c-3p高表达的结肠癌患者生存预后较差,并且是结肠癌患者不良生存预后的独立危险因素,表明miR-376c-3p是一种新的判断结肠癌预后的肿瘤标志物。临床上可以根据血清miR-376c-3p表达水平对结肠癌患者的预后进行评估预测,进而选择个体化的治疗方案,以提高临床治疗效果。
肿瘤中存在大量miRNA表达上调或下调,形成复杂的调控网络,影响疾病进展。本研究中,结肠癌患者血清miR-221-3p与miR-376c-3p表达呈正相关。分析其机制,可能与两者在结肠癌中发挥协同作用有关。Yang等[24]报道,miR-221-3p能够通过靶向抑制抑癌基因Bcl-2的表达,而促进促癌基因Bad的表达,抑制肿瘤细胞凋亡,促进肿瘤进展。Zhang等[25]研究发现,miR-376c-3p通过LINC00152,能够促进调控下游Bcl-2的表达,进而抑制肿瘤凋亡的发生。因此,miR-221-3p和miR-376c-3p在调控肿瘤细胞凋亡过程中可能发挥协同作用。但两者的具体作用机制仍有待深入探索。
综上所述,结肠癌患者血清中miR-221-3p、miR-376c-3p表达升高,miR-221-3p与miR-376c-3p表达之间呈正相关。血清miR-221-3p、miR-376c-3p表达与肿瘤分期、分化程度及淋巴转移有关,是新的结肠癌预后判断的分子标志物。
利益冲突:所有作者声明无利益冲突
作者贡献声明
王晓燕:设计研究方案,实施研究过程,论文撰写;肖超:提出研究思路,分析试验数据,论文审核;肖佑:资料搜集整理,实施研究过程;潘燎、肖戈:实施研究过程,参与撰写
