子宫内膜癌组织LncRNACARLo-5、CDK2、CDKN1A表达及临床意义
2021-11-22刘艳红李虎杨翔郑玮
刘艳红,李虎,杨翔,郑玮
子宫内膜癌(endometrial cancer,EC)是常见的女性生殖系统肿瘤,发病率占女性恶性肿瘤的第8位[1]。近年来,随着早期诊断及影像技术的发展,EC发病率呈逐渐上升的趋势[2]。EC的治疗方式以手术为主,以化疗、内分泌治疗及免疫治疗为辅。目前EC患者的总体生存率无显著升高,患者由于肿瘤复发、转移导致生存预后不良[3]。EC发生机制与癌基因的异常激活或抑癌基因的失活有关。长链非编码RNA(LncRNA)结肠癌相关转录本1(colon cancer associated transcript 1,CARLo-5)基因位于8q24.21,参与正常细胞的分化发育等生物学过程。近年来发现,LncRNACARLo-5通过影响下游癌基因的表达,促进结直肠癌及卵巢癌等肿瘤的进展,导致肿瘤耐药性的形成[4-5]。细胞周期蛋白依赖性激酶2 (cyclin-dependent kinase 2,CDK2)编码的蛋白是细胞周期蛋白依赖性蛋白激酶复合物的催化亚基,它调节细胞周期的进程,促进G1到S期的转变。 CDKN1A是一种 G1细胞周期进程的负性调节因子,介导p53依赖的细胞周期G1期阻滞。CDK2和CDKN1A的表达失衡在人类多种肿瘤中亦较为常见[6-7]。本研究通过检测EC患者肿瘤组织中LncRNACARLo-5、CDK2及CDKN1A的表达,初步探讨其临床意义,报道如下。
自适应天线阵列亦称为智能天线[1],它的工作过程为不断地调整权值,使其快速地收敛于当前的最优解。把用来调整权值的算法,称为自适应波束形成算法,它是此天线系统的核心,是决定系统性能的关键因素,也是进行智能天线阵列一系列研究的重点和关键。
1 资料与方法
1.1 临床资料 选取2016年1月—2018年1月广州市番禺区中心医院妇科诊治EC患者80例,术中取癌组织及癌旁组织(距癌组织边缘>2 cm)置于液氮中备用。患者年龄28~71(51.4±10.1)岁;组织学类型:子宫内膜样腺癌52例,黏液/浆液性腺癌28例;肿瘤大小:≤5 cm 49例,>5 cm 31例;组织分化程度:高中分化55例,低分化25例;FIGO分期:Ⅰ~Ⅱ期56例,Ⅲ~Ⅳ期24例;肌层浸润深度:浅肌层(<1/2)58例,深肌层(≥1/2)22例;伴淋巴结转移12例,不伴淋巴结转移68例。本研究经医院伦理委员会标准,患者或家属知情同意并签署知情同意书。
1.2 病例选择标准 (1)纳入标准:①病理学检查明确为EC;②临床及随访资料完备,患者能够配合治疗随访;③首次诊治,术前无肿瘤治疗史。(2)排除标准:①有严重的基础疾病;②合并其他恶性肿瘤;③患者处于妊娠期或哺乳期。
结合实际所需的冷热负荷,控制和调整空调系统的风水系统,设定设备的冷热温度,确保整个系统达到最佳运行目标。
LncRNA是一种无蛋白编码功能的长链核苷酸分子,参与正常细胞周期和程序性细胞死亡的调控过程。LncRNACARLo-5又称为CCAT1,是长度为2.6 kb的LncRNA。LncRNACARLo-5不仅参与调节细胞内染色体相互作用,还可以作为微小RNA的分子海绵,调控下游基因的表达[11-12]。LncRNACARLo-5作为一种致癌基因可促进肿瘤发生。研究发现,LncRNACARLo-5在结直肠癌中表达显著升高,并促进结肠癌细胞的增殖和侵袭,且发现该LncRNA的过表达是患者预后不良的标志[13]。本研究中,EC患者癌组织中LncRNACARLo-5表达显著上调,与Zhao等[14]学者报道结果一致。提示LncRNACARLo-5作为一种促癌基因,可促进EC的恶性进展。肿瘤中LncRNACARLo-5的表达受到多种癌基因的表达调控,如肿瘤发生时癌基因c-myc表达显著上调,而c-myc能够结合到LncRNACARLo-5启动子区域的E-盒区域,促进LncRNACARLo-5的表达[15]。本研究发现,LncRNACARLo-5高表达患者的肿瘤临床分期较高、深肌层浸润及淋巴结转移,表明EC中LncRNACARLo-5参与促进EC的疾病进展。既往在细胞实验研究中发现,LncRNACARLo-5能够通过诱导CDK的表达,促进肿瘤细胞G0期向G1期的转换,导致肿瘤细胞过度增殖;此外,LncRNACARLo-5能够诱导肿瘤细胞上皮间质转化过程的转录因子如snail、Twist等的表达,导致下游基质金属蛋白酶2/9表达增加,促进细胞外基质的降解,引起肿瘤细胞侵袭及转移能力增强,导致肿瘤进展[14]。本研究中EC癌组织LncRNACARLo-5高表达患者生存预后较差,表明LncRNACARLo-5高表达提示EC患者的不良生存预后。因此,LncRNACARLo-5是判断EC患者预后的肿瘤标志物,针对LncRNACARLo-5的治疗可能有助于改善EC患者的生存预后,值得深入研究[16]。
1.3.1 组织LncRNACARLo-5表达检测:采用实时荧光定量PCR(qRT-PCR)检测。取癌组织及癌旁组织各约50 mg,液氮中研钵研磨,按Trizol法提取组织RNA,DEPC水溶解,微量分光光度计(Narodrop2000,美国赛默飞公司)鉴定RNA浓度及纯度。以RNA为模板进行反转录,反转录为cDNA,然后进行qRT-PCR反应。反应体系为模板cDNA 1 μl,2×SYBR Green Mix 5 μl,ROXⅡ 0.2 μl,上游和下游引物各0.5 μl,无RNA酶水2.6 μl。反应条件为:94℃预变性4 min,94℃变性30 s,60℃退火34 s,72℃延伸34 s,共40个循环。CARLo-5上游引物:5'-TTTATGCTTGAGCCTTGA-3',下游引物:5'-CTTGCCTGAAATACTTGC-3';内参GAPDH上游引物5'-GAAGGTGAAGGTCGGAGTC-3',下游引物:5'-GAAGATGGTGATGGGATTTC-3'。结果采用2-ΔΔCt法表示,每个样本重复3次,结果取平均值。以LncRNACARLo-5相对表达量的平均值1.12为界,分为LncRNACARLo-5高表达40例和低表达40例。
1.3.2 组织CDK2和CDKN1A表达检测:采用免疫组化检测。取癌组织及癌旁组织福尔马林固定24 h,石蜡包埋,切片后70℃烤片2 h;二甲苯脱蜡后梯度乙醇水化;pH 6.8柠檬酸缓冲液进行抗原热修复;自然冷却至室温后,双氧水去除内源性过氧化物酶;一抗孵育过夜 (CDK2稀释比1∶200,CDKN1A稀释比1∶500,CDK2、CDKN1A抗体购自Abcam公司);二抗室温孵育2 h,DAB显色20 s,苏木素复染10 s,盐酸酒精分化3 s,梯度乙醇脱水封片。染色结果以染色强度评分和染色面积评分乘积表示[8],染色强度评分:无着色为0分,浅棕色 1分,深棕色2分;染色面积评分:面积≤25%为1分,25%<面积≤50%为2分,面积>50%为3分。结果≥4分判定为高表达,评分<4分为低表达,其中CDK2高表达35例,低表达45例;CDKN1A高表达33例,低表达47例。
为了弄清楚蒸汽本身的安全风险,英国伯明翰大学研究人员设计了一种可以模拟电子烟蒸汽的装置,并可以产生蒸汽冷凝液。随后,研究人员从八名健康的非吸烟人士肺部提取了肺泡巨噬细胞,并将这些细胞分别暴露在普通电子烟液体、有尼古丁和没有尼古丁的人工蒸汽冷凝液中。
1.3.3 随访:以门诊或电话随访3年,内容包括患者生存情况、疾病进展情况,随访自确诊之日开始,截止日期为2021年2月1日,随访截止至患者死亡或随访时间结束。

2.4 LncRNACARLo-5、CDK2及CDKN1A表达与患者生存预后关系 EC患者80例随访过程中失访2例,死亡14例,3年总体生存率(OS)为82.1%(64/78)。EC患者3年OS经Kaplan-Meier分析(log-rank 检验)表明, LncRNACARLo-5高表达患者低于低表达患者,CDK2高表达患者低于低表达患者,CDKN1A高表达患者高于低表达患者(P均<0.05),见表3。
2 结 果
2.1 癌组织及癌旁组织LncRNACARLo-5、CDK2、CDKN1A表达比较 EC患者癌组织LncRNACARLo-5相对表达量高于癌旁组织(P<0.01);癌组织中CDK2棕黄色阳性染色主要位于肿瘤细胞的细胞核,癌组织中CDK2高表达率显著高于癌旁组织(P<0.01);CDKN1A棕黄色阳性染色主要位于腺上皮细胞的细胞核,癌组织中CDKN1A高表达率显著低于癌旁组织(P<0.01),见表1、图1。
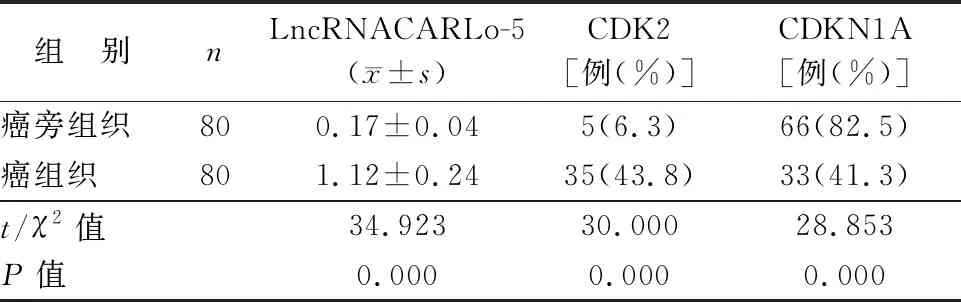
表1 癌组织及癌旁组织LncRNACARLo-5和CDK2、CDKN1A高表达比较

注:CDK2.细胞周期蛋白依赖性激酶2;CDKN1A.细胞周期蛋白依赖性激酶抑制剂1A。箭头代表阳性染色细胞
供水水质对水表计量准确度的影响,体现在两个方面:①水体化学指标含量高,例如pH值在8.0以上,硫酸盐和氯化物的含量在180mg/L以上,会导致管道内部结垢,改变正常的过水流态,继而造成计量偏差[2]。②水体中含有杂质,例如泥沙、丝麻等,随着时间延长,杂质积累数量增多,如果堆积在水孔附近,会减小水孔截面积,因水流速度加快影响计量准确度。
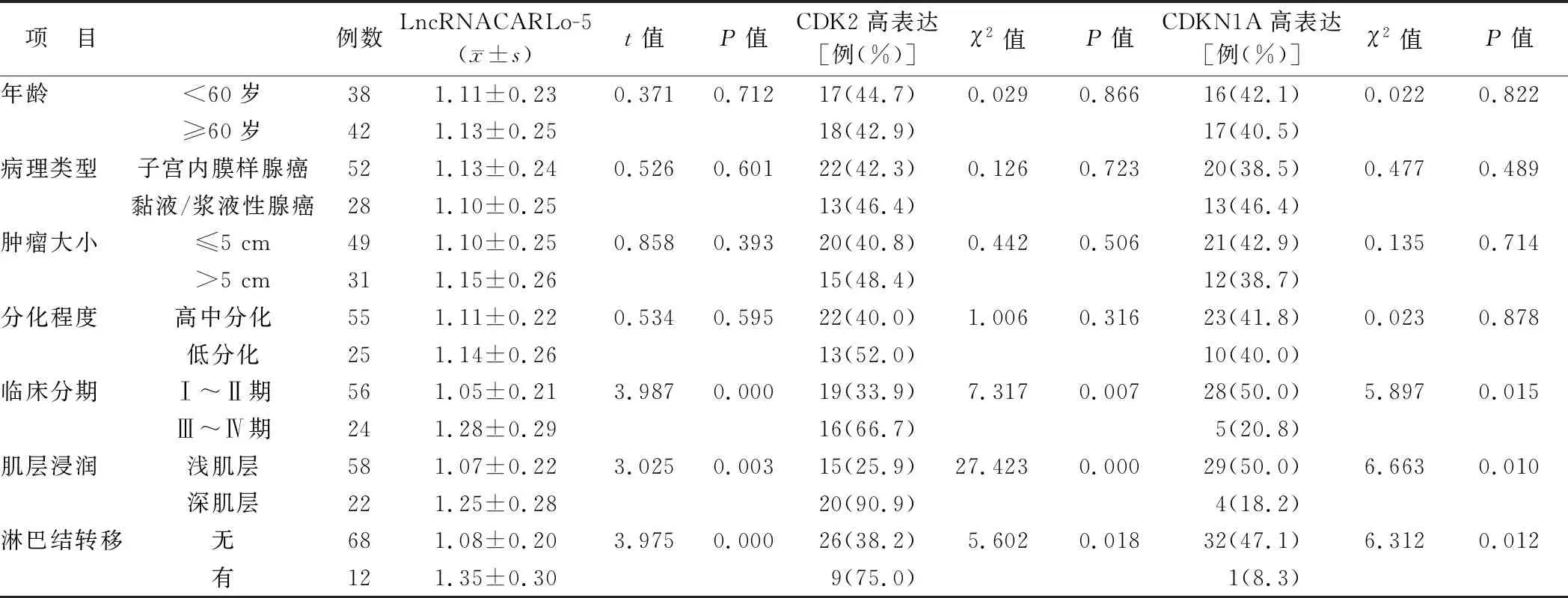
表2 EC患者癌组织LncRNACARLo-5、CDK2及CDKN1A表达在不同临床/病理特征中比较
EC是女性较为常见的生殖系统恶性肿瘤,大约占妇科肿瘤的30%。近年来随着我国人民生活水平的不断提高,EC的发病率和病死率有不断升高的趋势[9]。EC基本治疗包括子宫切除术和双侧附件切除术,对于有高危因素的Ⅰ~Ⅱ期患者可术后予以辅助放疗。对于晚期EC患者,手术加化疗的治疗方案可使EC患者获得最佳疗效。但EC,特别是高级别的EC患者肿瘤具有复发倾向,深入研究EC的诊治方法,对于降低EC复发率,改善我国女性生命质量意义较大。EC发病机制尚不清楚,目前认为,患者一般身体状况、病理分期、组织学分级及治疗方案等因素均是影响患者预后的因素[10]。寻找能够反映EC疾病特征的分子指标,对于EC患者的治疗选择及预后判断具有重要的价值。
在PP的注塑加工过程中,由于机械力、热、氧对材料的作用,PP的分子链断裂产生烷基自由基,由于环境中氧的存在,这些烷基自由基通过链增长、链支化及链终止等反应形成醛、酮、羧酸、酯、γ-内酮、水等小分子物质[1],这些小分子物质会对注塑件的气味、VOC造成很大的影响。但小分子物质在存储过程中会随着时间而衰减[2]。因此,通过对注塑温度和衰减的研究,寻找小分子物质产生和衰减的规律,对车内空气质量的管控有着重要的意义。

表3 LncRNACARLo-5、CDK2及CDKN1A高低表达患者3年OS比较 [例(%)]
2.5 LncRNACARLo-5、CDK2及CDKN1A表达预测子宫内膜癌价值分析 ROC曲线分析结果显示,LncRNACARLo-5、CDK2、CDKN1A及3项联合预测子宫内膜癌的曲线下面积(AUC)分别为0.807、0.775、0.747、0.841,3项联合检测对子宫内膜癌具有较高的诊断价值,见表4、图2。
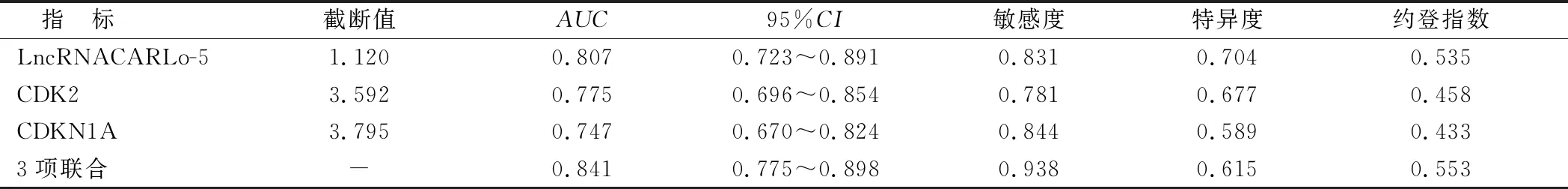
表4 LncRNACARLo-5、CDK2、CDKN1A及3项联合预测子宫内膜癌价值比较
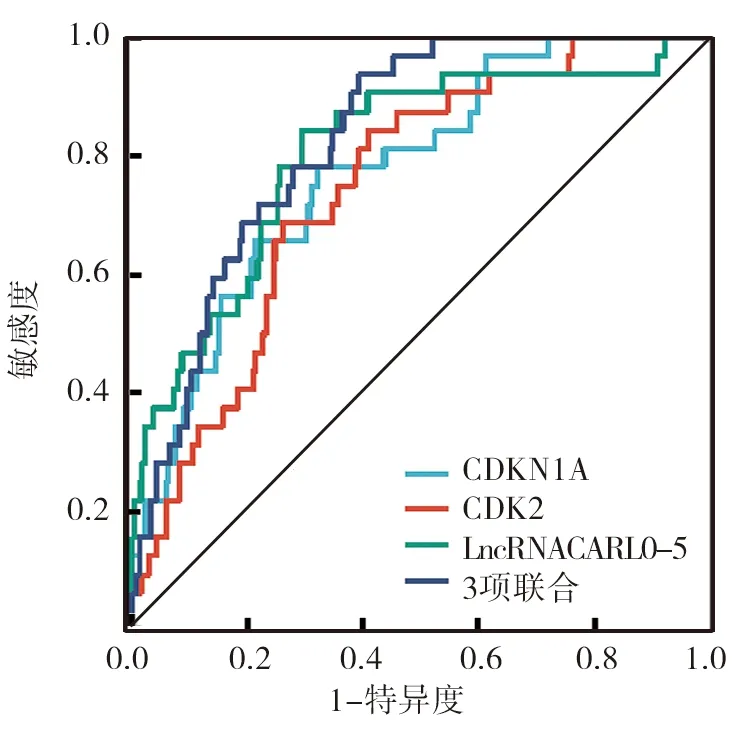
图2 ROC曲线分析LncRNACARLo-5、CDK2、CDKN1A及3项联合检测预测子宫内膜癌价值
3 讨 论
2.3 癌组织LncRNACARLo-5、CDK2及CDKN1A表达的相关性 Spearman秩相关分析显示,癌组织LncRNACARLo-5与CDK2表达呈正相关(r=0.472,P=0.000),与CDKN1A表达呈负相关(r=-0.455,P=0.000)。
1.3 观测指标与方法
2.2 LncRNACARLo-5、CDK2及CDKN1A表达在不同临床/病理特征中比较 EC患者血清LncRNACARLo-5、CDK2及CDKN1A表达在患者不同年龄、病理类型、肿瘤大小及分化程度中比较差异无统计学意义(P均>0.05);而在肿瘤临床分期Ⅲ~Ⅳ期、浸润深肌层及伴淋巴结转移患者中LncRNACARLo-5、CDK2呈高表达,CDKN1A呈低表达(P均<0.05),见表2。
在高中物理知识的学习中,我们应重视基础概念、定理的理解和掌握,结合物理知识之间的关联性,逐渐形成完善的物理知识框架,为自己物理综合能力的提升打下坚实的基础.同时,我们要养成自主思考和探究的习惯,进一步加深自己对各种物理现象的认知,善于对物理习题进行总结,从题型、考查内容等多个角度进行分析,促进自己解题能力的提升,在解题的过程中,要思路清晰、步骤严谨、正确率高,提高自己解题质量,以达到提高自己物理成绩的目的.
肿瘤细胞的恶性增殖与调控细胞周期的因子表达异常密切相关。CDK2属于细胞周期蛋白依赖性激酶家族成员,是一种重要的细胞周期调控因子。CDK2是正常细胞分裂过程完成DNA复制的关键因子,促进G1期向S期的转变并通过结合细胞周期素A调控S期的进程[17]。CDKN1A又称为P21,能够结合细胞周期素—周期素激酶复合物,发挥较强的细胞周期依赖性激酶抑制活性,参与正常细胞增殖、分化等生物学过程。研究表明,肿瘤中CDK2能够发挥阻滞CDKN1A功能的作用,CDK2能够结合细胞周期蛋白E1,形成磷酸化CAK复合物,抑制CDKN1A对Rb的去磷酸化作用,Rb磷酸化后释放E2F,启动细胞周期相关基因的转录[18]。本研究中,EC癌组织中CDK2表达上调,而CDKN1A表达下调,与以往研究报道一致[19]。CDK2与CDKN1A均是调控细胞周期G1/S期转换的重要因子,受Obg样ATP酶1(OLA1)因子的表达调控。研究表明,OLA1能够结合CDKN1A并抑制CDKN1A的表达,激活CDK2的活性,促进肿瘤细胞的增殖,并抑制肿瘤细胞的凋亡[7]。但亦有学者发现[20],除CDKN1A外,CDK2的表达还受到P57的抑制,过表达P57能够抑制CDK2—细胞周期素E1复合体的周期促进功能。因此,EC中CDK2是否受CDKN1A直接调控有待深入机制研究。此外,EC癌组织中CDK2、CDKN1A的表达与肿瘤临床分期、肌层浸润深度及是否伴淋巴结转移有关,提示EC中CDK2、CDKN1A参与EC的肿瘤进展。有学者报道,肺癌中AKT信号通路的激活,能够上调CDK2的表达,下调CDKN1A的表达,促进细胞周期G1/S期的转换,导致肿瘤的恶性进展[21]。本研究还发现,EC癌组织中CDK2高表达、CDKN1A低表达患者生存预后较差。LncRNACARLo-5、CDK2、CDKN1A单独检测诊断EC的AUC为0.807、0.775及0.747,而3项联合检测的AUC达0.841,提高了诊断EC的预测价值。并且与单一指标相比,3项联合检测可提高预测的敏感度,但其特异度低于单一指标检测,表明三者联合检测能够对子宫内膜癌进行初步的鉴别和诊断,为确定诊断提供依据。本研究中EC患者癌组织中LncRNACARLo-5表达与CDK2的表达呈正相关,与CDKN1A的表达呈负相关,提示EC中CDK2及CDKN1A的表达可能受到LncRNACARLo-5的表达调控。LncRNACARLo-5对CDK2、CDKN1A的表达调控可能是通过复杂的非编码RNA调控网络发挥作用的。有研究报道,LncRNACARLo-5作为一种长链非编码RNA,能够作为分子支架结合微小RNA[22],如miR-200b等,进而促进肿瘤恶性进展。而受LncRNACARLo-5调控的微小RNA能够转录后调控CDK2及CDKN1A的表达,进而促进肿瘤进展[23-24]。但LncRNACARLo-5、CDK2及CDKN1A之间具体作用机制有待深入研究。
综上所述,EC患者癌组织中LncRNACARLo-5、CDK2表达上调,而CDKN1A表达下调,LncRNACARLo-5、CDK2及CDKN1A表达与肿瘤临床分期、肌层浸润深度及是否伴淋巴结转移有关,是 EC患者不良生存预后的肿瘤标志物,癌组织中LncRNACARLo-5表达与CDK2表达呈正相关,与CDKN1A表达呈负相关,LncRNACARLo-5可能通过影响CDK2及CDKN1A的表达促进EC的恶性进展,有可能成为新的肿瘤标志物。
利益冲突:所有作者声明无利益冲突
作者贡献声明
刘艳红:设计研究方案,实施研究过程,数据整理,分析实验数据,论文撰写;李虎:提出研究思路,分析试验数据,论文审核;杨翔、郑玮:实施研究过程,资料搜集整理,论文修改,进行统计学分析
