烟草黄瓜花叶病毒亚组Ⅰ分离物生物学特性
2021-01-09申莉莉宋丽云龚明月何青云宋青松王宝剑刘文涛李斌王玉洁蔺忠龙
申莉莉 宋丽云 龚明月 何青云 宋青松 王宝剑 刘文涛 李斌 王玉洁 蔺忠龙




摘 要:对引起花叶狭长及疱斑畸形重症的烟草黄瓜花叶病毒,采用生物学接种、CP基因扩增测序、电镜观察、免疫印迹、荧光定量等方法,研究病毒分离物的株系、粒体形态、致病力、稀释限点、传导路径以及在抗感烟草上的症状。结果显示,分离物外壳蛋白基因长度为657 bp,其核苷酸序列与亚组Ⅱ的代表Q株系同源性为69.83%,与亚组Ⅰ的代表Fny株系同源性为93.00%,介于ⅠA与ⅠB株系之间。病毒粒体球形,直径28~30 nm,对烟草致病力强。病汁液稀释限点为10-5,质量浓度40倍稀释接种后病毒由接种叶移动到主茎后,先向下至根、向上至心叶,再扩散布满全株,最后集中在上部叶。亮黄和G28对其表现高感,病叶狭窄、黄化斑驳、变薄革质化及疱斑畸形;Ti245和铁耙子表现中抗,病叶轻微脉明斑驳。
关键词:烟草;黄瓜花叶病毒;亚组Ⅰ;生物学特性
Abstract: Cucumber mosaic virus (CMV) showing heavy narrow mosaic and enation deformity on tobacco leaf was isolated. The strain, viral morphology, pathogenicity, dilution limit concentration, transmission route and symptoms on resistant and susceptible tobacco were studied via biological inoculation, CP gene sequencing, electron microscopy, western blot and qRT-PCR. The results showed that the 657 bp coat protein gene shared 69.83% homology to CMV group Ⅱof Q strain, 93.00% identity to CMV groupⅠof Fny strain, which were between ⅠA andⅠB strains. The virus particles were spherical, about 28-30 nm in diameter. It showed strong pathogenicity to tobacco. The dilution limit concentration of disease juice was 10-5 in vitro. After inoculation with 40 times dilution on tobacco, CMV systemically spread from inoculated leaf to stem, first down to root and up to heart leaf, then to whole plant, finally continued to upper new leaves. Bright yellow and G28 were susceptible, showing heavy narrow and yellow mosaic, leathery and distorted leaves. Ti245 and Tiepazi were moderate resistance, showing vein clearing and mild mosaic.
Keywords: tobacco; cucumber mosaic virus; subgroupⅠ; biological characteristics
黃瓜花叶病毒(cucumber mosaic virus,CMV)是雀麦花叶病科(Bromoviridae)黄瓜花叶病毒属(Cucumovirus)的代表种,是由RNA1、RNA2、RNA3组成的三分体正义单链RNA病毒。CMV严重危害我国烟叶生产,烟草苗期和成株期均可感染,以大田成株期发病较多,且CMV往往与其他病毒混合发生严重,烟草产量损失巨大[1-2]。
CMV不同株系或分离物其寄主范围不同,侵染同一寄主表现的症状存在一定差异。根据外壳蛋白(coat protein,CP)同源性可将其分为亚组Ⅰ和亚组Ⅱ[3],根据RNA3的5'非编码区将亚组Ⅰ分为ⅠA和ⅠB[4-6]。亚组Ⅱ接种烟草引起温和的系统斑驳和接种叶上出现坏死斑纹,亚组Ⅰ导致严重的系统花叶畸形,但不引起坏死斑纹[7]。
研究表明,RNA2是决定不同分离物存在寄主相关的致病性分化的主要区段[8]。RNA2编码的2a蛋白是引起细胞坏死反应的重要因子,第631位氨基酸突变可导致豇豆上的坏死反应消失[9-10];2a蛋白C端缺失会降低病毒在寄主体内的含量,减轻在烟草上的致病症状[11]。此外,RNA3编码的CP严重影响叶绿体光系统Ⅱ,与花叶症状的产生直接相关[12]。例如,M株系侵染烟草引起严重的黄白化,Fny株系侵染烟草引起绿斑驳;通过两者RNA3不同区域重组试验,发现花叶斑驳症状由CP上第129位氨基酸所决定[4, 12]。
病毒不同株系致病症状和发病程度受寄主抗性和侵染后环境条件影响。通常利于烟株生长的温度也利于病毒增殖,高温条件下叶部常发生隐症[1]。CMV在寄主上引起的症状与摩擦接种时的温度有关,亚组Ⅱ在高于26 ℃时侵染烟草不产生系统症状,而低于26 ℃时会产生叶片黄化[3];亚组Ⅱ分离物接种三生烟(Nicotiana tabacum)症状温和,但其症状和致病性受温湿度和光照强度影响[14]。强致病性株系M能引起烟草叶片完全黄化,但具有症状恢复现象,机制尚不明确[13]。
山东青岛烟草CMV典型症状为斑驳黄化、花叶狭长及疱斑畸形,严重降低烟叶产量和品质。为明确该地区CMV株系,阐明其在烟株体内的系统扩散时程,采集该CMV病叶进行了分离纯化、株系鉴定和生物学特性研究,以期为该病害的防治提供理论支持。
1 材料与方法
1.1 供试植物、病毒和检测试剂盒
枯斑寄主苋色藜(Chenopodium amaranticolor)用于病毒分离纯化和稀释限点检测;系统寄主三生NN烟(N. tabacum var. Samsun NN)、本氏烟(N. benthamiana)、K326、Ti245、铁耙子、亮黄、G28用于病毒扩散时程和致病性测定。
荧光定量、聚丙烯酰胺凝胶电泳及免疫印迹等试剂购自TaKaRa公司,CP抗体购自美国Agdia公司,Actin抗体购自北京CWBIO公司,引物(表1)合成及测序由青岛派森诺基因科技有限公司完成。
1.2 CMV纯化保存及株系鉴定
于发病初期,采集青岛即墨试验地花叶狭长及疱斑畸形的烟草CMV病叶,于灭菌的研钵中研磨成病汁液,用TMV、CMV和PVY免疫胶体金试纸条检测,排除混合侵染样品后,汁液摩擦接种苋色藜,于26 ℃/16 h光照下培养5~7 d。抠离单斑,研磨成汁液接种在三生NN烟上活体保存[14]。田间系统调查于团棵期至旺长期进行[15]。
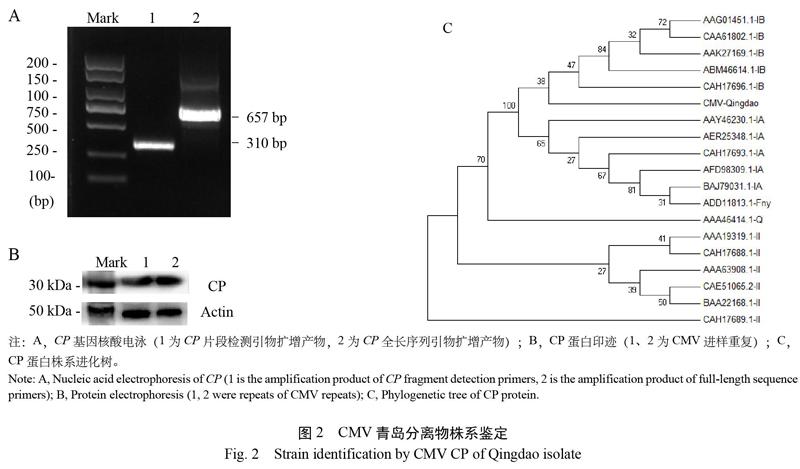
提取病叶总RNA,以CMV CP-F1和CMV CP-R1为引物,扩增CP全序列。测序后提交NCBI比对病毒株系并制作系统进化树。提取病叶总蛋白,进行聚丙烯酰胺凝胶电泳和免疫印迹,檢测CP条带[16]。
1.3 CMV形态及提纯液侵染力测定
采用聚乙二醇法提纯CMV[1],测定OD280计算病毒提纯液的浓度,聚丙烯酰胺凝胶电泳检测CP纯度,负染法透射电镜观察病毒形态[16]。提纯液用PBS稀释10、20倍,摩擦接种4~5叶期亮黄上部两片展开叶,记录病症。
1.4 CMV病汁液稀释限点测定
取在三生NN烟上活体保存35 d的上部展开病叶,研磨并用PBS稀释成10-1~10-6系列质量浓度,接种苋色藜,测定稀释限点[16]。
1.5 CMV在烟草上的扩散时程观测
在5~6叶期单盆单株本氏烟和K326上,接种质量浓度40倍稀释的CMV,26 ℃培养。定株拍照记录发病时程。另于接种后4、8、12、16 d取各部位组织,采用荧光定量PCR检测CP表达量[16]。
1.6 CMV对不同烟草品种的致病性观测
Ti245、铁耙子、G28、亮黄于30孔联体育苗盘假植,26 ℃培养至5~6叶期。在其上部两片展开叶上摩擦接种40倍稀释的CMV。接种后21 d逐株判定发病级别并记录抗感差异[17]。
2 结 果
2.1 CMV田间症状和纯化保存
田间系统调查显示,团棵期CMV发病率达10%,显著低于TMV和PVY,但0~9级发病级别均有发现。病叶典型症状有:花叶狭长、斑驳黄化,变薄革质化,疱斑耳突、扭曲畸形,叶基伸长、叶尖细长呈鼠尾状,严重时叶肉组织变窄甚至消失,仅剩主脉而呈线条叶,病株矮化、发育不良。此外,中下部叶还可表现沿主、侧叶脉的深褐色闪电状坏死斑纹,也称“橡叶纹”。
取CMV黄化狭长及疱斑畸形病叶,研磨汁液摩擦接种在苋色藜上,26 ℃培养5~7 d,接种叶出现过敏性坏死反应枯斑;接种三生NN和K326表现系统花叶,在本氏烟上表现心叶皱缩和植株矮化(图1)。
2.2 CMV株系鉴定
CMV CP扩增产物测序大小为657 bp(图2),命名为青岛分离物CMV-Qingdao。比对显示,CMV-Qingdao与亚组Ⅱ的代表Q株系同源性仅为69.83%;与亚组Ⅰ的代表Fny株系同源性为93.00%,介于ⅠA和ⅠB株系之间,与ⅠA株系同源性为92.09%~94.04%,与ⅠB株系同源性为91.28%~93.27%。提取病叶总蛋白,免疫印迹到一条24 kDa的单一条带,与CMV CP大小一致。
2.3 提纯CMV的形态和侵染力
100 g病叶提纯获得10 mL浓度为0.266 mg/mL的病毒提纯液。电镜下观察到直径28~30 nm的正二十四面体(近球形)病毒粒体,中心有致密电子云。提纯液在聚丙烯酰胺凝胶电泳上显示单一的CP条带;由于是来自病叶的粗提纯液,因而迁移减慢使表观分子量略大于CP分子量24 kDa。提纯液接种在感病烟草亮黄上7~15 d,上部叶表现花叶疱斑和变薄革质化,病株矮化,且高浓度处理发病较重(图3)。
2.4 CMV病汁液稀释限点
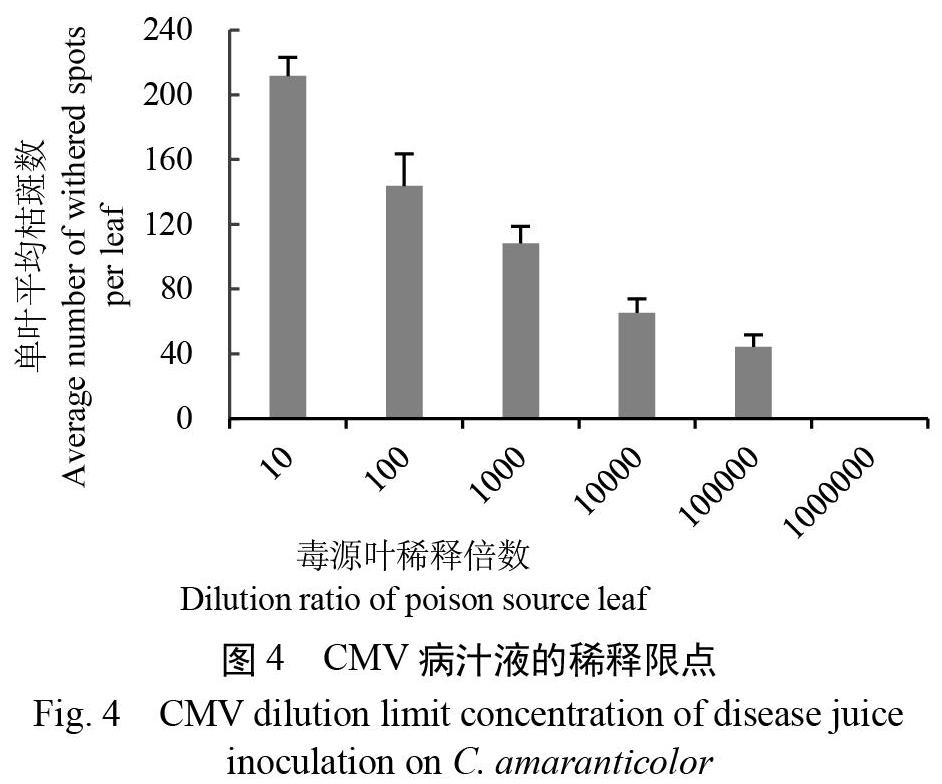
图4显示:枯斑数量随稀释倍数的增加而显著降低,10-6稀释液接种时多数处理叶片已无侵染点枯斑,因此稀释限点为10-5,接种物浓度以不低于10-2为宜。此外,随保存时间的延长,需要定期对毒源进行转接复壮。
2.5 CMV在烟株上的症状发展和移动路径
5~6叶期本氏烟接种40倍稀释的CMV后5~11 d,最先显症的是心叶,随之为心叶下叶,最后呈簇顶状皱缩,显著矮化(图1E)。接种在K326上7~21 d,初始心叶上出现脉明褪绿、黄绿相间的斑驳;随之叶片黄化、变薄革质化,叶基伸长、叶尖细长;最后疱斑畸形,顶芽矮缩(图1D)。及时施肥,心叶会相对长开,出现烟株生长伴随花叶显症的现象。
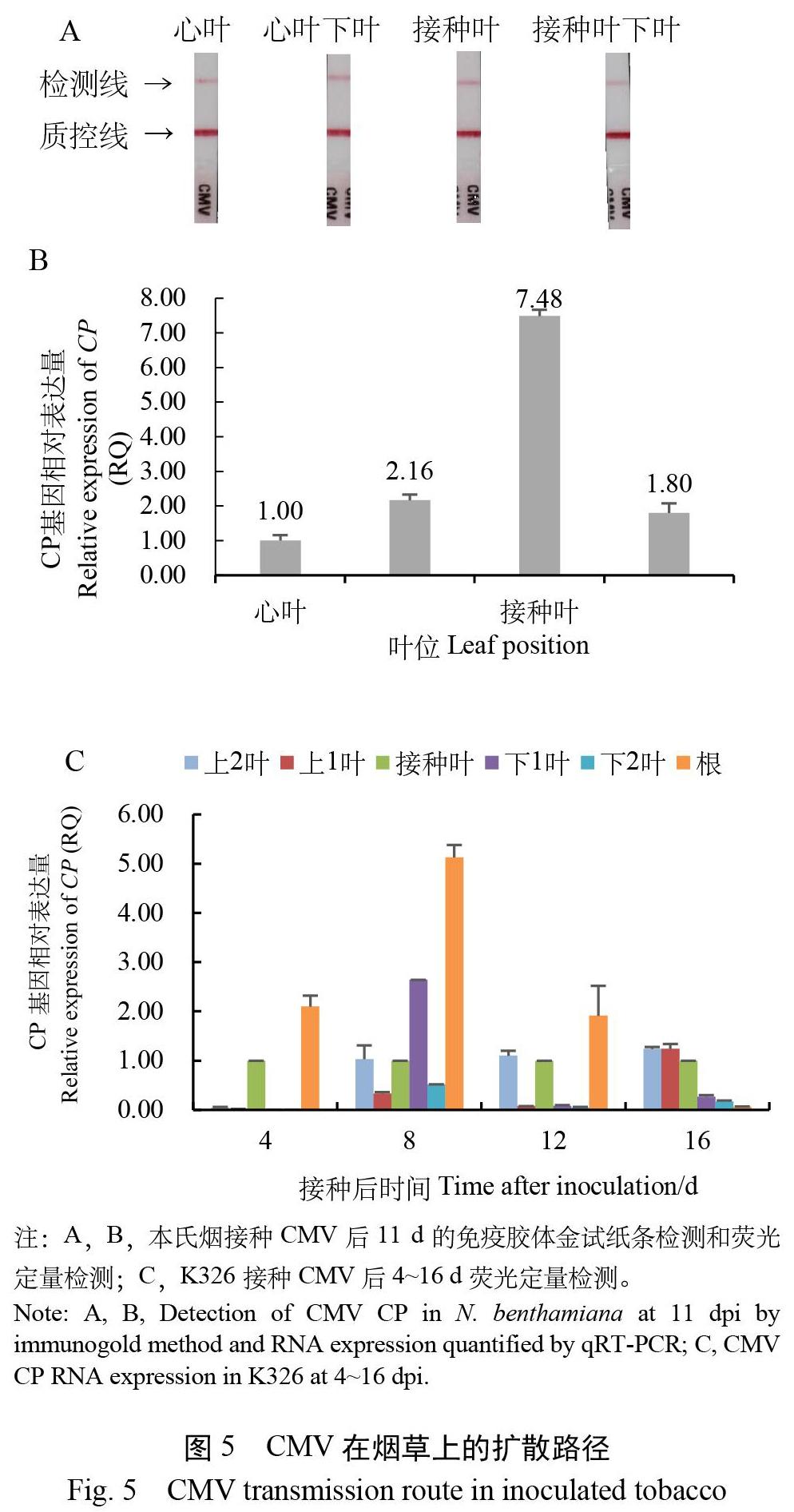
本氏烟接种40倍CMV后11 d,取同质量的心叶、心叶下叶、接种叶和接种叶下叶,制备相同质量浓度的病汁液。试纸条检测均显示明显的阳性条带,无法从亮度上区分含量高低(图5A)。荧光定量检测CP表达量显示:相对于心叶(病毒含量1.00),接种叶含量最高(7.48),其次是心叶下叶(2.16)和接种叶下叶(1.80)(图5B)。
K326于接种CMV后4、8、12、16 d,取各部位(接种叶上2叶、接种叶上1叶、接种叶、接种叶下1叶、接种叶下2叶、根)组织,相对于接种叶的CP表达量检测显示,第4天在根部、接种叶、上2叶中检测到CMV,说明病毒由接种叶到达茎后,先向下至根部。第8天各部位均检测到病毒,积累量排序为:上1叶<下2叶<接种叶<上2叶<下1叶<根,说明病毒在根部大量积累且开始向上运输至顶端。第12天积累量排序为:下2叶<下1叶<上1叶<接种叶<上2叶<根,说明病毒由根部向上运输旺盛。第16天积累量排序为:根<下2叶<下1叶<接种叶<上1叶<上2叶,说明病毒持续向上部叶运输,集中在顶端(图5C)。
上述移动路径显示病毒从接种叶移动至茎后,先向下至根、向上至心叶,再逐渐扩散布满全株,最后集中在上部叶。
2.6 CMV在不同抗病性烟草上的症状
在即墨温室进行的烟草苗期接种CMV抗性鉴定试验中,接种40倍CMV后21 d调查。T.I.245和铁耙子上部叶表现轻微的脉明和花叶,表现抗病;G28和亮黄表现显著的叶片狭窄、黄化斑驳、变薄革质化及疱斑畸形,表现感病(图6)。
3 讨 论
CMV在烟草上具有较强致病性[1,18]。本文用烟草花叶狭长及疱斑畸形的CMV分离物接种烟草,本氏烟、K326、亮黄、G28等均表现感病(图1、图6)。与本试验同时进行的一组试验表明[19],该病株引起的烟草花叶畸形较TMV重,矮化较PVY重。CMV在体外的抗逆性较TMV差,致死温度为60~75 ℃下10 min[1];室温下病汁液中病毒只能存活3~4 d;稀释限点为10-5(图4),病叶质量浓度40倍稀释使用时较易致病。在K326上接种后4~16 d的扩散路径为接种叶→茎→向下至根、向上至心叶→扩散布满全株,最后集中在上部叶。这一扩散路径与TMV相同[16];但试验中还发现不同培养条件下接种,对症状发展尤其是症状恢复现象有较大影响,营养条件好的单盆单株较30孔联体育苗盘更易出现上部叶隐症现象[19]。
自然界中存在很多CMV株系[20],已报道的株系或分离物有100余种,命名规则尚不统一,存在重复。ⅠB主要发生在中国、朝鲜、韩国、蒙古和日本等,而世界各地都有ⅠA和Ⅱ亚组的分布[12]。我国烟草CMV分离物两个亚组均有分布,以ⅠB株系报道较多。从云南烟草上检测到的CMV分离物与亚组Ⅱ同源性达96%,与亚组Ⅰ同源性仅为75%[21];从我国11个烟草分离物中鉴定出Ⅰ亚组的ⅠA和ⅠB及Ⅱ亚组,存在组间重组事件[22];侵染贵州、四川烟草的分离物主要属于ⅠB[23-24]。本文根据CP序列,发现青岛分离物与Ⅰ亚组Fny株系和Ⅱ亚组Q株系同源性分别为93.00%和69.83%,介于ⅠA与ⅠB株系之间。
重组在RNA病毒变异进化中极其重要,同时侵染同一寄主的不同病毒或株系,如发生重组,会产生适应力较强的变异株系,克服寄主抗性、扩大寄主范围或表现新症状。因此,记录我国烟草主栽品种上CMV的症状类型及其对应的核酸序列和株系种类,有助于监测优势株系的流行变异。
4 结 论
表现病叶狭窄、斑驳黄化、变薄革质化、疱斑畸形和病株矮化重症反应的青岛烟草CMV分离物属于Ⅰ亚组,介于ⅠA与ⅠB株系之间,对烟草致病性强;稀释限点为10-5,病叶质量浓度40倍稀释接种易致病;在K326上接种4~16 d的扩散时程为:病毒从接种叶移动至茎后,先向下至根、向上至心叶,再逐渐扩散布满全株,最后集中在上部叶;后期营养充足利于烟株生长和症状恢复。
参考文献
[1]朱贤朝,王彦亭,王智发. 中国烟草病害[M]. 北京:中国农业出版社,2002.
ZHU X C, WANG Y T, WANG Z F. Tobacco disease of China[M]. Beijing: China Agriculture Press, 2002.
[2]王凤龙,周义和,任广伟. 中国烟草病害图鉴[M]. 北京:中国农业出版社,2019.
WANG F L, ZHOU Y H, REN G W. Illustrated book of tobacco disease in China[M]. Beijing: China Agriculture Press, 2019.
[3]PALUKAITIS P, ROOSSINCK M J, DIETZGEN R G. Cucumber mosaic virus[J]. Advances in Virus Research, 1992, 41: 281-348.
[4]SHINTAKU M H, ZHANG L, PALUKAITIS P. A single amino acid substitution in the coat protein of cucumber mosaic virus induces chlorosis in tobacco[J]. Plant cell, 1992, 4(7): 751-757.
[5]DANIELS J, CAMPBELL R N. Characterization of cucumber mosaic virus isolates from California[J]. Plant Disease, 1992, 76: 1245-1250.
[6]ROSSINCK M J, ZHANG L, HELLWALD K H. Rearrangements in the 5' nontranslated region and phylogenetic analyses of cucumber mosaic virus RNA 3 indicate radial evolution of three subgroups[J]. Journal of Virology, 1999, 73(8): 6752-6758.
[7]ZHANG L, HANADA K, PALUKAITIS P. Mapping local and systemic symptom determinants of cucumber mosaic cucumovirus in tobacco[J]. Journal of General Virology, 1994, 75: 3185-3191.
[8]亓哲. 黃瓜花叶病毒(CMV)不同分离物致病力及种子带毒分析[D]. 泰安:山东农业大学,2019.
QI Z. Analysis of pathogenicity of different isolates of cucumber mosaic virus and its seed-born[D]. Tai’an: Shandong Agricultural University, 2019.
[9]KARASAWA A, OKADA I, AKASHI K, et al. One amino acid change in cucumber mosaic virus RNA polymerase determines virulent/avirulent phenotypes on cowpea[J]. Phytopathology, 1999, 89: 1186-1192.
[10]HU Z Z, ZHANG T Q, YAO M, et al. The 2a protein of cucumber mosaic virus induces a hypersensitive response in cowpea independently of its replicase activity[J]. Virus Research, 2012, 170: 169-173.
[11]DU Z Y, CHEN F F, ZHAO Z J, et al. The 2b protein and the C-terminus of the 2a protein of cucumber mosaic virus subgroup Ⅰstrains both play a role in viral RNA accumulation and induction of symptoms[J]. Virology, 2008, 380(2): 363-370.
[12]田兆豐,于嘉林,刘伟成,等. 黄瓜花叶病毒(CMV)亚组Ⅰ、Ⅱ分离物生物学特性比较研究[J]. 华北农学报,2009,24(5):201-205.
TIAN Z F, YU J L, LIU W C, et al. Comparative study on bio-characteristics of cucumber mosaic virus (CMV) subgroup Ⅰand Ⅱ[J]. Scta Aqriculturae Boreall-Sinica, 2009, 24(5): 201-205.
[13]陈明胜. 黄瓜花叶病毒M株系引致烟草症状恢复的初步研究[D]. 杨凌:西北农林科技大学,2007.
CHEN M S. Primary studies on symptom recovery of tobacco plants infected by cucumber mosaic virus strain M[D]. Yangling: Northwest A & F University, 2007.
[14]申莉莉. CMV诱导烟草内质网应激及调控因子NbbZIP28的研究[D]. 沈阳:沈阳农业大学,2017.
SHEN L L. CMV induces endoplasmic reticulum stress and research of the regulator NbbZIP28 in Nicotiana [D]. Shenyang: Shenyang Agricultural University, 2017.
[15]任广伟,孔凡玉,王凤龙,等. 烟草病虫害分级及调查方法:GB/T 23222—2008[S].
REN G W, KONG F Y, WANG F L, et al. Grade and investigation method of tobacco diseases and insect pests: GB/T 23222-2008 [S].
[16]申莉莉,贾海燕,何青云,等. 毒株、苗龄及温度对烟草苗期接种TMV试验的影响[J]. 植物病理学报,2021,51(4):607-617.
SHEN L L, JIA H Y, HE Q Y, et al. Effects of virus strain, seedling age and temperature in TMV inoculation of tobacco at seedling stage[J]. Acta Phytopathologica Sinica, 2021, 51(4): 607-617.
[17]孔凡玉,王凤龙,张成省,等. 烟草品种抗病性鉴定:GB/T 23224—2008[S].
KONG F Y, WANG F L, ZHANG C S, et al. Identification of cultivar resistance to tobacco disease: GB/T 23224—2008 [S].
[18]邱艳红,王超楠,朱水芳. 黄瓜花叶病毒致病性研究进展[J]. 生物技术通报,2017,33(9):10-16.
QIU Y H, WANG C N, ZHU S F. Research advances on the pathogenicity of cucumber mosaic virus[J]. Biotechnology Bulletin. 2017, 33(9): 10-16.
[19]王静,申莉莉,王秀芳. 烟草主要病虫害严重度分级图谱[M]. 北京:中国农业科学技术出版社,2021.
WANG J, SHEN L L, WANG X F. Severity classification map of major tobacco diseases and insect pests[M]. Beijing: China Agriculture Science and Technology Press, 2021.
[20]MOYLE R, PRETORIUS L S, SHUEY L S, et al. Analysis of the complete genome sequence of cucumber mosaic virus strain K[J]. Genome Announcements, 2018, 6(7). https://doi.org/10.1128/genomeA.00053-18.
[21]李凡,周雪平,戚益军,等. 从云南烟草上检测到的黄瓜花叶病毒亚组II分离物[J]. 微生物学报,2000(4):346-351.
LI F, ZHOU X P, QI Y J, et al. Detection of cucumber mosaic virus subgroup II isolate form tobacco plants in Yunnan province[J]. Acta Microbiologica Sinica, 2000(4): 346-351.
[22]金大伟. 我国主要烟区烟草黄瓜花叶病毒的鉴定及全基因组序列分析[D]. 武汉:华中农业大学,2014.
JIN D W. Identification and complete sequence analysis of cucumber mosaic virus from tobacco in the main tobacco growing areas in China[D]. Wuhan: Huazhong Agricultural University, 2014.
[23]宋丽云. 我国烟草TMV和CMV种群结构遗传分析[D]. 北京:中国农业科学院,2012.
SONG L Y. Phylogeographic analysis of TMV and CMV of tobacco in China[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012.
[24]赵雪君,刘世超,李斌,等. 四川煙区CMV和PVY株系分化研究[J]. 西南大学学报(自然科学版),2017,39(3):8-16.
ZHAO X J, LIU S C, LI B, et al. Study on strain differentiation of CMV and PVY in the main tobacco–planting areas in Sichuan province[J]. Journal of Southwest University (Natural Science Edition), 2017, 39(3): 8-16.
