PK-120表达异常在复发性流产妊娠免疫耐受机制中的作用
2021-11-24张东方
李 兰 陈 燕 张东方
1华北理工大学基础医学院 河北唐山 063210;2华北理工大学附属医院妇产科
复发性流产(recurrent pregnancy loss, RPL)是指连续发生3次或3次以上妊娠23周前的自然流产,大约影响到2%~5%的育龄夫妇[1]。2017 ESHRE报道约40%RPL属于原因不明,而越来越多的证据指出原因不明的RPL可能与免疫因素有关[2]。免疫细胞对母体子宫蜕膜化与胚胎胎盘发育的调控是妊娠建立和维持的关键。影响其平衡调节因素较多,与细胞因子自身、生长因子以及特殊抗原表达均有关[3]。近期我们采用蛋白质组学方法筛选出27个与RPL密切相关的差异蛋白,其中血浆激肽释放酶敏感性糖蛋白-120(Plasma kallikrein sensitive glycoprotein 120, PK-120)是比较典型的差异蛋白之一。PK-120蛋白是924个氨基酸编码的分布于血浆中的糖蛋白(glycoprotein),隶属于胰蛋白酶抑制剂(ITI)家族成员,其在C末端序列中含有激肽释放酶缓激肽样结构域,即具有血浆激肽释放酶敏感性。此外,前期研究表明在不同种类的疾病如乳房癌、卵巢癌、胰腺癌、糖尿病中可检测到与疾病相关的有差异性的PK-120裂解片段,但其确切的分子机制并不清楚[4-6]。PK-120异常表达对妊娠免疫耐受的影响目前尚未见报道。因此,本研究利用人单核细胞(PBMC)、人绒毛滋养层细胞系JEG3,探讨 PK-120siRNA 对促炎细胞因子/抗炎细胞因子(Th1/Th2)免疫应答的影响,并结合基因转染技术,观察比较裂解片段PK-120(F.L.)、PK-120(T.R.)对免疫细胞增殖的影响。同时,利用共培养体系分析PK-120(T.R.)与妊娠免疫耐受的关系,为进一步阐明RPL发病机制提供实验基础。
1 资料与方法
1.1研究对象 2018年1月~2020年1月华北理工大学附属医院妇产科住院的原因不明RPL患者60例,自然流产≥3次。年龄(32.6±5.2)岁;体质量指数(BMI):(26.3±1.7)kg/m2;妊娠(5.3±2.6)次;生育(1.4±0.2)次;既往流产孕(7.8±1.0)周;继发流产(3.6±0.8)次。均为早期流产者,夫妻双方染色体核型正常、Rh血型一致,抗精子抗体阴性;患者子宫发育正常,无中、重度子宫内膜异位;生殖激素正常,妊娠期无病毒感染及其他疾病史,无致畸环境接触史和服药史,无烟酒嗜好,家族无遗传病史。同期收集30例健康女性作为对照组,年龄(31.9±4.5)岁;BMI:(24.8±2.5)kg/m2;妊娠(2.5±1.7)次;生育(1.8±0.6)次,均有正常生育史。受试者均有正常月经周期,并在月经周期排卵后5~9d收集血液样本,静脉血样采集与保管方法如前期研究所述[7]。
1.2主要试剂 JEG3人绒毛膜癌细胞株(ATCC HTB-36)、THP-1人外周血单核细胞系(ATCC TIB-202);RPL患者与对照组血清、PBMC;CD14磁珠分选CD14 + 细胞(MiltenyiBiotec, Germany);高糖DMEM培养基(GIBCO BRL, USA);胎牛血清(GIBCO BRP, USA);质粒DNA构建及鉴定、建立过表达 PK-120细胞株;BD CBA人Th1/Th2/Th17细胞因子试剂盒(BD Biosciences, USA);兔PK-120多克隆抗体(sc-21987, USA);鼠β-actin单克隆抗体(sc-25778, USA)鼠Flag单克隆抗体(Sigma, USA);鼠Myc单克隆抗体(9E10, USA);realtime PCR试剂盒, Lipofectamine 2000及RNAimax(Invitrogen, UK)。
1.3方法
1.3.1细胞培养与分离 JEG3细胞生长于DMEM培养液、PBMC与人THP1细胞生长于RPMI 1640培养液(含10%胎牛血清、1%青霉素和链霉素),置于37℃、5% CO2的培养箱内。采集对照组新鲜外周血,采用Ficoll 密度梯度离心分离PBMC,并按照说明书纯化CD14+细胞(Miltenyi Biotec,Germany)。
1.3.2质粒DNA构建及鉴定 建立过表达PK-120细胞株,采用全基因合成法合成PK-120基因的编码区序列,克隆至带pGEM-T Easy vector 的表达载体。设计合成引物,扩增该基因克隆至pCS4-3Flag载体,采用Lipofectamine 2000、Amaxa cell line nucleofector kit V试剂盒将质粒转染至细胞,G418筛选稳转细胞株。pCS4-3Flag-PK-120(△BKD)的构建利用Over-lapping PCR技术完成。采用Real-time PCR、Western blot和细胞免疫荧光方法判断PK-120高表达效果。
1.3.3流式细胞术检测细胞因子的表达 多色流式细胞仪LSR Fortessa(BD Biosciences, USA)进行检测,利用BD FACSDivaTMsoftware调节仪器电压、补偿及获取细胞样品,每管获取2 × 105个细胞。采用Flowjo 10.0对所得细胞亚群及细胞因子流式数据进行分析。根据说明书用BD CBA Th1/Th2/Th17细胞因子试剂盒检测PBMC及不同条件培养液中细胞因子的活性。
1.3.4Western blot检测 按照实验设计进行诱导干扰或质粒转染至细胞后,提取细胞蛋白,用BCA测定蛋白浓度后,以每个泳道30~50 μg上样,电泳并转膜。将膜放入不同浓度的抗体中(抗PK-120抗体以 1:200稀释;抗Flag与抗 β-actin抗体分别以1:1000 稀释),4℃孵育过夜,二抗羊抗兔IgG-AP、羊抗鼠IgG-AP(1:5000稀释)37℃孵育2h,BCIP/NBP显色剂显色1min。用Image J软件(NIH, V2.1.4.7)对蛋白条带测量光密度值,将目的蛋白条带与相应内参光密度值比作为该蛋白的相对表达量,并进行统计学分析。
1.3.5Real-time PCR检测 提取细胞总RNA测定纯度及浓度,对目的基因进行引物设计合成,见表1。根据说明书,SYBR®Green PCR Master Mix(Applied Biosystems,USA)real-time PCR试剂盒用于DNA扩增与检测。

表1 目的基因引物序列
1.3.6RNA干扰实验 使用Ambion SilencerTM针对PK-120基因设计2条siRNA并合成,其序列为#1; 5’-CGA ACC ACC CAU UUG AGA U-3’, #2; AUG UCU CGA UGG CAA GCA C-3’(Bioneer, Korea)。RNAimax、siRNA分别用Opti-MEM稀释混合后转染入细胞,具体操作按照RNAimax试剂盒(Invitrogen, UK)。相同浓度的非靶向siRNA(sc-37007, USA)作为阴性对照组。
1.3.7细胞增殖实验 采用CCK-8实验进行分析,将转染24h、48h、72h的各组细胞密度调整5×103个/mL,加入CCK-8溶液10μL进行培养,37℃ 孵育1~4h, 置于酶标仪上450nm处对各孔吸光度值检测3次,取其平均值为最终所测值,具体操作按照Cell counting kit-8(Dojindo Molecular Technologies, USA)进行。
1.3.8体外共培养(co-culturing system)模型试验 研究分为三组:JEG3细胞加入5%FBS、JEG3细胞加入5%对照组血清、JEG3细胞加入5%RPL患者血清[RPL患者组1和2为PK-120(T.R.)高表达的实验组;RPL患者组3为PK-120(F.L.)与PK-120(T.R.)表达实验组]共培养24h后,分析比较Th1/Th2、基质金属蛋白酶-2(matrix metalloproteinase-2, MMP-2)、基质金属蛋白酶-9(matrix metallo proteinase-9, MMP-9)、黏蛋白(MUC-1)、胎盘蛋白(placental protein 14, PP14)的分泌量。

2 结果
2.1RPL组和对照组Th1、Th2水平及PK-120 表达 采用Western blot法与ELISA法测定血清Th1、Th2含量及PK-120 表达,发现RPL患者血清PK-120(T.R.)裂解片段相对表达显著增加,而对照组 PK-120(F.L.)增加,见图1。RPL患者组血清中Th1(TNF-α、IL-1β、IFN-γ、IL-2)水平均高于对照组(P<0.05),而Th2(IL-4、IL-10)的水平低于对照组(P<0.05),见表2。进一步分离RPL患者PBMC,发现PK-120 mRNA表达水平明显低于对照组(P<0.05),见表3;但PK-120(T.R.)裂解片段高于对照组(P<0.01),见图2。RPL患者PBMC中Th1水平高于对照组,而Th2的水平却明显低于对照组(P<0.05),见表3。

图1 对照组与RPL组血清PK-120表达水平
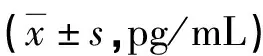
表2 RPL组与对照组血清中细胞因子水平比较

表3 RPL组与对照组外周PBMC中细胞因子和PK-120 mRNA表达水平比较
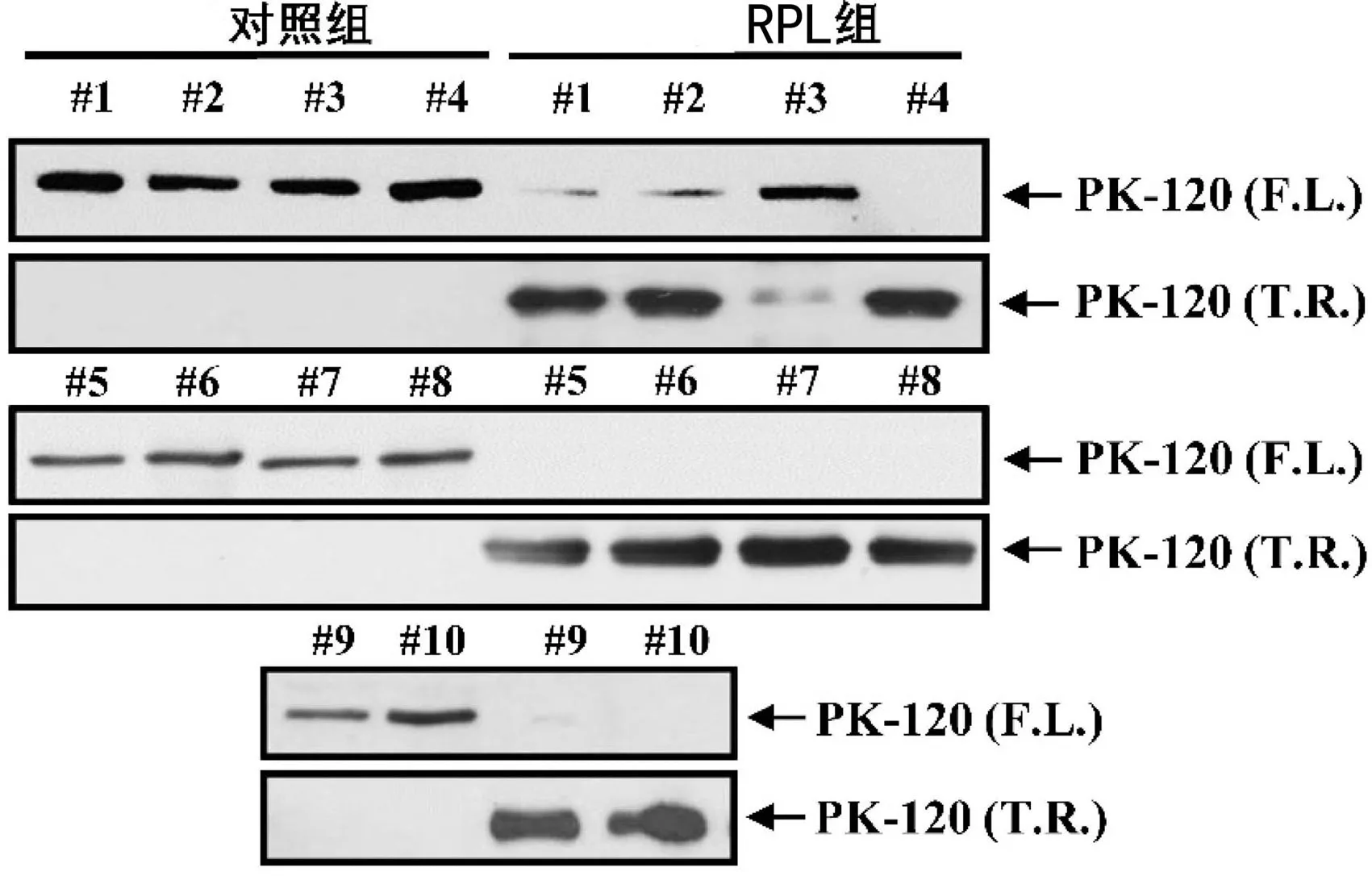
图2 对照组与RPL组PBMC中PK-120表达水平
2.2PK-120敲低的PBMC可增加Th1释放 利用流式细胞仪检测PK-120 敲低的人CD14+PBMC中的细胞因子的表达量,结果显示,Th1表达水平显著增高,而Th2显著降低,差异均有统计学意义(P<0.05),见表4。
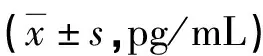
表4 各组CD14+PBMC中细胞因子表达量的比较
2.3PK-120对JEG3人绒毛滋养层细胞中Th1、Th2表达的调节作用 RNA干扰沉默PK-120基因结果显示与对照组相比,siRNA处理后JEG3细胞中TNF-α、IL-1β、IL-2表达量增加,而IL-4、IL-10、IL-13表达量减少,其中TNF-α、IL-1β、IL-2、IL-4、IL-10差异具有统计学意义(P<0.05)。见表5。分别将质粒pCS4-3Flag-PK-120(F.L)、pCS4-3Flag-PK-120(T.R,aa689-902)、pCS4-3Flag-PK-120(△BKD,aa661-688)转染至JEG3细胞,建立稳定表达细胞系并比较细胞因子的分泌量,见图3。结果显示:PK-120(F.L.)组与PK-120(T.R.)组相比,PK-120(T.R.)组可上调Th1(TNF-α、IL-1β、IFN-γ、IL-2)的表达,而PK-120(F.L.)组可明显上调Th2(IL-4、IL-10)的表达(P<0.05)。与PK-120(F.L.)组相比,PK-120(△BKD)组Th2(IL-4及IL-10)水平明显降低(P<0.05);以Th1/Th2来反映免疫应答方式,TNF-α/IL-10及IFN-γ/IL-10比率见表6。
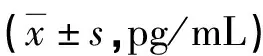
表5 各组JEG-3人绒毛滋养层细胞中细胞因子的表达量的比较

图3 Western blot检测其构建体的表达水平

表6 各组转染后细胞Th1、Th2细胞因子mRNA表达比较
2.4各组细胞增殖的比较 siPK-120转染组可时间依赖性增加THP1单核细胞的增殖力, siRNA阴性组与对照组间细胞的增殖无显著差异(P>0.05);siRNA-PK-120组细胞的增殖较对照组明显增加,差异有统计学意义(P<0.05),见表7。而PK-120(T.R.)组较PK-120(F.L.)组表达水平显著增加,差异有统计学意义(P<0.05),见表8。Western blot检测单个构建体的表达水平见图4。

表7 各组细胞增殖的比较

表8 各组转染后CCK-8实验结果的比较

图4 Western blot检测单个构建体的表达水平
2.5共培养体系分析结果 为了进一步明确PK-120与RPL发生机制之间直接的相关性,我们利用体外共培养模型以证明PK-120与妊娠免疫耐受关系及相关分子之间的交互作用。研究分为三组:JEG3细胞加入5%FBS、JEG3细胞加入5%对照组血清、JEG3细胞加入5%RPL患者血清[RPL组1和2为PK-120(T.R.)高表达的实验组;RPL组3为PK-120(F.L.)与PK-120(T.R.)表达实验组]共培养24h后,比较细胞因子分泌量与粘附分子表达量。相差显微镜下可见在RPL患者血清共培养组,滋养层细胞70%~80%死亡(锥虫蓝染色法确定);同时,在对照组可观察到“jelly coat”样透明物质生成(红色箭头)见图5;RPL组Th1表达量较对照组显著上调(P<0.05),见表9;共培养体系细胞中,RPL组MMP-9的表达量较对照组明显增高(P<0.05),MMP-2、MUC-1、PP-14的表达量明显下调,差异具有统计学意义(P<0.05),见表10。

图5 各组人绒毛膜滋养层细胞系JEG-3细胞共培养(100×)
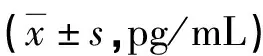
表9 各组共培养体系中细胞因子表达比较

表10 各组共培养体系中MMP-2、MMP-9、MUC-1及PP-14表达量的比较
3 讨论
从免疫学角度看,同种免疫与母体及胚胎免疫耐受失衡相关,多表现为封闭抗体低下及共刺激途径占优势,Th1与Th2的比值偏移[8]。妊娠进程中,胎儿作为半同种自然移植物,只有母体对其免疫处于抑制状态下能维持正常妊娠,在此期间母体会抑制T细胞反应以阻止自身的排异反应[9]。正常妊娠Th2占优势,当Th1/Th2平衡向靠近Th1方向移动则会损害妊娠,导致流产[10]。本课题组前期研究鉴定了RPL有关基因及蛋白质,其中>65%RPL患者PK-120 蛋白质出现截断形式(cleaved or truncation form),但对这一现象的分子机制还不十分清楚。
PK-120与其他4个同源的重链及1条轻链共同编码ITI家族分子。早期研究表明其与透明质酸通过软骨素硫酸桥十字共价连接,作为丝氨酸蛋白抑制酶类似物,是一种潜在的细胞外基质(ECM)调节物[11],在疾病发生过程中牢固地与透明质酸相结合,从而转变了自身的一些性质,在炎症和其他的生物过程中起调节作用[12-13];由于具有对激肽释放酶降解的敏感性,后来被认为是一种血浆激肽释放酶的酶底物,被称为PK-120[5]。我们研究发现,对照组血清中有PK-120(F.L.)的表达,但是在RPL患者血清中,PK-120(T.R)裂解片段显著上调;而PK-120在RPL患者PBMC中mRNA表达水平明显低于对照组。PK-120具有几个推定的结构域(putative domain),包括信号肽、von villebrand因子A型结构域(272-432aa)、富含脯氨酸的区域(611-730aa)、可变剪接结构域(621-650aa)和缓激肽样结构域(Bradykinin-like domain, BKD,661-688 aa)。其中,富含脯氨酸的区域(PRR)内有缓激肽样片段(Pro662-Arg688)可参与急性期炎症反应[14-15]。另外,缓激肽样结构域内有血浆激肽释放酶切割位点(R688),我们的前期研究(LC-MS/MS)已经鉴定了PK-120在RPL患者中切割位点[7]。在对domain功能研究中发现,BKD 区域在免疫应答及RPL发病机制中可能具有重要作用。本次研究结果显示,人CD14+单核细胞PK-120的敲除可以上调Th1的表达。进一步实验表明,在PK-120(T.R)过表达组Th1的表达增加,而在PK-120(F.L.)转染细胞后,Th2的表达增加。
为了更好的了解PK-120与RPL发病机制的相关性,我们分析上述共培养系统显示,与对照组相比,RPL组共培养细胞中免疫反应相关基因的表达降低,如PP-14和MUC-1。研究表明,这些因子在RPL患者的绒毛组织中异常表达[16]。大约有25%的RPL患者显示出对滋养层的免疫反应增强,炎性细胞相对增殖率显著[17]。提示免疫抑制相关基因产物的异常调节可能导致RPL。PP-14作为一种免疫抑制分子,可能参与阻止母体对早期胚胎的免疫反应,对维持妊娠起重要作用。而粘附分子如MUC-1在附着及粘附、妊娠免疫调节中起重要作用,可通过形成胞饮突(Pinopode)完成对滋养细胞的侵袭。也有研究指出,MUC-1的表达下降可能会诱导超级生育能力(super-fertility),并中断胚胎自我选择,这使得有缺陷的胚泡及胚胎能够被植入,最终导致流产率增加[18-19]。另外,MMP-2和MMP-9被发现在妊娠早期直接或间接地参与了滋养层细胞的侵袭和粘附过程。在本研究中,共培养体系检测结果显示,RPL患者组MMP-2、MUC-1、PP-14均显著低于对照组,而MMP-9表达量高于对照组; 对照组中“jelly coat” 样透明物质表型的形成可能与正常的免疫调节及妊娠免疫耐受或侵袭密切相关,且RPL共培养组细胞分泌Th1型细胞因子明显上调,提示可能与妊娠过度炎症反应有关,导致Th1/Th2之间的平衡状态被打破而发生RPL。
综上所述,PK-120表达异常可上调促炎性细胞因子的分泌及免疫细胞增殖。PK-120(F.L.)可能在维持Th1/Th2平衡中起积极作用,而PK-120(T.R.)可能与妊娠免疫耐受及RPL发生机制有关。血清与PBMC中PK-120的检测可能成为RPL诊断的评价指标及分子治疗潜在的靶点。但其作用与相关信号通路还需进一步深入研究。
