阿托伐他汀对白蛋白诱导的HK-2细胞凋亡的影响及机制初探
2021-11-19陈艳霞秦晓华房向东涂卫平
陈艳霞,黄 翀,秦晓华,房向东,涂卫平
(南昌大学第二附属医院肾脏内科,南昌 330006)
慢性肾功能衰竭中肾小管细胞的凋亡不如急性肾功能衰竭中突出。然而,肾小管细胞凋亡是肾脏功能不全的关键特征,蛋白尿在慢性肾病的进展中起着关键作用。蛋白尿可诱导人肾小管上皮细胞(human renal tubular epithelial cells,HK-2)细胞的凋亡。在慢性肾功能衰竭中,很难确定在规定的时间范围内因凋亡而死亡的HK-2细胞的绝对数量,但HK-2细胞凋亡对肾功能衰竭的促进作用已被广泛接受[1]。尿液中的白蛋白被认为是危险因素,对于如何缓解蛋白尿引起的肾功能衰竭问题的研究有着重要意义,因为它们可能成为控制慢性肾病新的治疗靶点。目前,阿托伐他汀(atorvastatin,ATO)对于白蛋白诱导的HK-2细胞的凋亡影响尚不明确,因此,本研究旨在探讨ATO对白蛋白诱导的HK-2细胞凋亡的影响,并对其可能的作用机制进行探讨。
1 材料与方法
1.1 主要试剂与仪器
HK-2细胞来自美国ATCC细胞库;ATO购自美国辉瑞制药有限公司;RhoA/ROCK信号通路抑制剂(Y27632)购自美国Sigma公司;HK-2细胞培养基DMEM/F12培养基购自美国Hyclone公司;HK-2细胞培养液中的胎牛血清购自美国Gibco公司;流式细胞检测仪为美国Beck-man公司产品。RhoA、ROCK1及内参(β-actin)引物序列见表1。

表1 RhoA、ROCK1、β-actin引物序列
1.2 实验细胞培养及分组
体外培养HK-2细胞,将培养到85%~90%的HK-2细胞随机分为7组:空白对照组(A组)、白蛋白诱导组(B组:5 mg·mL-1白蛋白)、ATO组(C组:10-8mol·L-1ATO)、低浓度ATO+白蛋白诱导组(D组:10-10mol·L-1ATO+5 mg·mL-1白蛋白)、中浓度ATO+白蛋白诱导组(E组:10-9mol·L-1ATO+5 mg·mL-1白蛋白)、高浓度ATO+白蛋白诱导组(F组:10-8mol·L-1ATO+5 mg·mL-1白蛋白)、RhoA/ROCK信号通路阻断剂组(G组:10 μmol·L-1Y27632+5 mg·mL-1白蛋白);予以各实验组细胞干预培养48 h后,流式细胞仪检测各组HK-2细胞的早期凋亡,采用RT-PCR检测各组HK-2细胞RhoAmRNA、ROCK1mRNA的表达。实验重复3次。
1.3 流式细胞仪检测HK-2细胞早期凋亡率
各实验组细胞干预48 h后,收集各实验组的HK-2细胞。PBS洗涤×2次(2000 r·min-1离心5 min)收集(1~5)×105细胞。加入500 μL Binding Buffer进行HK-2细胞的重悬。加入5 μL Annexin V-FITC混匀后再加入5 μL Propidium Iodide,再次混匀。于室温下,避光反应5~15 min,在1 h内流式细胞仪上检测HK-2细胞的早期凋亡率。
1.4 RT-PCR检测各组HK-2细胞中RhoA、ROCK1 mRNA的表达
培养结束后,弃去培养液后分别收集各实验组的HK-2细胞,用Trizol提取总RNA进行RNA完整性检测后,用核酸微量蛋白测定仪进行RNA浓度的测定。取总RNA 1.5 μg逆转录合成cDNA,取cDNA 2 μL在2×EasyTaq PCR SuperMix的作用下扩增目标基因(以人β-actin为内参照),总反应体系为50 μL。RhoA及ROCK1的引物序列如上所述。反应条件:94 ℃预变性5 min,55 ℃退火30 s,72 ℃延伸7 min,共35个循环。产物完成电泳后采用凝胶成像系统成像并使用Quantity One软件进行数据分析。
1.5 统计学方法

2 结果
2.1 ATO对白蛋白诱导的HK-2细胞早期凋亡的影响
A组与C组HK-2细胞早期凋亡率比较差异无统计学意义(P>0.05);B组HK-2细胞早期凋亡率较其他各实验组升高明显,且差异均有统计学意义(均P<0.05);D、E、F组HK-2细胞早期凋亡率较B组降低,且差异均有统计学意义(均P<0.05);D、E、F组HK-2细胞早期凋亡率组间比较差异均有统计学意义(均P<0.05);在D、E、F组中,干预用的ATO的浓度为逐渐升高,HK-2细胞早期凋亡率呈现逐渐下降的趋势;G组HK-2细胞早期凋亡率与D、E、F组比较差异均有统计学意义(均P<0.05);见表2,图1。

表2 各组HK-2细胞早期凋亡率比较
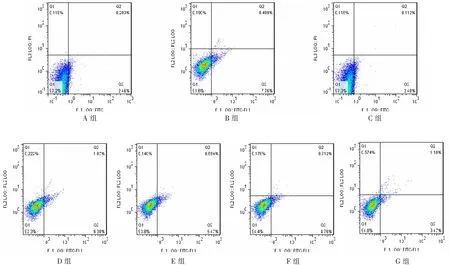
图1 各组HK-2细胞早期凋亡率情况
2.2 ATO对白蛋白诱导的HK-2细胞中RhoA/ROCK1信号通路的影响
A组与C组RhoAmRNA、ROCK1mRNA的表达比较差异无统计学意义(P>0.05);B组与G组RhoAmRNA表达差异无统计学意义(P>0.05),而G组ROCK1mRNA的表达较B组明显减少;D、E、F组HK-2细胞RhoAmRNA、ROCK1 mRNA的表达较B组减少(均P<0.05);见图2,表3。
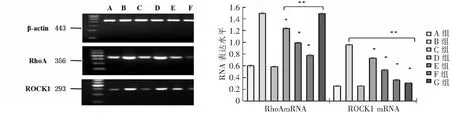
*P<0.05与A组比;**P<0.05。图2 各组HK-2细胞RhoAmRNA、ROCK1 mRNA的表达情况
表3 各组HK-2细胞RhoAmRNA、ROCK1 mRNA的表达情况
3 讨论
慢性肾脏病的进展过程中,除了有肾间质的纤维化,还伴有肾小管的萎缩。而蛋白尿就是引起肾小管萎缩中HK-2细胞凋亡的危险因素。研究表明,过量的白蛋白可以通过Fas信号途径[2]、线粒体凋亡途径[3]、内质网应激[4]、蛋白激酶B途径[5]等引起HK-2细胞的凋亡。
目前,他汀类药物是抗动脉粥样硬化治疗的基础药物,具有广泛的临床应用,尤其是心血管疾病方面,并且显示出高效和良好的安全性。不仅如此,他汀类药物在肾脏疾病方面,具有一定的临床作用。BIANCHI等[6]的研究表明,在患有慢性肾脏病、蛋白尿和高胆固醇血症的患者中,除了使用ACE抑制剂或ARB方案外,还可以使用ATO治疗来降低蛋白尿和肾脏疾病的进展速度;FUENTES等[7]研究发现,在肾移植的同种异体移植前使用ATO,可以减少肾脏的急性炎症负担,并促进移植后肾功能的恢复。ATO的预给药可以通过其抗氧化作用保护肾脏免受亚胺培南诱导的肾毒性[8]。另外,ATO可以减轻心肌细胞凋亡[9]、抑制血管紧张素Ⅱ诱导的人脐静脉内皮细胞凋亡[10]、抑制人类胆管癌细胞的凋亡[11]等。且ATO能改善碘普罗胺诱导的糖尿病大鼠肾损伤,其保护作用的机制可能与抑制HK-2细胞凋亡有关,且这种保护作用呈现剂量的依赖性[12]。ATO在造影剂肾损伤中具有保护作用,通过调控PERK/eIF2α/CHOP通路减轻造影剂诱导的大鼠肾小管上皮细胞凋亡[13]。而本研究结果发现,ATO可以改善白蛋白诱导的HK-2细胞的早期凋亡的发生。
已证实Rho相关螺旋形成蛋白激酶(ROCK-1和ROCK-2)参与平滑肌的收缩和细胞凋亡[14]。同时,Rho/ROCK信号途径是调控细胞收缩和凋亡的关键环节[15]。ATO可通过抑制ROCK信号通路来预防Ang Ⅱ诱导的人动脉内皮细胞的单层破裂,该机制的发现可以部分解释他汀类药物对心脑血管疾病(如颅内动脉瘤)的某些有益作用[16]。另有研究[17]表明,大剂量ATO可迅速抑制促动脉粥样硬化的Rho/ROCK途径,而与胆固醇降低无关。辛伐他汀可通过下调ROCK的活性抑制小鼠胚胎干细胞的自我更新[18]。以上研究均提示,ATO在体内的作用机制可能与调控Rho/ROCK信号通路有关,本研究结果显示,D、E、F组HK-2细胞RhoAmRNA、ROCK1 mRNA的表达较B组减少,予以Y27632进行RhoA/ROCK信号通路阻断后,其HK-2细胞的早期凋亡率明显下降,提示RhoA/ROCK信号通路参与白蛋白诱导的HK-2细胞早期凋亡的发生。而ATO发挥抑制白蛋白诱导的HK-2细胞早期凋亡作用的机制可能与部分阻断RhoA/ROCK信号通路有关。
在临床应用中,ATO的安全性和耐受性至关重要。荟萃研究[19]分析提示现有数据表明,阿托伐他汀在其治疗剂量范围内(10~80 mg·d-1)通常具有良好的耐受性。ATO对肾脏的作用具有剂量依赖性,在庆大霉素诱导的肾损伤模型研究[20]中发现,低剂量的阿托伐他汀对急性肾损伤中的肾小管上皮细胞具有保护作用。本研究进行了ATO在体外培养的HK-2细胞中10-8mol·L-1、10-9mol·L-1、10-10mol·L-13个浓度的探讨,进一步研究将继续对ATO的浓度梯度进行摸索。
本文目前局限在细胞水平的研究,动物水平及人体水平ATO对肾小管上皮细胞凋亡的作用及其可能机制需要进行进一步的实验探讨。本研究提示ATO可抑制白蛋白诱导的HK-2细胞的早期凋亡,其作用机制可能与部分阻断RhoA/ROCK信号通路有关,为临床寻找延缓肾脏疾病进展的治疗新靶点提供了理论依据。
