白脂素对高浓度葡萄糖诱导心肌细胞损伤的保护作用及机制
2021-11-19张雅楠李浩东章芯怡黄起壬
张雅楠,李浩东,章芯怡,韩 杰,黄起壬
(1.江西省基础药理学重点实验室;2.南昌大学药学院a.药理学教研室;b.2018级,南昌 330006)
糖尿病是一种发病率和病死率仅次于癌症和心血管病的第三大疾病[1]。糖尿病的晚期伴有糖尿病神经病变、糖尿病肾病、糖尿病心肌病(DCM)等多种并发症。DCM是最终造成糖尿病患者严重死亡的主要原因[2]。1972年RUBLER等[3]首次发现DCM是心脏疾病的一种特殊形式,在患有缺血性或高血压性心脏病的糖尿病患者中较为常见,主要表现为心脏结构和功能异常[4]。
白脂素(ASP)是由FBN1(Fibrillin-1)的最末端2个外显子编码的一种新型糖原蛋白激素,主要存在于人体的白色脂肪组织中,由白色脂肪细胞分泌而来[5],肌原纤维蛋白前体C端剪切位点是该激素起作用的主要部位。有研究[6-7]表明ASP可以有效调节人体血糖,具有增强食欲和消炎等作用。ASP一方面能够和人体肝脏细胞外周表面的受体相互结合,刺激人体肝脏细胞内的葡萄糖分泌,直接导致血糖值上升;另一方面,ASP可以穿过血脑屏障,直接激活与下丘脑中枢摄食功能相关的AgRP+神经元,并进一步地抑制与厌食功能相关的神经元的活性,促进摄食活动,间接地发挥了升高血糖的作用[8]。GROENER等[9]发现,1型糖尿病患者出现低血糖时,血浆ASP水平明显升高,其与1型糖尿病的胰岛素抵抗作用有关。LEE等[10]也发现,ASP可通过TLR4/JNK介导的炎症反应影响胰岛素对葡萄糖的作用效果。既往研究[11]表明ASP可作为预测急性冠脉综合征(ACS)伴不稳定型心绞痛严重程度的新型生化标志物。ASP在无氧运动的情况下分泌增多[12],因此推测ASP可能对DCM也有影响。目前ASP与DCM之间关系的研究较少,有研究[13-14]表明体内摄入过多的葡萄糖,血糖浓度增高会使心肌细胞受到严重的损伤。因此,本文通过高浓度葡萄糖(HG)诱导心肌细胞损伤并予ASP干预,探讨ASP在HG诱导的心肌细胞损伤中的作用,期望为临床诊治DCM提供实验依据。
1 材料
1.1 细胞株及血清培养基
H9C2细胞株购自美国ATCC(Catalog No:CRL1730);胎牛血清购自天津海硕源科技有限公司;DMEM/f12培养基购自美国Hyclone公司。
1.2 药品及试剂
ASP购自上海强耀生物科技有限公司,葡萄糖购自美国SIGMA公司,乳酸脱氢酶(LDH)及丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-PX)检测试剂盒均购自南京建成生物工程研究所,SOD兔多克隆抗体购自武汉博士德生物工程有限公司,GSH-PX兔多克隆抗体购自杭州华安生物技术有限公司,GAPDH鼠多克隆抗体购自武汉三鹰生物技术有限公司。
2 实验分组及方法
2.1 HG诱导心肌损伤模型的建立
将H9C2细胞均匀接种于100 mm的细胞培养板上,随机分为Ctrl组和HG组,HG组设立不同的葡萄糖浓度组,每组细胞培养基的葡萄糖终浓度分别为20、30、40、50和60 mmol·L-1,处理24 h后,通过MTS检测H9C2的存活率,收集细胞上清液检测LDH活力,确定最适合的葡萄糖浓度,建立HG诱导损伤模型,以进行后续实验。
2.2 ASP对细胞活力的影响观察
将H9C2细胞均匀接种于96孔板上,当细胞铺满培养板80%后将细胞随机分为Ctrl组、HG组(50 mmol·L-1)、Ctrl+ASP(20 nmol·L-1)组和HG+ASP组,用葡萄糖浓度为50 mmol·L-1的完全培养基对HG组和HG+ASP组进行处理36 h,Ctrl组和Ctrl+ASP组则用葡萄糖浓度为5.5 mmol·L-1完全培养基同步处理36 h;36 h后将各组培养基均换成正常葡萄糖浓度的完全培养基;除Ctrl组和HG组外,其余2组分别加入20 nmol·L-1的ASP继续培养24 h,处理结束后通过CCK8检测细胞存活率,观察细胞活性变化。
2.3 ASP对LDH活性、MDA含量、SOD和GSH-PX活性的影响观察
2.3.1 LDH活性检测
将细胞均匀接种于100 mm培养皿中,同上分组处理后,取各组上清液进行检测,LDH活性检测采用微板法,首先实验设置空白孔、标准孔、测定孔和对照孔,在空白孔里面加入25 μL的双蒸水、标准孔里面加入25 μL浓度为0.2 μmol·mL-1的丙酮酸标准液,测定孔和对照孔里面则先分别加入5 μL的双蒸水后,再根据实验分组的不同分别加入20 μL样本,随后在所有孔内加入25 μL的基质缓冲液,最后单独在测定孔中加入5 μL辅酶,混匀,置于37 ℃的水浴锅中温浴15 min;随后在所有孔里面分别加入25 μL 2,4-二硝基苯肼,混匀,放在37 ℃的水浴锅中反应15 min;结束后在各孔中加入250 μL 0.4 mmol·L-1的NaOH溶液,混匀,室温放置5 min,将各孔溶液转移100 μL至96孔板中并将96孔板置于酶标仪上,设置检测波长为450 nm,得到吸光度值后,根据吸光度值计算出各组活性。
2.3.2 MDA含量测定
收集各组上清液后采用TBA法进行检测,实验设置空白管、标准管、测定管和对照管,按照实验及分组要求,取离心管标记好后,首先在空白管中加100 μL的无水乙醇,标准管中加入与空白管等量的浓度为10 nmol·L-1的标准品,测定管和对照管根据细胞实验分组的不同分别加入与空白管等量的样本,然后在所有管中加入100 μL蛋白澄清剂,颠倒混匀后,在所有管中加入酸缓冲液3 mL,在对照管中加50%的冰醋酸1 mL,空白管、标准管和测定管则分别加入1 mL的TBA显色剂。最后将离心管盖上盖,用针在盖上扎一小孔,混合并摇匀后,放在95 ℃的水浴锅中反应40 min,取出用净水冲洗冷却降温,然后放在离心机中离心,条件为3500 r·min-1,时间10 min,离心结束后取上层,设置条件于532 nm处、1 cm光径,用二蒸水调零后,检测各管吸光度值。根据吸光度值计算各组MDA含量。
2.3.3 SOD活性测定
收集各分组上清后进行SOD活性测定,实验设置对照孔、对照空白孔、测定孔、测定空白孔,取96孔板。首先对照空白孔与对照孔同步处理加入20 μL蒸馏水,测定孔和测定空白孔也是同步处理,按细胞分组的不同加入20 μL待测样本;随后对照孔和测定孔同步处理各自加入20 μL酶工作液,对应的对照空白孔和测定空白孔也是同步处理加入20 μL酶稀释液。所有孔颠倒混匀后,分别各自加入200 μL的底物应用液,混匀后,放在37 ℃的烘箱里孵育20 min,取出96孔板置于酶标仪中450 nm处检测吸光度值。根据所检测出的各组吸光度值计算出各组SOD活性。
2.3.4 GSH-PX活性测定
实验分为酶促反应和显色反应两部分。首先酶促反应部分,各分组准备酶管和非酶管,先在所有管中加入0.2 mL 1 mmol·L-1的GSH溶液,并在酶管中加入0.1 mL待测样本,重悬混匀后,将所有管放在37 ℃的水浴锅中反应5 min,反应结束后在所有管中加入0.1 mL稀释了100倍后的贮备液,充分混匀后,37 ℃水浴锅反应5 min后在所有管中加入2 mL沉淀剂,并单独在非酶管中加入0.1 mL待测样本,充分混匀后,设置离心机条件为3500 r·min-1,离心10 min,收取各管上层清液1 mL做显色反应;根据试剂盒实验说明书显色反应部分设置空白管、标准管、非酶管、酶管,先在空白管里加入1 mL GSH标准品的溶剂应用液,标准管中则加入1 mL浓度为20 μmol·L-1的GSH标准液,非酶管和酶管加入酶促反应的上层清液1 mL,随后在所有的管中依次分别加入缓冲液1 mL和显色剂250 μL还有稳定剂50 μL。最后充分重悬混匀,常温静置15 min后,置于412 nm、1 cm光径比色杯,用蒸馏水调零后,检测各管OD值,根据OD度值计算各个分组的GSH-PX活性。
2.4 Western blotting检测细胞内SOD和GSH-PX表达
按上述处理方法处理好细胞后,弃去培养基后用PBS清洗细胞表面2次,用现配的裂解液(RIPA裂解液:PMSF=100∶1)裂解细胞15 min,每隔5 min 摇一下细胞培养皿,确保裂解液充分接触细胞表面,最后收集培养皿表面混合物并于4 ℃离心收集上清液得到细胞总蛋白,提取蛋白后通过BCA蛋白定量法检测各分组的蛋白浓度,将提取到的总蛋白溶于上样缓冲溶液中煮沸10 min,用9%的SDS-PAGE进行电泳分离,随后进行转膜,将目的条带湿转到适宜的PVDF膜上,湿转结束后将PVDF膜放入浓度为8%的脱脂牛奶中并在室温条件下摇床封闭2 h,封闭结束后用TBST清洗PVDF膜表面牛奶,最后把PVDF膜依次放入稀释好的对应的一抗中(稀释倍数为1∶1000),并置于4 ℃冰箱孵育过夜。次日将膜取出用TBST清洗,将PVDF膜放入相应的二抗(稀释倍数为 1∶2000)中,室温置于摇床上2 h,TBST洗膜6次,每次7 min,最后用ECL化学发光法进行检测,将PVDF膜放置于Bio-Rad化学发光成像系统仪中进行显影。最终图片在Image-J软件上进行灰度值分析,将所得SOD和GSH-PX蛋白带的灰度值分别除以对应组β-actin的灰度值后,在Excel表中进行数据分析。
2.5 qRT-PCR检测细胞内SOD和GSH-PX mRNA的水平
将细胞均匀接种于60 mm培养板中,经前期细胞分组处理后,弃去上清液,用PBS清洗细胞表面2次,采用Trizol法提取各组细胞的RNA,随后将提取到的RNA逆转录成cDNA。1)残留gDNA的去除体系为16 μL,4×2-Step gDNA Erase-Out Mix 4 μL,模板RNA 1 μg,42 ℃反应2 min;2)逆转录反应体系为20 μL,5×ToloScript qRT EasyMix 4 μL,gDNA去除反应液16 μL,37 ℃反应15 min,85 ℃反应5 s。通过qRT-PCR检测SOD、GSH-PX mRNA的水平,PCR扩增体系为20 μL,其中cDNA为2 μL,上下游引物各0.4 μL,2×SYBR Green qPCR Master Mix 10 μL,PCR循环数为40,95 ℃预变性15 min,95 ℃变性15 s,65 ℃退火15 s,72 ℃延伸30 s。
2.6 荧光法检测细胞内活性氧(ROS)水平
将细胞均匀接种于六孔板上,经前期处理后,采用活性氧检测试剂盒,先将DCFH-DA和无血清细胞培养基按1∶1000的比例稀释好后,从孵箱中取出处理好的细胞培养板,弃去细胞培养基,用PBS冲洗细胞表面后加入稀释好的DCFH-DA,然后将细胞培养板放回孵箱孵育30 min,取出PBS清洗,吸净PBS加入抗荧光淬灭剂,置于荧光倒置显微镜下观察并计算出各组相对荧光强度(倍数)。
2.7 统计学方法

3 结果
3.1 HG诱导心肌细胞的损伤模型
MTS检测结果显示:HG组葡萄糖处理浓度为20和30 mmol·L-1时细胞活力分别为(95.74±3.2)%和(89.7±5.3)%,与Ctrl组(5.5 mmol·L-1)相比差异无统计学意义(P>0.05);当HG组葡萄糖浓度为40 mmol·L-1时细胞活力为(84.07±3.5)%,下降了15%,差异具有统计学意义(P<0.05);HG组葡萄糖浓度分别为50和60 mmol·L-1时,细胞活力分别为(66.77±5)%和(59.33±5)%(P<0.001)。LDH活性观察结果显示:当葡萄糖处理浓度为5.5 mmol·L-1时,LDH为(83.33±10)U·L-1;当葡萄糖处理浓度为50 mmol·L-1时,LDH为(108±4.5)U·L-1,LDH上升明显(P<0.05)。提示,当葡萄糖处理浓度为50 mmol·L-1时,细胞活力下降(P<0.001)和LDH活性升高(P<0.05),表明HG诱导心肌细胞损伤模型建立成功,可采用该模型进行后续实验。见图1。

***P<0.001、*P<0.05与5.5 mmol·L-1比较,ns:P>0.05。图1 不同葡萄糖浓度对细胞活力和LDH活性的影响(n=3)
3.2 ASP对HG诱导细胞活力的影响
CCK8检测结果显示:HG组和HG+ASP组细胞活力分别为(55.45±3.4)%和(61.61±4.8)%。与HG组相比,HG+ASP组细胞活力显著升高,升高了6.5%(P<0.05)。见图2。
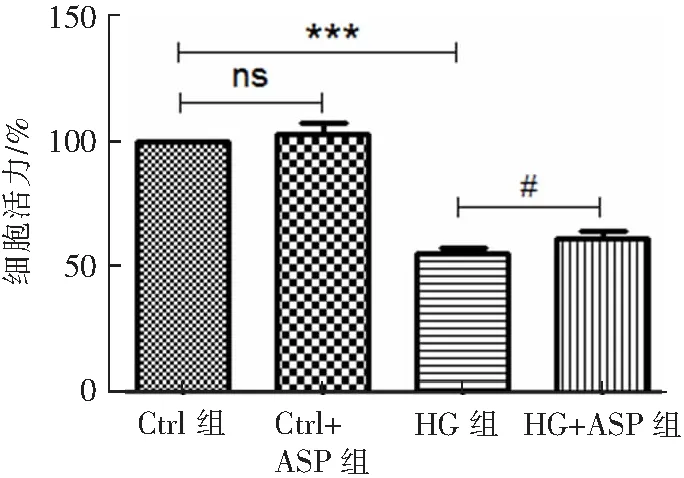
#P<0.05,***P<0.001,ns:P>0.05。图2 ASP对HG诱导的细胞活力影响(n=3)
3.3 ASP对LDH、SOD和GSH-PX活性以及MDA含量的影响
HG组的LDH活性为(114±7.5)U·L-1、MDA含量为(1.52±1.0)nmol·L-1、SOD活性为(11.13±0.75)U·mL-1、GSH-PX活性为(4.36±1.36)nmol·min-1·mL-1,HG+ASP组的LDH活性为(96±5.5)U·L-1、MDA含量为(1.12±0.21)nmol·L-1、SOD活性为(12.98±0.3)U·mL-1、GSH-PX活性为(27.78±1.08)nmol·min-1·mL-1。与HG组相比,HG+ASP组的SOD(P<0.05)、GSH-PX(P<0.05)的活性明显上升,LDH活性(P<0.001)、MDA含量(P<0.001)显著下降。见图3。
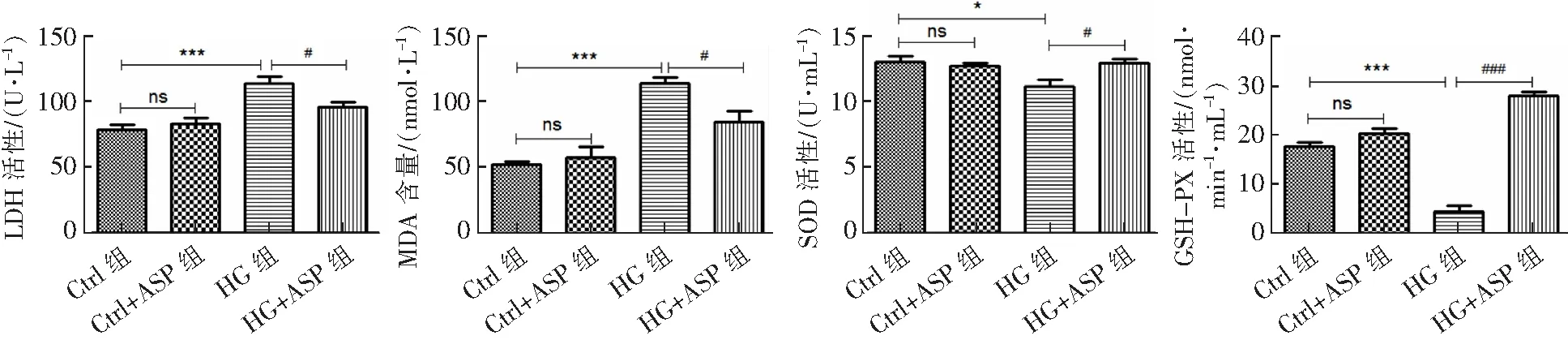
###P<0.001,#P<0.05,***P<0.001,*P<0.05,ns:P>0.05。图3 ASP对LDH、SOD和GSH-PX活性以及MDA含量的影响(n=3)
3.4 ASP对心肌细胞内SOD和GSH-PX表达的影响
与Ctrl组比较,Ctrl+ASP组SOD和GSH-PX蛋白的表达量差异无统计学意义(P>0.05),而HG组的SOD蛋白表达量比Ctrl组降低了10%,GSH-PX降低了20%(P<0.01);与HG组相比,HG+ASP组的SOD蛋白表达量上升43%,GSH-PX蛋白表达量上升86%(P<0.01)。见图4。
3.5 ASP对心肌细胞内SOD和GSH-PX mRNA水平的影响
qRT-PCR实验结果显示:与Ctrl相比,HG组的SOD mRNA水平表达量降低10%,GXH-PX mRNA水平表达量降低25.7%(P<0.05,P<0.001),Ctrl+ASP组差异无统计学意义(P>0.05);与HG组比较,HG+ASP组的SOD mRNA水平增加11.8%,GSH-PX mRNA水平增加9%(P<0.05)。见图5。
3.6 ASP对HG诱导的细胞内ROS水平的影响
从荧光图片和荧光强度分析结果可知,与Ctrl组相比,Ctrl+ASP组ROS水平差异无统计学意义(P>0.05),而HG组ROS水平增加546%(P<0.001);与HG组相比,HG+ASP组ROS含量下降62.8%(P<0.05)。表明,HG可显著增加细胞内ROS水平,而ASP可以显著降低ROS水平。见图6。
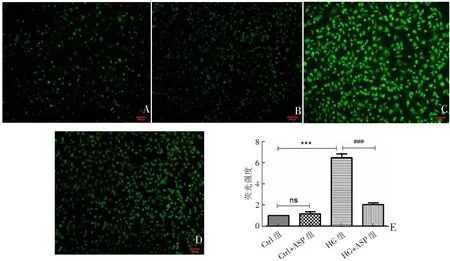
A—D为各组的荧光图片(×100),A:Ctrl组;B:Ctrl+ASP组;C:HG组;D:HG+ASP组。E为各组的相对荧光强度分析图,###P<0.001,***P<0.001,ns:P>0.05。
4 讨论
糖尿病是一种很常见的代谢性疾病,其主要特征为慢性高血糖,可导致细胞运输和利用葡萄糖的功能障碍[15]。慢性高血糖症,会引发一系列长期的并发症,最终导致心力功能障碍/衰竭或心肌病[16]。DCM很容易导致糖尿病患者发生心力衰竭[4]。而氧化应激和细胞凋亡是DCM发生和进展的最重要因素[16]。氧化应激是指机体遭受到刺激之后,机体内会产生与沉积过多的氧化中间产物,这会导致机体的氧化功能失衡(伴或不伴抗氧化能力下降)。有研究[17-18]表明,机体内的血糖含量增高可直接诱导心肌细胞凋亡,它通过增加机体内游离脂肪酸和生长因子的水平,进一步导致底物的供应和利用以及钙稳态和脂质代谢异常;除此以外,它还会进一步促进ROS的大量产生和释放,从而诱导氧化应激,造成基因表达异常,信号转导错误和心肌细胞凋亡。本研究主要通过HG(50 mmol·L-1)作用H9C2细胞来模拟机体HG环境下的心肌,CCK8检测细胞活力和检测细胞LDH活性结果显示,高浓度葡萄糖可以造成H9C2细胞损伤。
ASP可以调节哺乳动物体内的血糖平衡,其在禁食状态下产生后转移到肝脏,进一步激活G蛋白-cAMP-PKA信号通路以促进肝脏释放葡萄糖进入血液,从而调节血糖[7]。有研究[18]发现大多数2型糖尿病患者分泌ASP的时候没有节律性,这有可能是导致糖尿病发生的原因。有研究[19]表明ASP可通过上调Spartin通路抑制HG或高血糖诱导糖尿病小鼠心肌微血管内皮细胞(CMECs)的氧化应激反应,从而改善糖尿病小鼠心肌微血管内皮损伤。本研究发现用浓度为20 nmol·L-1的ASP处理细胞后,可以逆转HG诱导的H9C2细胞活力下降和LDH活性升高,说明ASP对HG造成的H9C2细胞损伤具有改善作用;进一步研究发现,ASP处理组细胞上清液中的MDA含量降低、SOD和GSH-PX活性升高,并且细胞中SOD和GSH-PX的蛋白和mRNA的表达均出现显著性升高,ASP处理组细胞中ROS的生成也减少。因此推断ASP是通过增加细胞活性,促进氧自由基的清除来保护心肌细胞免受葡萄糖的损害。
综上,本研究主要通过HG诱导建立心肌细胞体外损伤模型,模拟糖尿病心肌损伤,心肌损伤时会引起一系列氧化应激和炎症反应,导致细胞活力下降、ROS稳态失衡和部分炎症因子释放,通过ASP干预治疗可以降低部分氧化应激从而达到减弱HG导致的心肌损伤。这也为DCM防治提供了一种新的可能。
