羟自由基氧化对鹰嘴豆蛋白的结构及溶解性的影响研究
2021-11-15黄星雨何嘉敏华亚蒙张新玲朱增芳毛晓英吴庆智
曾 谦,黄星雨,何嘉敏,华亚蒙,张新玲,朱增芳,毛晓英,吴庆智,张 建
(石河子大学 食品学院,新疆 石河子 832000)
鹰嘴豆(Cicer arietinumL),属野豌豆族[1]。近年来,我国鹰嘴豆产量成倍增长,具有“鹰嘴豆之乡”之称的新疆木垒县目前已经形成了6.67 khm2的鹰嘴豆种植面积,占我国鹰嘴豆种植面积的83%[2]。植物蛋白作为人类食物蛋白重要来源之一,其已经成为解决世界人口日益增加问题的一种全新的食物蛋白来源[3]。试验选用的鹰嘴豆蛋白质含量为24.2%,对研究蛋白质氧化具有重要意义。通常,蛋白质氧化是指活性氧自由基直接作用于蛋白质分子,或蛋白质分子与氧化副产物发生反应而导致蛋白质结构发生改变[4]。一般认为,活性氧自由基与蛋白质的氨基酸侧链和肽链骨架反应,导致蛋白质分子发生裂解或者交联[5]。蛋白质中的半胱氨酸、酪氨酸、苯丙氨酸等氨基酸残基易与活性氧自由基反应[6-7]。试验采用的是羟自由基氧化体系对鹰嘴豆蛋白质进行氧化,而羟自由基氧化体系主要由抗坏血酸、过氧化氢(H2O2)、三氯化铁(FeCl3)三者在一定条件下进行氧化还原反应而产生。目前,有些学者已经通过羟自由基体系的研究证实,蛋白质可以被活性氧自由基氧化,这种氧化会对蛋白质造成不可逆的变化,如蛋白质的肽键断裂、蛋白质分子发生交联聚合而生成变性高聚物、蛋白质结构中氨基酸发生氧化脱氧及改变蛋白质的结构,导致蛋白质丧失生物活性[8]。李学鹏等人[9]研究了模拟氧化体系对六线鱼蛋白质的影响,认为羟自由基会对其鱼肉蛋白质的羰基、总巯基、游离氨基酸含量产生影响。Wu W等人[10]用不同浓度AAPH自由基对大豆分离蛋白氧化24 h,结果发现,相对于未氧化的大豆分离蛋白来说,氧化后的样品中的α-螺旋结构和β-折叠结构明显降低。
因此,试验以鹰嘴豆蛋白为主要研究对象,采用羟自由基氧化体系氧化鹰嘴豆蛋白,研究鹰嘴豆蛋白的羰基含量、二聚酪氨酸含量、表面疏水性、内源荧光、溶解性的变化,讨论羟自由基氧化对鹰嘴豆蛋白质的结构及溶解度的影响,为鹰嘴豆蛋白产品在加工及贮藏过程中品质控制提供理论依据。
1 材料与方法
1.1 材料与仪器
精选鹰嘴豆,木垒县鹰哥生物科技有限公司提供;三氯乙酸(TCA),天津永晟精细化工有限公司提供;乙二胺四乙酸(EDTA),上海金锦乐实业有限公司提供;十二烷基硫酸钠(SDS),天津市凯通化学试剂有限公司提供;其他试剂,均为分析纯。
SP-752/752PC型紫外可见分光光度计,上海光谱仪器有限公司产品;F-7000型荧光光谱仪,日本日立公司产品;PHS-3C型雷磁pH计,上海仪电科学仪器股份有限公司产品;LGJ-18S型冷冻干燥机,北京松源华兴科技有限公司产品;高速冷冻离心机,费默飞世尔科技(中国)有限公司产品。
1.2 试验方法
1.2.1 鹰嘴豆分离蛋白的制备
根据毛晓英等人[11]的方法。鹰嘴豆室温下干燥后粉碎成鹰嘴豆粉。鹰嘴豆粉过60目筛,正己烷脱脂,豆粉∶正己烷为1∶5(W∶V),室温下连续搅拌60 min,豆粉自然沉降与上层正己烷分离,倒出正己烷进行回收,豆粉再重复上述操作2次。最后将鹰嘴豆粉置于通风橱中室温干燥12 h,将处理好的脱脂豆粉装袋置4℃冰箱中保存。脱脂鹰嘴豆粉与水1∶10(W∶V)混合,用1 mo/L NaOH调pH值至8.3,搅拌提取1 h,以转速4 000 r/min离心10 min,沉淀再按料液比为1∶5(W∶V)提取2次,将3次上清液混合,上清液用1 mol/L HCl调pH值至等电点(pH值4.5)沉淀蛋白,搅拌使沉淀复溶后,溶液置于离心机中以转速4 000 r/min离心10 min,得到的沉淀加适量蒸馏水后用1 mol/L NaOH调pH值至7.0,冻干。
1.2.2 氧化鹰嘴豆蛋白的制备
参考Park D等人[12]的方法构建以下氧化体系:使FeCl3浓度0.1 mmol/L,抗坏血酸浓度0.1 mmol/L恒定,共设置5个H2O2浓度,浓度分别为0,0.5,1.0,5.0,10.0 mmol/L,构建氧化体系。将鹰嘴豆蛋白均匀分散于构建的氧化体系中,于4℃条件下氧化24 h,然后用1 mmol/L乙二胺四乙酸终止反应,并将终止后的鹰嘴豆蛋白浆置于离心机中以转速4 000 r/min离心10 min,得到的沉淀加适量蒸馏水后用1 mol/L NaOH调pH值至7.0,冻干。上述氧化反应在15 mmol/L哌嗪-N,N'-双(2-乙磺酸)缓冲溶液(pH值6.0,离子强度0.6 mmol/L)中进行。
1.2.3 羰基含量的测定
用去离子水配置蛋白质溶液5 mg/mL,再用双缩脲法测上清液蛋白质含量。用2,4-二硝基苯肼法[13]测定蛋白质中羰基含量。取1 mL已知浓度的样品蛋白,放入离心管,每管中加入10 mmol/L DNPH(2,4-二硝基苯肼1 mL,溶剂为2 mol/L HCl);室温避光反应1 h,每15 min使用涡旋振荡器搅拌1次;加1 mL 20%TCA(三氯乙酸)终止反应,以转速8 000 r/min离心10 min,弃上清液;用1 mL乙酸乙酯∶乙醇(1∶1)清洗沉淀3次;加6 mol/L盐酸胍溶液3 mL,于37℃水浴保温15 min溶解沉淀,以转速8 000 r/min离心10 min,保留上清液;紫外分光光度计于波长370 nm处测定吸光度,使用分子吸光系数22 000 M/cm计算其含量。
计算公式:
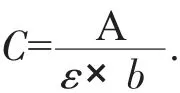
式中:C——羰基含量,nmol/mg;
A——吸光度;
ε——22 000 M/cm;
b——比色光径(1 cm)。
1.2.4 二聚酪氨酸含量测定
鹰嘴豆蛋白溶液2 mg/mL,用双缩脲法测定上清液蛋白质含量。参考Davies KJ A等人[14]的方法采用荧光分光光度计进行检测,参数设定为发射波长设420 nm,激发波长325 nm,灵敏度4,狭缝宽度均为10 nm,二聚酪氨酸的含量用相对荧光值(单位A.U.)来表示,相对荧光值的计算公式如下:
相对荧光值(单位A.U.)=

1.2.5 表面疏水性的测定
参照Huang Y R等人[15]的方法采用ANS做荧光探针,测定鹰嘴豆蛋白的表面疏水性。用0.01 mol/L pH值7.0磷酸盐缓冲液溶解0.5 g鹰嘴豆蛋白样品,磁力搅拌2 h后用考马斯亮蓝指剂法测定上清液中蛋白质浓度,用磷酸盐缓冲液稀释,使其最终质量浓度为0.5 mg/mL。用pH值7.0的磷酸盐缓冲液(0.01 mol/L)将蛋白质质量浓度稀释到0.005~0.500 mg/mL,取4 mL稀释蛋白样品并加入50μL ANS溶液(8 mmol/L,采用0.01 mol/L pH值7.0的磷酸盐缓冲液配制);同时,测定不加ANS溶液的稀释蛋白作为空白。采用荧光分光光度计测定样品的荧光强度(在激发波长365 nm,发射波长484 nm处测定荧光强度,狭缝设置为5,灵敏度设置为2),在上述条件下测定荧光强度,以荧光强度对蛋白质浓度作图,蛋白质分子的表面疏水性指数(H0)是曲线初始阶段的斜率[16]。
1.2.6 内源荧光的测定
参照王丹丹等人[17]的方法测定鹰嘴豆蛋白的内源荧光强度。利用荧光计获得蛋白质样品的固有发射荧光光谱,鹰嘴豆蛋白样品溶解于0.01 mol/L pH值7.0的磷酸盐缓冲液,使溶液中蛋白质的质量浓度为0.1 mg/mL。以溶解样品的磷酸盐缓冲液为空白。激发波长283 nm,扫描波段为300~400 nm,灵敏度为1,中速。
1.2.7 溶解度的测定
蛋白质溶解性的测定根据叶林[18]的方法,略作修改。将鹰嘴豆蛋白样品溶于去离子水中,磁力搅拌1 h,离心后取上清液,测定波长540 nm处吸光度。以牛血清白蛋白作标准曲线。溶解度为样品蛋白质含量和溶液蛋白质含量的比值。
1.3 数据处理
试验结果用平均数±标准误差表示,样本重复数n=3。采用SPSS statisics 23.0的Dukeny检验进行显著性分析,采用Origin8.5软件绘图。
2 结果与分析
2.1 羟自由基氧化对鹰嘴豆蛋白羰基含量的影响
蛋白质氧化后会有许多变化,其中羰基的形成是最明显的变化之一[7]。因此,可将蛋白质中羰基的形成作为蛋白被氧化的测定指标之一,羰基主要由氨基酸侧链(一般是对活性氧自由基敏感的带有NH或NH2的氨基酸残基)及肽键的氧化断裂产生[9]。所以,蛋白质中羰基形成越多表明蛋白质被羟自由基氧化的程度越高。
羟自由基氧化对鹰嘴豆蛋白羰基含量的影响见图1。
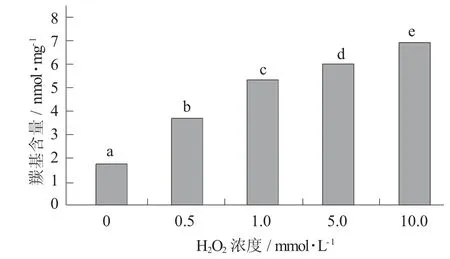
图1 羟自由基氧化对鹰嘴豆蛋白羰基含量的影响
试验设置一组空白对照(H2O2浓度为0)。由图1可知,随着H2O2浓度的增加,羰基的形成逐渐增加。与空白组蛋白羰基含量相比,随着H2O2浓度增加,羰基含量显著增加。羰基可能是由于羟自由基与氨基酸侧链或肽链发生氧化反应产生,且羟自由基浓度与蛋白质中羰基含量呈正相关[19-20]。雷叶斯等人[21]在研究羟自由基氧化体系对大黄鱼肌原纤维蛋白结构的影响中也有类似的结果:0~10 mmol/L H2O2处理时,大黄鱼肌原纤维蛋白氧化程度增加即蛋白羰基含量呈上升趋势。章银良等人[22]关于羟自由基诱导蛋白质氧化损伤的研究得出结论,随着双氧水浓度的增加和氧化时间的延长,羰基含量整体呈现增加的趋势。
2.2 羟自由基氧化对鹰嘴豆蛋白二聚酪氨酸含量的影响
蛋白质中酪氨酸残基被羟自由基氧化,通过化学键的作用形成蛋白质聚合物,称为二聚酪氨酸,因此蛋白质中二聚酪氨酸的含量可作为蛋白质氧化的重要指标之一[5,23]。
羟自由基氧化对鹰嘴豆蛋白二聚酪氨酸含量的影响见图2。
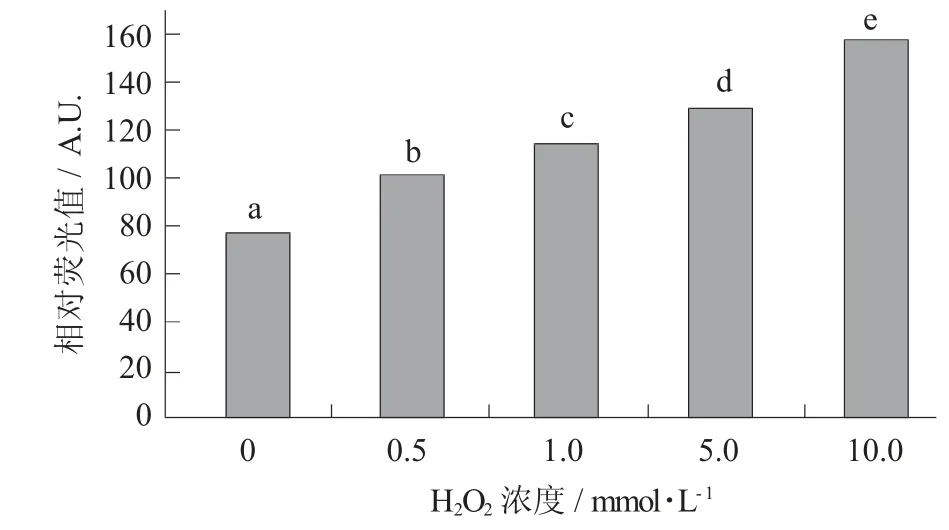
图2 羟自由基氧化对鹰嘴豆蛋白二聚酪氨酸含量的影响
由图2可知,随着H2O2浓度的增加,二聚酪氨酸的含量呈增长趋势,这说明酪氨酸残基对羟自由基敏感。方海砚等人[24]在研究羟自由基氧化对鲢鱼肌原纤维蛋白结构的影响时得到了类似结论,0~10 mmol/L H2O2处理时,随着H2O2浓度的增加,二聚酪氨酸含量也显著增加。陈霞霞等人[25]在研究自由基模拟氧化银鲳肌原纤维蛋白也得到了类似结果。
2.3 羟自由基氧化对鹰嘴豆蛋白表面疏水性的影响
一般采用ANS荧光探针法测量H0的变化,用于检测蛋白质表面的疏水位点的变化,表征蛋白质的变性程度[26]。在评价蛋白质物理化学性质及结构变化的过程中,蛋白质表面疏水性有重要作用,其可以表达蛋白质分子间的相互作用能力[27],在一定程度上能反映蛋白质的氧化程度,且与蛋白质的功能性质联系紧密[28]。
羟自由基氧化对鹰嘴豆蛋白表面疏水性的影响见图3。
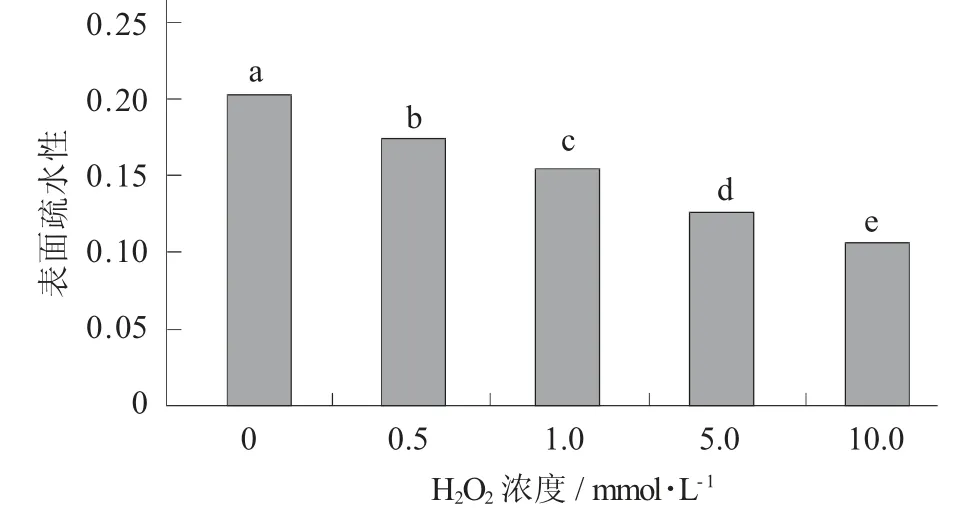
图3 羟自由基氧化对鹰嘴豆蛋白表面疏水性的影响
由图3可知,鹰嘴豆蛋白的表面疏水指数随着羟自由基浓度的增加而显著下降,从0.202 7降低至0.106 2(p<0.05)。其中,吴伟等人[29]研究结果表明被氧化后的大豆蛋白空间结构易发生变化,从而导致蛋白表面疏水性下降。蛋白质被羟自由基氧化发生变性,导致蛋白质结构遭到破坏,使内部部分氨基酸残基(指脂肪族与芳香族等氨基酸残基)被氧化,使位于蛋白质内部的疏水性基团暴露,在疏水作用下,这些暴露的基团相互作用,使得氧化蛋白聚合形成蛋白聚集体,从而导致蛋白质的表面疏水性降低[30];此外,由于氧化使蛋白结构打开又重新组合,使疏水基团嵌入,新的亲水基团形成(如羰基),导致疏水基团下降[31]。实际的表面疏水性主要是由蛋白质中分散的或聚集的颗粒决定的[32],蛋白质共价聚集,导致部分疏水基团掩埋,从而使蛋白质的疏水基团数量减少,由此说明其结构得到改变[17]。
2.4 羟自由基氧化对鹰嘴豆蛋白内源荧光的影响
在一定激发波长照射下,含有色氨酸(Trp)残基、酪氨酸(Tyr)残基和苯丙氨酸(Phe)残基等芳香族氨基酸残基的蛋白质会产生荧光,称为内源荧光[33]。例如,确定蛋白质内色氨酸残基的相对位置及表示蛋白质结构改变均可以通过色氨酸最大内源荧光发射波谱实现[34]。同时,蛋白质内色氨酸残基被氧化程度及其微环境的变化也可通过色氨酸最大内源荧光发射波谱表示,进而能够表征羟自由基氧化蛋白质后对其三级结构的影响[17]。
羟自由基氧化对鹰嘴豆蛋白内源荧光的影响见图4。
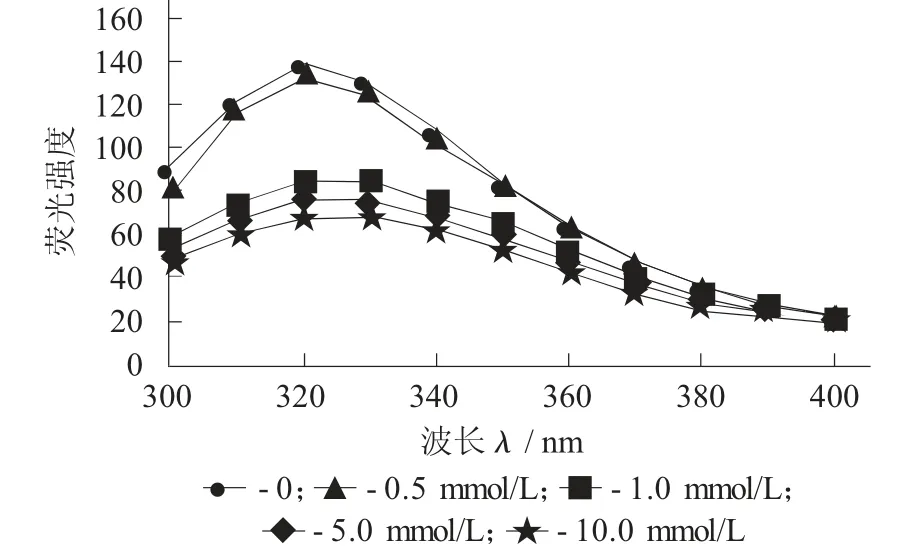
图4 羟自由基氧化对鹰嘴豆蛋白内源荧光的影响
由图4可知,天然鹰嘴豆蛋白最大荧光峰位在320 nm处。当过氧化氢氧化体系浓度从0增加到10 mmol/L时,鹰嘴豆蛋白λmax强度从141.24降低到70.37,最大荧光峰位发生蓝移。其荧光蓝移,说明随着氧化程度的增加,色氨酸被转移到更加疏水的非极性环境中。Ye L等人[35]研究花生蛋白氧化对结构影响时发现,随着活性氧自由基浓度的增加,花生蛋白荧光强度逐渐下降且最大荧光峰位蓝移,造成荧光强度下降的原因是氧化蛋白形成蛋白聚集体,使色氨酸进入内部的非极性环境。Wu W等人[36]研究氧化大豆蛋白时,结果表示氧化大豆蛋白最大内源荧光蓝移,表明大豆蛋白质内被确定位置的色氨酸残基经氧化后而被掩蔽,使得蛋白质聚集。由上述结果表明,内源荧光强度下降,是羟自由基氧化体系浓度的增加使得色氨酸使色氨酸的微环境变为亲水。进而可以得出结论,氧化可以使鹰嘴豆蛋白的构象发生变化。
2.5 羟自由基氧化对鹰嘴豆蛋白溶解度的影响
影响蛋白质溶解度的因素主要分为内因和外因,如蛋白质-蛋白质和蛋白质-水之间相互作用均会影响蛋白质的溶解。
羟自由基氧化对鹰嘴豆蛋白溶解度的影响见图5。
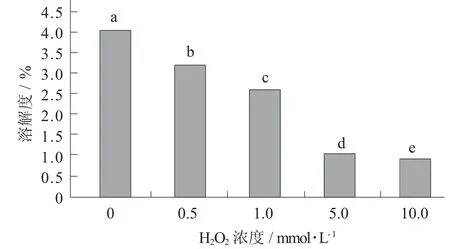
图5 羟自由基氧化对鹰嘴豆蛋白溶解度的影响
由图5可知,随着H2O2浓度的增加,溶解度逐渐降低,且蛋白溶解度由4.08%降低至0.87%。鹰嘴豆蛋白样品溶解度下降是因为低浓度的羟自由基氧化使得鹰嘴豆蛋白形成了可溶性聚集体,而高浓度的羟自由基氧化导致的共价交联使得产生的可溶性聚集体进一步发生聚集形成不可溶性聚集体[37]。吴伟等人[38]在研究过氧自由基氧化大米蛋白时发现,大米蛋白共价交联形成不可溶性聚集体,使得大米蛋白溶解性降低,蛋白质与脂质氢过氧化物相结合之后,使得蛋白质的能态发生变化,引起蛋白质变性是导致蛋白质溶解度降低的内在原因。而在邓克权[39]的研究中也可得出氧化使得大豆球蛋白乳化性、乳化稳定性、起泡性、泡沫稳定性、凝胶硬度及凝胶强度下降。由试验结果可以得出,氧化对蛋白溶解度影响比较大。
3 结论
通过研究可以看出,鹰嘴豆蛋白经过羟自由基氧化后,其结构发生明显改变,并随着浓度的改变发生不同程度的改变。随着H2O2浓度的增加,蛋白质羰基含量、二聚酪氨酸含量呈现显著增加趋势(p<0.05);表面疏水性从0.202 7降低到0.106 2(p<0.05);内源荧光强度显著下降且最大荧光峰位发生蓝移;蛋白质溶解度显著降低。因此,在鹰嘴豆蛋白加工和贮藏过程中应采取措施防止鹰嘴豆蛋白发生氧化,并对活性氧自由基诱导蛋白质氧化对其结构及溶解度提供相关理论依据。
