耐硒芽孢杆菌的筛选及其亚硒酸盐还原机制的探究
2021-11-14余雍和程水源王璋倩
杨 锐,余雍和,程水源,2,3, ,王璋倩,2,3,
(1.武汉轻工大学生命科学与技术学院武汉轻工大学国家富硒农产品加工技术研发专业中心,湖北武汉 430023;2.武汉轻工大学国家富硒农产品加工技术研发专业中心,湖北武汉 430023;3.武汉轻工大学硒科学与工程现代产业学院,湖北武汉 430023)
硒对生物体而言是一种必不可少的微量元素,日常中补充不足会增加许多慢性疾病的风险,如血浆中硒浓度较低时前列腺癌风险会增加4~5倍[1];当人体血硒浓度低于45 μg/L以上时,其心血管疾病的发病率和病死率会增加2~3倍[2];Peter等[3]在元素硒防治癌症的试验中发现,8年后随访试验组患者癌症病死率降低了48%。硒缺乏症在世界各地的人群中普遍存在,因此,有必要在日粮中添加富硒食品来补充这种微量营养素的不足。在膳食补充中,一般添加无机硒(如亚硒酸盐)或有机硒(如硒代半胱氨酸)。无机硒不易被人体吸收且安全剂量范围较窄,高浓度时存在一定的毒性,有机硒吸收与安全性相对较好,但自然界中含量少,生产成本高,因此寻求安全性更高且经济效益好的补硒方式迫在眉睫[4]。近年来,一些研究发现纳米形态的单质硒体内活性强、毒性低、吸收好[5]。如从生物功效来看,纳米硒表现出较高的自由基清除能力和抗癌活性,纳米硒在体外清除羟基自由基的效率为无机硒的5倍,为有机硒的2.5倍[6]。基于纳米硒的特殊性质,目前对硒功能化的研究正在迅猛发展[7]。
环境中微生物在硒的生物地球化学循环中起主要作用[8]。一些水生和土壤细菌已被证明能抵抗硒氧阴离子,并将其还原为元素硒或甲基化硒形式,从而降低生物利用率和毒性,在环境修复中也具有研究意义[9]。此外,利用微生物合成纳米硒,生产成本低,而且生物法生成的纳米硒结构稳定,分散性好[10]。虽然近几年对微生物还原亚硒酸钠生成单质硒的研究逐渐成为热点,但是关于细菌细胞还原产生红色单质硒的机理研究较少,不同的细菌,由于所含酶类及参与氧化还原反应物质的不同,可能存在不同的还原机理。如生物体内的蛋白质等活性硫醇基团能够与亚硒酸盐反应生成纳米硒(selenium nanoparticles,SeNPs),这被认为是一种微生物的脱毒机制[11~12]。此外,研究表明[13],在毫摩尔浓度的亚硒酸盐生长的枯草杆菌中大量诱导硫氧还蛋白和硫氧还蛋白还原酶。芽孢杆菌中硒还原的机制,以bacillithiol(烟酸硫醇)的参与为先决条件[14]。有关亚硒酸盐在微生物中的转化机制仍在不断探索中。研究发现,微生物可在胞外或胞内多个位点还原积累SeNPs,如表1所示,不同的细菌还原酶系不同,对应的酶还原活性部位也有所差异。
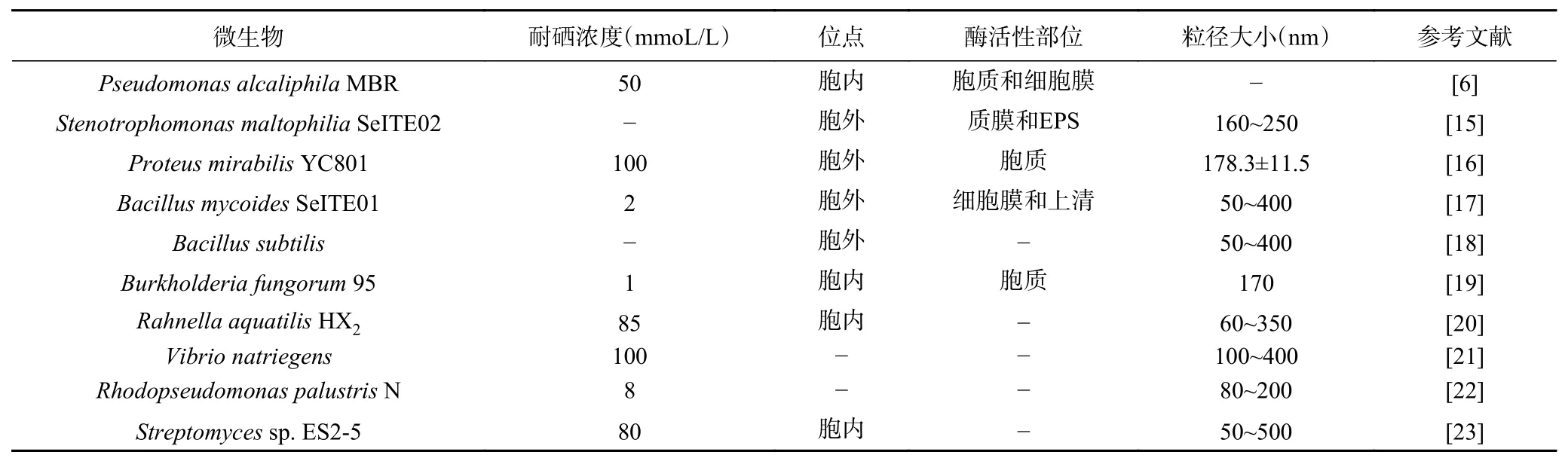
表1 部分微生物合成纳米硒颗粒的特性Table 1 Characteristics of SeNPs synthesized by some microorganisms
芽孢杆菌(Bacillus)对外界有害因子抵抗力强,分布广,存在于土壤、水、空气以及动物肠道等处,大多数对人体无害,且具有利用价值。目前对芽孢杆菌亚硒酸钠还原机理和纳米硒形成机理研究较少。本文从长期施加硒肥的大豆种植基地的土壤中筛选出一株耐硒能力较高的细菌高山芽孢杆菌(Bacillus altitudinisF4),探究该菌对亚硒酸钠的还原作用。测定该细菌对亚硒酸盐的耐受能力并对还原过程中其生长动力学进行监控。最后结合体外还原试验初步探究该菌亚硒酸盐还原和单质硒合成的可能机制,旨在为提高利用生物法合成纳米硒的产率、富硒微生物的开发、富硒产品的研发提供理论指导和技术支撑。
1 材料与方法
1.1 材料与仪器
采样土壤 长期施加硒肥的大豆种植基地;亚硒酸钠(Na2SeO3) Sigma;酵母提取物、胰蛋白胨
青岛海博生物;磷酸二氢钾、磷酸氢二钾、氯化钠、硫酸镁 武汉维基生物;还原型辅酶Ⅰ(NADH)、还原型辅酶Ⅱ(NADPH) 生工生物工程(上海)股份有限公司。
HNY-2012C型恒温培养振荡器 天津市欧诺仪器仪表有限公司;电子分析天平 赛多利斯科技有限公司;UV1802G型紫外可见分光光度计 上海光谱仪器有限公司;Eppendorf AG22331 Hamburg型PCR扩增仪 德国Eppendorf公司;DYY-7型DNA电泳仪 北京六一仪器厂。
1.2 实验方法
1.2.1 菌种筛选、分离及鉴定
1.2.1.1 菌种筛选及分离 土壤样品选择距地表10 cm深处。为了筛选得到芽孢杆菌,称取土样置于65 ℃的烘箱中1 h,后用无菌水进行稀释。稀释样品涂布于LB平板上,33 ℃培养箱培养24 h。分离纯化的菌株接种到含Na2SeO3的培养基中,于33 ℃培养箱培养72 h后观察菌落颜色。挑选红色菌落进行复筛,得到纯化的亚硒酸钠还原菌命名为F4用于后续试验。
1.2.1.2 菌株种属鉴定 细菌的革兰氏染色试验和细胞形态观察在100×油镜下进行;细菌的生理生化鉴定试验按照伯杰氏细菌鉴定手册要求进行。
以提取的基因组DNA为模板,以通用引物27-F:5’-GAGAGTTTGATCCTGGCTCAG-3’和1492-R:5’-ACGGGCGGTGTGTRC-3’进行16S rRNA基因扩增。扩增后得到的产物送上海生工生物有限公司进行测序;得到的序列提交到EzBioCloud数据库中进行比对并进行BLAST比对。利用MAGA 7.0采用邻近法(Neighbour-Joining)构建进化树。
细菌的革兰氏染色试验和细胞形态观察在100×油镜下进行;细菌的生理生化鉴定试验按照伯杰氏细菌鉴定手册要求进行。
1.2.2 菌株生长动力学 取适量菌液接种到含100 mL LB培养液的三角烧瓶中(OD600约为0.02),在33 ℃下培养,测定生长曲线并检测菌株生长对数期。不加亚硒酸钠作为对照。在菌株生长的对数前期加硒,测定菌株在含硒培养基中的生长曲线。将不同浓度的Na2SeO3加入细菌溶液中,至终浓度分别为25、50、100 mmoL/L,并在33 ℃下继续培养。在整个培养过程中,每2 h测量一次细胞浓度(OD600),并绘制生长曲线。
1.2.3 耐硒浓度测定 将菌株F4接种到LB液体培养基中摇培并进行生长曲线测定。待其在LB液体培养基生长至对数期后,调节菌液浓度后按10~106进行一系列梯度稀释。取100 μL上述梯度稀释菌液涂布于含50、100、150、200、250 mmoL/L亚硒酸钠平板上,以不加硒作为对照组。涂布均匀后于33 ℃培养箱静置培养72 h。待长出菌落形态后进行计数,通过公式计算菌株在不同亚硒酸钠平板上的存活情况。

1.2.4 亚硒酸盐还原活性分析
1.2.4.1 细胞组分蛋白的提取 取对数期菌株,6000×g下离心5 min,上清过0.2 μm滤膜,-20 ℃密封储存备用。沉淀重悬于磷酸盐缓冲盐水(PBS,pH7.2)洗涤,并超声处理3 min后,以6000×g离心5 min以去除细胞碎片。收集沉淀备用。再将上述菌体置于预冷后的研钵中,倒入液氮充分研磨,用预冷的PBS将破碎的菌体溶解,超声(250 W,70次,间隔5 s)10 min,得到细胞研磨液。细胞研磨液于6000×g,4 ℃,离心5 min,得到的沉淀为细胞碎片,-20 ℃密封储存备用。将上清(细胞质和细胞膜的混合物)20000×g离心60 min,上清为细胞质,沉淀为细胞膜,-20 ℃密封储存备用。向上步得到的细胞碎片中各加入1 mL的0.1%的Triton×100,振荡均匀(约1 min),然后再于6000 ×g,4 ℃,离心5 min,收集上清,此为细胞周质,-20 ℃密封储存,备用[17]。
1.2.4.2 上清液的提取 将培养液4 ℃下12000×g,离心30 min,收集上清,过0.22 μm滤膜,备用。
1.2.4.3 胞外多糖(EPS)的提取 培养菌液于4 ℃下12000×g,离心30 min,收集上清,过0.22 μm滤膜,并用等体积预冷乙醇混合,-20 ℃下预冷沉淀。4 ℃下12000×g,离心30 min,收集沉淀即胞外多糖(EPS),用无菌ddH2O溶解。
1.2.4.4 硒还原活性检测 使用以下反应混合物测定亚硒酸盐还原酶的活性:培养上清液,细胞质和膜级分;亚硒酸钠(终浓度为0.2 mmoL/L);NADPH或NADH(终浓度为0.2 mmoL/L)。将反应混合物在28 ℃下孵育36 h。分别以不添加培养上清液,细胞质或膜级分的反应混合物作为对照[16]。
1.3 数据处理
实验中的数据均为3次重复。MAGA 7.0采用邻近法(Neighbour-Joining)构建进化树,bootstrap设置为1000次。GraphPad Prism 8.0绘制图表。
2 结果与分析
2.1 菌株的分离鉴定
2.1.1 菌株形态学和生理生化特征 在电子显微镜下观察细胞形态是短杆状的结构见图1。F4菌株在33 ℃下培养24 h后菌落形态为不透明,呈乳白色,表面有褶皱,边缘完整,不粘稠。革兰氏染色为阳性。
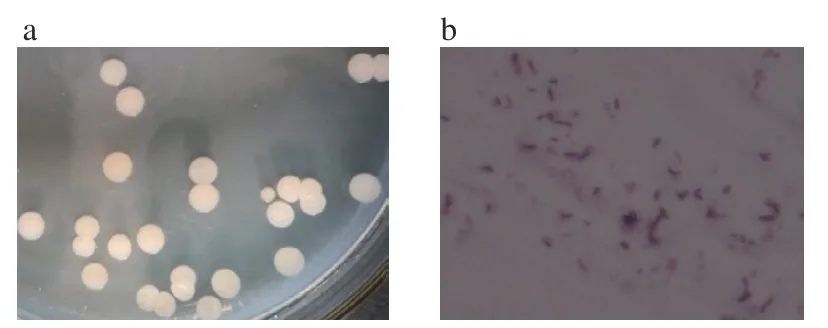
图1 F4菌株在LB平板上的菌落形态(a)和100倍电子显微镜下细胞形态(b)Fig.1 Colony morphology of F4 strain on LB plate (a) and 100-fold electron microscopic cell morphology (b)
菌株生理生化试验结果如表2。结果表明,菌株F4能分解利用葡萄糖、蔗糖、甘露糖和阿拉伯糖,在明胶培养基中能分解明胶,氧化酶试验、枸橼酸盐利用、V-P试验和接触酶实验为阳性。对照伯杰氏手册符合芽孢杆菌属的生理生化实验结果。

表2 细菌F4生理生化特征Table 2 Biochemical and physiological characteristics of the bacterial isolate F4
2.1.2 菌种鉴定 通过16S rRNA测序鉴定,获得的细菌16S rRNA序列在EzBioCloud数据库中进行比对,发现与模式菌Bacillus altitudinis16S相似度为99.2%。基于Neighbour-Joining的系统发育分析结果如图2,菌株与高山芽孢杆菌Bacillus altitudinis聚在同一分支中,自检支持率达96%,表明该菌株与Bacillus altitudinis有较高的同源性。综上将该菌株命名为Bacillus altitudinisF4。
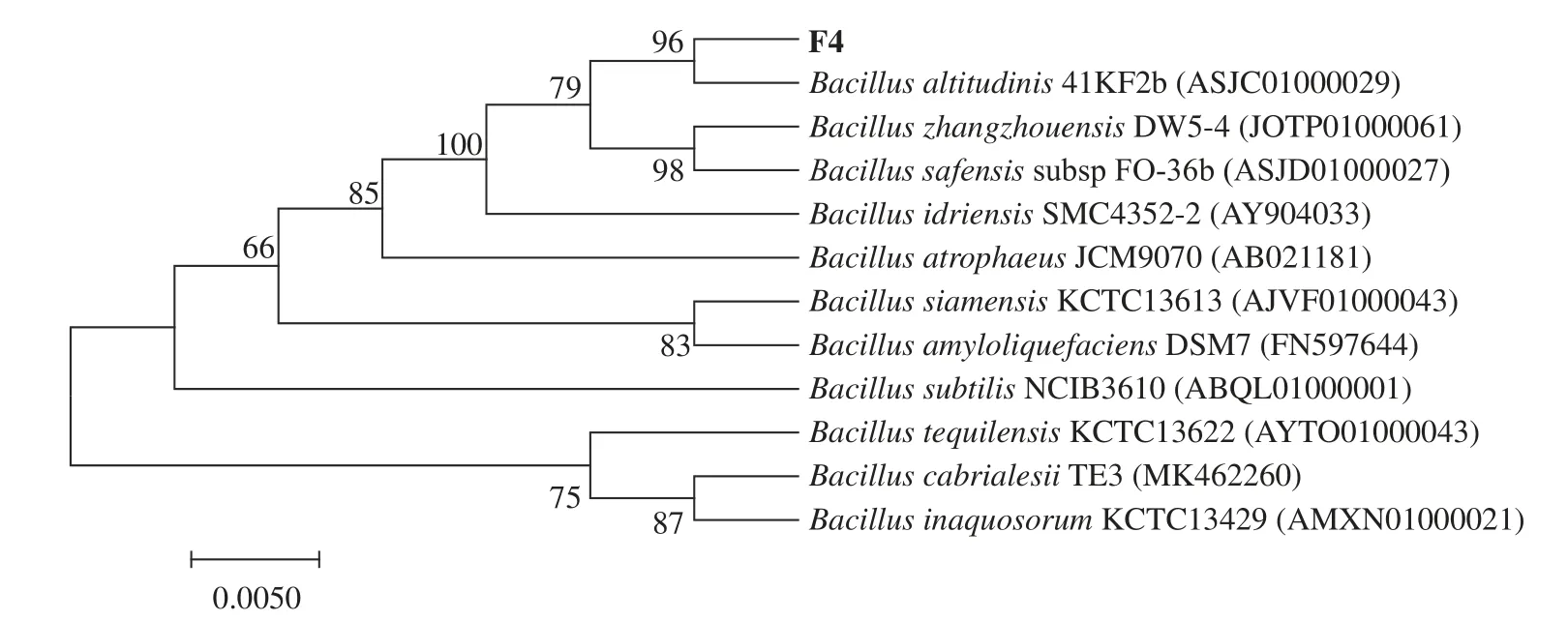
图2 系统发育树分析Fig.2 Phylogenetic tree analysis
2.2 不同亚硒酸钠浓度下菌株F4生长曲线
通过绘制生长曲线得知,菌株在LB培养液中培养时,经过4 h的延滞期后进入对数期。有研究表明加硒时间越早,对菌株生长的抑制作用越强[23]。前期测定了F4的生长曲线,分析得该菌株在4 h开始从延滞期过渡,在6 h进入对数期(图3中对照组(CK)即为不加硒时菌株生长曲线)。本试验确定在菌株生长对数前期即6 h时添加亚硒酸钠,此时菌株生长相对较快且菌体密度可到最大。如图3,试验观察到添加亚硒酸盐后8 h内即菌株总培养14 h时,菌株的生长与不加硒相比较缓慢,浓度到达100 mmoL/L时几乎停滞生长,过了该时期后菌株生长16~48 h进入对数期,50 h后到达稳定期。如图4,在前10 h时间内,在其生长过程中,培养液首先变浑浊,然后进入对数期,从14 h后开始颜色慢慢由淡黄色变为深红色,且添加亚硒酸钠浓度越高,溶液颜色越浅。但到对数后期和稳定期可以观察到培养基中均会产生红色沉淀,表明该菌株在含亚硒酸盐的液体中会先生长后发生还原反应,且在生长后会恢复原状。在相对低浓度25和50 mmoL/L,其对数后期及稳定期含Na2SeO3的吸光度值要高于不含Na2SeO3的LB培养液。在Avendaño等[24]和袁永强等[25]的研究中也观察到了同样的现象,可能原因是Na2SeO3抑制细胞分裂而使细胞体积增大,在经过长时间生长后,细胞密度要大于对照,因而表现吸光度增加现象。Wang等[15]对Proteus mirabilisYC801的研究发现亚硒酸盐的还原发生在指数生长期后期直到稳定期,而且与高浓度的亚硒酸盐相比,该菌对低浓度的还原更快。但是Fernández-Llamosas等[26]发现固氮弧菌属(Azoarcus)仅在稳定期开始消耗亚硒酸盐和形成纳米硒。
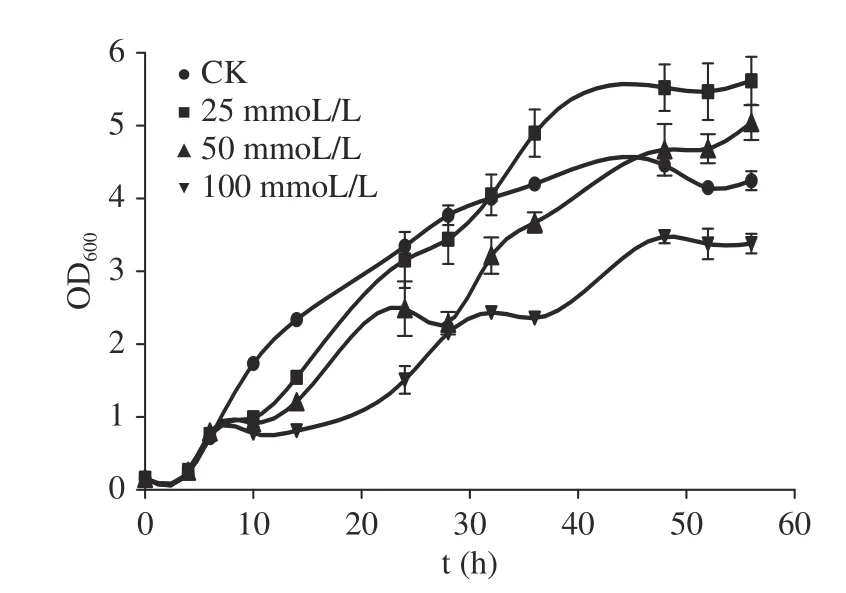
图3 不同亚硒酸钠浓度下B. altitudinis F4生长动力曲线Fig.3 Growth curve of B. altitudinis F4 under different sodium selenite concentrations

图4 在含亚硒酸钠培养基中菌株分别在不同时间的生长情况Fig.4 Growth of strains in a medium containing sodium selenite at different time
2.3 菌株F4耐硒能力
如图5可观察到,在37 ℃下培养72 h后,与不加硒的LB平板(图5a)相比,菌株在100 mmoL/L的含亚硒酸钠平板(图5b)中,形成的红色菌落菌落大小明显变小。
在较低浓度50 mmoL/L亚硒酸钠平板中,菌株菌落生长较好,存活率为37.08%(图6)。在高浓度250 mmoL/L亚硒酸钠平板中,观察到3~6个单菌落,存活率较小。因此判断B. altitudinisF4最高可耐250 mmoL/L亚硒酸钠。浓度越高,对菌株抑制作用越强。菌落大小会随着亚硒酸钠浓度的升高而变小,这也表明了较高亚硒酸钠对细菌具有毒害作用。已报道的微生物的耐硒浓度普遍在1~100 mmoL/L。沼泽红假单胞菌N(Rhodopseudomonas palustrisN)耐硒浓度为8 mmoL/L[21],链霉菌ES2-5(Streptomycessp.ES2-5)为80 mmoL/L[22],奇异假单胞菌YC801(Proteus mirabilisYC801)最高耐硒浓度达100 mmoL/L[15]。B. altitudinisF4耐硒浓度可达250 mmoL/L,耐硒能力为较高水平。
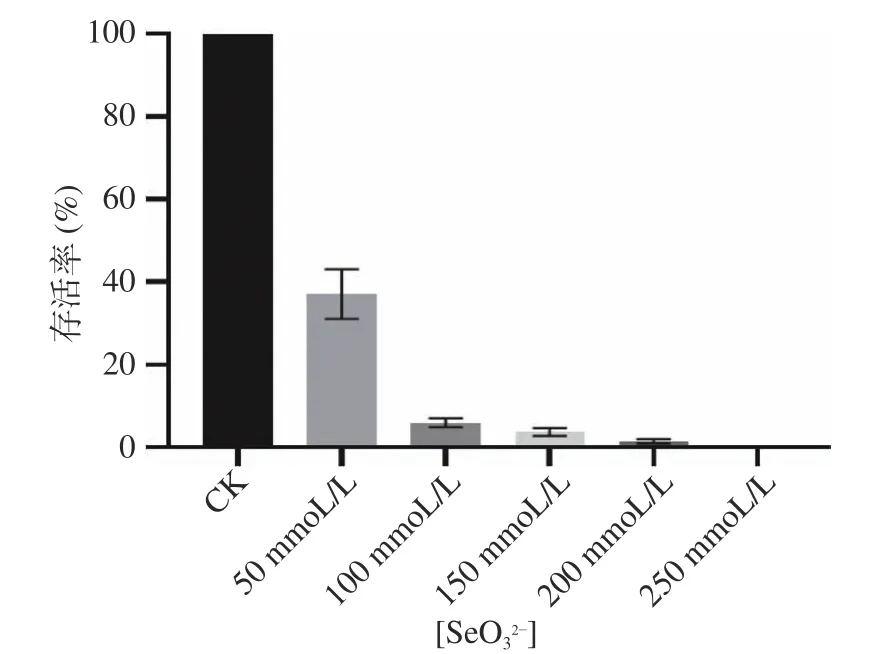
图6 在不同浓度亚硒酸钠平板中B. altitudinis F4存活率Fig.6 Survival rate of B. altitudinis F4 in different concentrations of sodium selenite
2.4 纳米硒合成部位的亚细胞定位
利用体外还原试验对亚硒酸盐还原反应在细菌培养中的定位进行了研究,如图7,分离得到的上清液组分中发现颜色变化明显,有红色沉淀生成,表明亚硒酸盐的还原活性主要存在于上清液中,可能是含有某种生物活性分子。同时也观察到在NADH存在的条件下,细胞质中也有略微的还原活性,推测此反应为酶促过程,因此需要电子供体。Lampis等[16]研究Bacillus mycoidesSeITE01还原活性机理发现在依赖于NADH亚硒酸盐还原主要存在于膜组分,且在上清液中也有略微还原活性。因此,根据B.altitudinisF4还原亚硒酸盐试验,推测该菌还原可能是由于细菌细胞释放或在质膜被激活的蛋白质的作用,且在还原合成过程中起到一种还原酶的性质。杨颖等[27]研究属于β变形菌门的贪铜杆菌(Cupriavidussp. SHE)细胞组分合成纳米硒能力的研究中发现,细胞上清液具有更强的合成纳米硒的能力,推测可能是贪铜杆菌能分泌某些生物活性分子,例如谷胱甘肽(glutathione,GSH)等,能在胞外作为还原剂还原亚硒酸钠为单质纳米硒颗粒。有研究发现多种芽孢杆菌如Bacillus megaterium[11]、Bacillus selenitireducens[20]、Bacillus subtilis[13]与亚硒酸盐作用之后能够诱导硫氧还蛋白与硫氧还蛋白还原酶的表达。在B.altitudinisF4还原过程中硫氧还蛋白和硫氧还蛋白还原酶或其他酶系在还原过程中起作用需在未来试验中进一步考察研究。

图7 对具有亚硒酸盐还原活性的不同细胞部位和培养液进行酶促测定Fig.7 Enzymatic assay on different cell compartments or culture broth fractions with selenite reduction activity
3 讨论
本试验筛选出了一株耐硒能力较强的高山芽孢杆菌(Bacillus altitudinisF4),确定了在平板培养中菌株的最高耐硒浓度,测定了菌株生长动力曲线。大多数文章在探究菌株对亚硒酸钠的耐硒能力时,以菌株与不同浓度硒共发酵过程中的颜色变化为指标来确定菌株最高耐硒浓度,这种方法主观性较强。本试验在该基础上,将一系列浓度梯度的菌液分别涂布在不同浓度的亚硒酸钠平板上,根据平板菌落数计算存活率来确定最高耐硒浓度平板,B. altitudinisF4耐硒能力较强,这为找寻其还原的部位、还原机理提供很好的材料。图5 菌株F4分别在LB(a)和100 mmol/L亚硒酸钠(b)平板中菌株菌落形态
Fig.5 Morphology of bacterial F4 colonies in LB (a) and 100 mmoL/L sodium selenite plates (b)本文通过体外进行亚硒酸盐还原试验,初步判断纳米硒合成的机制。在试验中观察到上清液颜色变化明显,有红色沉淀,表明SeNPs合成主要存在于上清液中。同时也观察到在NADH存在的条件下,细胞质中也有略微的还原活性。该菌合成纳米硒可能是由于分泌了某种活性分子,在还原过程中起到还原酶的作用。但是关于导致亚硒酸盐离子还原为元素硒形式的确切机制没有阐明,推测可能是某些生化还原剂仅通过对前体“应激”的反应而被微生物排出[18]。细菌还原亚硒酸盐的不同酶系分布在细胞不同的部位。如Burkholderia fungorum[19]存在于细胞质中;Thauera selenatis菌的周质中[28];在Rhodobactersp. NKPB030619菌株的细胞外及EPS发现还原活性[29]。目前关于各种酶介导微生物还原亚硒酸钠的可能机制主要有谷胱甘肽和谷胱甘肽还原酶途径;硫氧还蛋白和硫氧还蛋白还原酶途径;亚硫酸盐还原酶和亚硝酸盐还原酶途径[30],还有其他物质或酶介导,如Shewanella oneidensisMR-1周质中的富马酸酯还原酶(Fumarate reductase)[31]。有关介导B. altitudinisF4合成纳米硒的生物活性因子或酶系种类的确定,后期阶段将继续进行更多的试验来探究亚硒酸盐的还原过程中的机理和纳米硒的合成机制。最终以期得到工业化菌株,以此能大规模利用细菌合成纳米硒,应用于食品、农业和畜牧业、药物开发等领域[32-34]。
