Fonsecaea monophora聚酮合酶基因的CRISPR-Cas9敲除载体的构建
2021-11-01李敏英黄欢李倩骆明芬王晓悦刘红芳曾维英席丽艳
李敏英 黄欢 李倩 骆明芬 王晓悦 刘红芳 曾维英 席丽艳,2
(1.南方医科大学皮肤病医院,实验研究中心,广州 510091;2.中山大学孙逸仙纪念医院皮肤科,广州 510120)
关于Fonsecaea黑化的报道显示,病原体能够产生分泌型的,以及与细胞壁相关的黑色素样组分[1-3]。这些黑色素是免疫激活剂,参与宿主免疫细胞的相互作用[4-5],而且对抗真菌药物敏感性的影响并不一致[6-8]。Fonsecaeamonophora是近年发现的新种[9],是我国南方地区着色芽生菌病(chromoblastomycosis, CBM)的主要致病菌[10-11]。真菌黑素的主要合成途径是1,8-二羟基萘(DHN)途径和二羟苯基丙氨酸(DOPA)途径,着色霉菌属主要合成DHN-黑素[12-13],而聚酮合酶PKS1(polyketide synthases,PKS1)调控DHN-黑素合成起始,常被作为靶点来获得黑素缺陷株。因此,敲除F.monophora聚酮合酶PKS1,研究其对各种环境因素的抵抗力、毒力,对于阐明黑化过程中所涉及的生理过程和疾病的发病机制至关重要。
本研究旨在利用CRISPR-Cas9系统对F.monophora进行基因编辑,但由于原有的pFC334质粒上的筛选基因是鸟氨酸氨甲酰基转移酶基因(argB),是营养缺陷型筛选,需先获得argB营养缺陷型菌株,后把进行argB基因载体转化,才能在基本培养基中筛选到阳性转化子,实验过程繁琐,并且原有gRNA骨架上缺乏酶切位点,而pFC332质粒上无gRNA骨架,所以在原有的两个载体上进行改造,简化了实验过程,构建PKS1基因的CRISPR-Cas9敲除载体,以期利用原生质体法获得PKS1基因缺陷株,为研究F.monophoraPKS1基因的功能及DHN-黑素的作用奠定基础。
1 材料和方法
1.1 材料
pFC334质粒和pFC332质粒从上海柯雷生物科技有限公司购得。切胶回收试剂盒、质粒提取试剂盒、DH5α感受态细胞(北京天根生化科技有限公司)。Primes TAR©Max DNA Polymerase,DNA Marker, In-Fusion HD Cloning Kit(大连宝生物工程有限公司)。PCR仪(美国伯乐BIO-RAD公司),限制酶内切酶MreⅠ,PstⅠ,BglⅡ,T4连接酶(ThermoFisher Scientific公司)。quick ligationTM kit(NEB公司)所有相关引物如表1所示。所有引物合成(PAGE纯化方式)及测序工作由北京擎科新业生物技术有限公司完成。
1.2 方法
设计gRNA 在我们前期的研究中,通过对F.monophora转录组的测序,获得了PKS1基因的cDNA全长序列,然后利用在线设计网站(http://crispor.tefor.net/),选择物种为F.monophora,获得可用的gRNA,挑选分数较高的四条gRNA插入到Cas9载体中(见表1)。
构建PKS1基因的CRISPR-Cas9敲除载体 ①敏感性检测:将F.monophora于潮霉素B浓度为0、100、200、300、400 μg/mL的PDA抗性平板上划线,25℃培养1周后,拍照观察判断是否抗性适用于筛选阳性转化子。②构建含有潮霉素抗性的pFC334-AarⅠ载体:设计引物在gRNA骨架前插入两个AarⅠ酶切位点(见表1),pFC334质粒作为模板,分别扩增相对应的两个片段(1号和2号片段),PCR条件:98℃ 10 s,55℃ 10 s,72℃ 1 kb/min,30 cycles。切胶回收纯化后融合成一个片段(片段1),利用Touchdown PCR进行融合,PCR条件:98℃ 10 s,65~55℃(每个cycles降1℃) 10 s,72℃ 1 kb/min,10cycles,98℃ 10 s,55℃ 10 s,72℃ 1 kb/min,20cycles。用MreⅠ和PstⅠ对pFC334质粒和PCR产物进行酶切,37℃孵育4~6 h,回收后,使用Takara In-Fusion HD Cloning Kit连接融合片段1和pFC334线性化载体后,转化至大肠杆菌DH5α感受态中,涂平板后,37℃过夜培养,次日挑取单菌落送擎科公司测序。将测序成功的重组质粒命名为pFC334-AarⅠ。③构建pFC332-gRNA-AarⅠ载体:用限制性内切酶MreⅠ和BglⅡ对pFC332质粒和pFC334-AarⅠ质粒进行酶切,获得线性化的pFC332载体和已经插入AarⅠ酶切位点的gRNA骨架片段,对两者进行胶回收纯化后,用T4连接酶把片段连到pFC332载体上,转化及涂平板后,37℃过夜培养。次日挑取上述平板中的单菌落,做菌落PCR鉴定,验证载体是否构建成功。pFC332质粒和pFC332-gRNA-AarⅠ质粒图谱(质粒改造前后图谱)(见图1、2)。④连接gRNA:用AarⅠ对pFC334-HygR质粒和PCR产物进行酶切后,把设计好和退火后的gRNA连到载体上。

表1 所用引物Tab.1 Specific primers in this study

(续表)
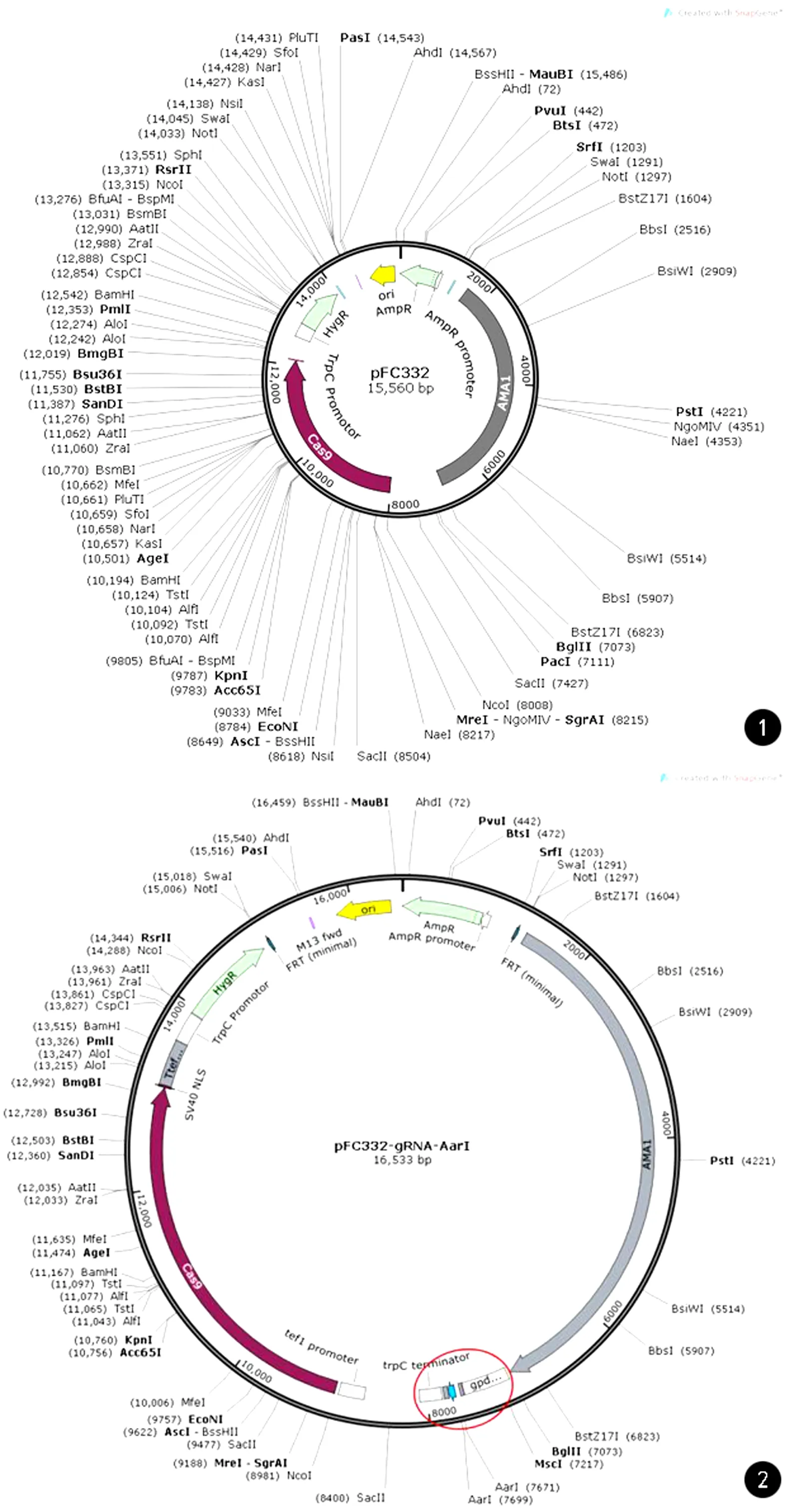
图1 pFC332质粒图谱 图2 pFC332-gRNA-AarⅠ质粒图谱(被改造后的插入片段指示在红色框内)Fig.1 Profile of pFC332 plasmid Fig.2 Profile of pFC332-gRNA-AarⅠ plasmid (The modified insert was indicated in the red box)
2 结 果
敏感性检测确证潮霉素可用于F.monophora抗性筛选 在PDA加入不同浓度的潮霉素检测菌体的敏感性,结果如图3显示该菌对潮霉素敏感,在含有潮霉素的培养基中不能生长,可用潮霉素于F.monophora基因敲除操作中的抗性筛选。
利用高保真酶扩增所需片段 以pFC334质粒(17327 bp)作为模板,使用AarⅠ-gRNA和PstI amplify引物(见表1),利用高保真酶分别扩增相对应的1号(1.5 kb左右)和2号片段(3.5 kb左右),结果图4中的均为目的片段,条带均单一,可用于下一步胶回收后融合片段。
利用高保真酶获得所需的融合片段 把上一步扩增获得的片段进行融合,1号和2号片段融合成片段1,电泳后,结果图5中红色框内的为目的片段(5 kb左右),切胶回收后用于下一步的实验。
获得pFC334-AarI载体 使用PstⅠ和MerⅠ酶对pFC334载体进行酶切,跑胶鉴定,结果如图6所示,从而结果可以得出载体已线性化,切胶回收线性化载体后,连接片段1后测序结果显示已获得序列正确的pFC334-AarⅠ载体。
获得pFC332-gRNA-AarⅠ载体 对pFC334-AarⅠ进行双酶切后,获得目的片段(2 kb左右),并使用同样的酶线性化pFC332载体后,跑胶鉴定,结果如图7所示,连接后挑选单菌落,菌落PCR鉴定结果如图8所示。选取阳性单菌落测序,获得测序成功的重组质粒,命名为pFC332-gRNA-AarⅠ。
连接靶点和载体 使用NEB的quick ligationTMkit连接退货后的靶点与使用AarⅠ酶线性化的pFC332-gRNA-AarⅠ载体(结果如图9所示),挑取单菌落测序,并已测序成功,获得连接各靶点的载体(pFC332-PKS1-T1,2,3,4) 。

图3 F. monophora潮霉素B抗性检测. A. PDA培养基;B. 含100 μg/mL潮霉素B的PDA培养基; C. 含200 μg/mL潮霉素B的PDA培养基; D. 含300 μg/mL潮霉素B的PDA培养基; E. 含400 μg/mL潮霉素B的PDA培养基 图4 扩增获得的1号和2号片段. A. M:15 kb DNA Marker,1-8:1号扩增片段(1.5 kb左右),9:阴性对照(不加模板);B. M:15 kb DNA Marker,1:阴性对照(不加模板),2-6:2号扩增片段(3.5 kb左右) 图5 融合后的片段1. M:15 kb DNA Marker, 1:阴性对照(不加模板);2:目的片段(红框内)图6 pFC334载体双酶切. M:15 kb DNA Marker, 1: pFC334载体双酶切前;2: pFC334载体双酶切后 图7 pFC332和pFC334-AarⅠ载体双酶切. M:15 kb DNA Marker, 1: pFC332载体双酶切后;2: pFC334-AarⅠ载体双酶切后 图8 pFC332-gRNA-AarⅠ阳性菌落鉴定. M:15 kb DNA Marker, 1:阴性对照(不加模板);2: pFC332;2-12:挑取的单菌落 图9 pFC332-gRNA-AarⅠ载体单酶切. M:15 kb DNA Marker, 1:阴性对照;2: pFC332-gRNA-AarⅠ载体单酶切后Fig.3 Detection of hygromycin B resistance of F. monophora. A. PDA medium; B. PDA medium containing hygromycin B (100 μg/mL); C. PDA medium containing hygromycin B (200 μg/mL); D. PDA medium containing hygromycin B (300 μg/mL); E. PDA medium containing hygromycin B (400 μg/mL) Fig.4 Fragment 1and 2 obtained by amplification. A. M: 15 kb DNA Marker, 1-8: Amplified fragment 1 (about 1.5 kb), 9: Negative control (without template); B. M: 15 kb DNA Marker, 1: Negative control (without template), 2-6: Amplified fragment 2 (about 3.5kb) Fig.5 Fragment 1 after ligation. M: 15 kb DNA Marker, 1: Negative control (without template); 2: Target fragment (in red box) Fig.6 Double enzyme digestion of pFC334 vector. M: 15 kb DNA Marker, 1: pFC334 vector before double enzyme digestion; 2: pFC334 vector after double enzyme digestion Fig.7 Double enzyme digestion of pFC332 vector and pFC334-AarⅠ vector. M: 15 kb DNA Marker, 1: pFC332 vector after double enzyme digestion; 2: pFC334-AarⅠ vector after with double enzyme digestion Fig.8 Identification of PFC332-gRNA-AarⅠ positive colonies. M: 15 kb DNA Marker, 1: negative control (without template); 2: pFC332; 2-12: Single colonies selected Fig.9 Single enzyme digestion of pFC332-gRNA-AarⅠ vector. M: 15 kb DNA Marker, 1: negative control; 2: pFC332-gRNA-AarⅠ vector after single enzyme digestion
3 讨 论
国内外已有大量研究证实,黑素在病原体的毒力中发挥重要作用,比如烟曲霉、皮炎外瓶霉、新生隐球菌等。在烟曲霉等感染中,黑素(同为DHN-黑素)可阻断TLRs免疫活化,影响巨噬细胞自噬的激活从而影响病原体清除。本课题组前期将临床分离株SUMS0505多次传代获得白化突变株,对F.monophora色素株和白化株进行研究,证实了F.monophora黑素能引起巨噬细胞TLR-2、TLR-4以及Dectin-1等受体的差异性表达[14]及Th1/Th2细胞免疫反应失衡[15],证明F.monophora黑素与毒力相关,可引起巨噬细胞免疫调节失衡来抗衡杀伤作用。但黑素是如何影响宿主对F.monophora的免疫反应,是否与慢性感染的形成有关,这些相关机制尚不十分明确。据文献报道F.pedrosoi的黑素可引起Th1/Th2 免疫应答失衡,Th1反应受限致细胞免疫功能低下,抑制NO产生,直接减弱了对F.pedrosoi的杀伤能力,而Th2反应偏倚,促进了肉芽肿和纤维化的形成[16]。其次,黑素本身具有一定的免疫活性,能影响细胞因子的分泌,调节宿主的免疫反应类型[17-18],与真菌的致病性密切相关,是非常重要的毒力因子。因此,本研究选择敲除F.monophora黑色素的生物合成途径中的PKS1基因,对研究黑素在F.monophora中的作用,以及阐明黑素引起的着色芽生菌病的发病机制极为重要。
CRISPR/Cas9技术仅由两个元件组成,Cas9核酸酶和由两个小RNA组成的单导RNA(sgRNA),即可对特异序列的外源DNA进行识别、剪切[19-20],具有特异性强、效率高、多功能性和易操作性等优势,并且有不少报道在真菌生物中成功实现了对靶基因的定向编辑。Fuller等[21]利用CRISPR/Cas9系统对烟曲霉(A.fumigatus)中的基因进行敲除,并且证明了Cas9本身不影响菌体的生长发育和毒力,表明了该系统适用于真菌致病机理及基因功能的研究。目前在丝状真菌研究领域中,CRISPR/Cas9技术已得到广泛应用,如在曲霉属(Aspergillus)[22]、链格孢霉(Alternariaalternata)[23]、里氏木霉(Trichodermareesei)[24]、水稻稻瘟病菌(Pyriculariaoryzae)[25]、玉米黑粉菌(Ustilagomaydis)[26]等,说明CRISPR/Cas9系统对丝状真菌基因编辑的可操作性。本研究获得了具有Cas9基因、潮霉素抗性基因和gRNA骨架的双元载体pFC332-gRNA-AarⅠ,且成功构建了由Cas9介导的PKS1基因敲除载体,为研究F.monophora的PKS1基因及DHN-黑素的功能研究奠定了基础。
